二烯丙基二硫化物诱导G2/M期阻滞对卵巢癌细胞增殖和凋亡的影响
2019-03-06张瑞涛史惠蓉刘哲颖姬鹏程
张瑞涛,史惠蓉,任 芳,刘哲颖,姬鹏程
郑州大学第一附属医院妇科,郑州 450052
卵巢癌是女性生殖系统常见恶性肿瘤之一,手术和化疗是临床治疗卵巢癌患者的主要手段,缺乏早期诊断手段、易于产生铂类药物化疗耐药是卵巢癌患者预后不良的主要原因,导致其死亡率高居女性生殖系统恶性肿瘤首位[1- 2]。因此,寻找具有抗肿瘤活性的传统中药材和植物提取物可为卵巢癌患者的临床治疗提供新的选择。二烯丙基二硫化物(diallyl disulfide,DADS)是大蒜主要的脂溶性有效成分之一,研究表明DADS对多种恶性肿瘤细胞,如胃癌、结肠癌、乳腺癌、非小细胞肺癌、前列腺癌、膀胱癌、白血病等肿瘤细胞具有抑制作用,可抑制肿瘤细胞增殖,诱导细胞分化和凋亡,抑制细胞侵袭和转移,导致细胞周期G2/M期阻滞等[3- 9]。细胞内外DNA损伤信号导致细胞周期 G2/M期阻滞的主要分子机制是通过调节Chk1/2-CDC25C通路和P53通路活性,进而抑制CyclinB1/CDK1复合物的活性和进入细胞核,最终引起G2/M期阻滞[10]。目前尚无DADS对卵巢上皮性癌细胞增殖和凋亡影响的相关报道,本研究初步探讨了DADS对卵巢癌SK-OV- 3、OVCAR- 3细胞增殖和凋亡的影响及其可能的分子机制。
材料和方法
细胞株和实验动物人上皮性卵巢癌细胞系SK-OV- 3、OVCAR- 3细胞,购自中国典型培养物保藏中心(武汉大学保藏中心)。BALB/C nu/nu雌性裸鼠18只,购自北京维通利华有限公司,鼠龄4~5周,体质量10~15 g。
主要试剂和抗体RPMI 1640完全培养基购自美国Hyclone公司,MTT、DADS购自美国Sigma-Aldrich公司。将DADS与Tween 80以1∶2比例充分溶解,加入0.9%生理盐水稀释100倍,震荡混匀,并以RPMI 1640完全培养基分别稀释至终浓度为5、10、20、30 mg/L的工作液备用。顺铂(Cisplatin,DDP)为山东齐鲁制药厂产品,加入0.9%生理盐水稀释100倍,并以RPMI 1640完全培养基分别稀释至终浓度为5、10、20、30 mg/L的工作液备用。鼠抗人检验点蛋白激酶1(checkpoint kinase 1,Chk1)单克隆抗体(单抗)、鼠抗人Chk2单抗、鼠抗人细胞分裂磷酸酶25C(cell division phosphostase 25C,CDC25C)单抗、山羊抗人p-CDC25C(ser216)多克隆抗体(多抗)、兔抗人p-CDK1(Thr14/Tyr15)多抗、鼠抗人细胞周期蛋白B1(CyclinB1)单抗、鼠抗人转录靶因子生长阻滞及DNA损伤基因45α(growth arrest and DNA damage-indueible gene 45α,GADD45α)单抗、鼠抗人14- 3- 3σ单抗、山羊抗人Ki- 67多克隆抗体购自美国Santa Cruz Biotechnology公司,兔抗人细胞周期依赖激酶1(cyclin dependent kinase 1,CDK1)多抗、鼠抗人P53单抗、兔抗人p-P53(ser15)多抗、山羊抗人p-Chk1(ser345)多抗、兔抗人p-Chk2(Thr68)单抗、鼠抗人P21WAF1多抗、鼠抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体、兔抗人Survivin单克隆抗体、鼠抗人Cleaved-caspase3单克隆抗体、膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(FITC)细胞凋亡检测试剂盒、蛋白免疫印迹及免疫沉淀蛋白裂解液购自江苏碧云天生物技术公司,增强化学发光(ECL)试剂盒、兔抗人β肌动蛋白(β-actin)单抗、鼠抗兔单克隆IgG购自北京中杉金桥科技有限公司。
细胞培养及分组SK-OV- 3、OVCAR- 3细胞接种于6孔板中,用含有10%胎牛血清的RPMI 1640完全培养基在37 ℃、5% CO2、相对湿度90%的培养箱中培养,至对数生长期收集细胞,用于后续实验。根据不同处理,分别将SK-OV- 3和OVCAR- 3细胞分为空白处理组、DADS处理组(实验组)和顺铂处理组(阳性对照组)3组。
MTT法检测细胞增殖能力分别将SK-OV- 3、OVCAR- 3细胞按1×104个/孔接种于96孔板,培养24 h后分别加入含DADS和顺铂(终浓度分别为5、10、20、30 mg/L)的培养基,每浓度均设5个复孔,另设5个空白处理细胞孔。分别继续孵育12、24、48 h后更换成普通培养基,继续培养24 h后每孔加入5 mg/ml MTT液20 μl,4 h后弃去上清液,每孔加入150 μl二甲基亚砜(DMSO)溶液,于摇床上低速振荡10 min,置酶标仪于492 nm波长处测定各孔的吸光度(A)值,计算细胞生长抑制率,抑制率(%)=(1-A实验组/A对照组)×100%(各组细胞分别以空白处理组细胞为对照组,其余浓度组为实验组),LOGIT法计算软件计算半数抑制浓度(IC50),相同实验分别重复3次。
流式细胞术检测细胞凋亡用含DADS和顺铂(终浓度分别为5、10、20、30 mg/L)的培养基分别处理对数生长期的SK-OV- 3、OVCAR- 3细胞12、24、48 h,另设空白处理细胞组,用不含乙二胺四乙酸(EDTA)的胰酶消化,冰磷酸盐缓冲液(PBS)洗涤细胞2次,1000 r/min(r=8 cm)离心5 min,各组分别收集1×105个细胞,弃上清液,加入195 μl Annexin Ⅴ-FITC结合液重悬细胞,然后加入5 μl Annexin Ⅴ-FITC轻轻混匀后,再加入10 μl碘化丙啶混匀,室温、避光孵育15 min,冰浴后立即置流式细胞仪(美国BD公司)检测细胞凋亡情况,采用Cell Quest软件(美国BD公司)分析细胞凋亡率。实验重复3次。
裸鼠实验模型检测卵巢癌细胞移植瘤体积按照SPF标准饲养的18只裸鼠随机分为空白处理组、DADS处理组、顺铂处理组3组,每组6只裸鼠,无菌操作将300 μl细胞悬液分别注射于各组裸鼠右前肢腋下皮肤下,SK-OV- 3、OVCAR- 3细胞各注射3只裸鼠,每只裸鼠注射107个细胞。自注射当日起每日观察裸鼠情况,注射第10日起分别给予腹腔注射生理盐水、50 mg/kg DADS生理盐水溶液、50 mg/kg顺铂生理盐水溶液1次,以后每4 d注射1次,共注射5次。自注射当日起第30日颈椎脱臼处死裸鼠,剥离肿瘤进行测量。游标卡尺分别测量皮下结节的最大长径及与其垂直的宽径,肿瘤体积计算公式为:体积(mm3)=宽2×长/2。动物实验方案符合中国实验动物制度伦理审查委员会关于动物实验的指导方针,并经郑州大学第一附属医院伦理委员会批准。
流式细胞术检测细胞周期分布用普通培养基、含30 mg/L DADS的培养基、含30 mg/L顺铂的培养基分别处理对数生长期的SK-OV- 3、OVCAR- 3细胞24 h,用不含乙二胺四乙酸(EDTA)的胰酶消化,分别收集3组细胞各1×106个,PBS漂洗细胞2次,70%冰乙醇固定24 h,洗涤离心后加入含100 mg/L核糖核酸酶A的碘化丙啶,室温避光染色后采用FACScalibur流式细胞仪(美国BD公司)检测细胞周期时相变化,ModFit流式细胞周期分析软件(美国Verity Software House公司)分析结果。
Westernblot检测用普通培养基、含30 mg/L DADS的培养基分别处理SK-OV- 3、OVCAR- 3细胞24 h后更换成普通培养基,蛋白裂解液提取上述2组细胞总蛋白,采用考马斯亮蓝法(Bradford法)检测蛋白浓度,控制样品浓度在1~3 mg/ml。各组均取30 μg总蛋白进行10%十二烷基硫酸钠(SDS)-聚丙烯酰氨凝胶(PAGE)电泳,恒压20 V,利用Trans-Blot半干转印系统(美国BIO-RAD公司)转移至聚偏二氟乙烯(PVDF)膜,含5%脱脂奶粉、0.05%吐温20枸
橼酸盐缓冲液(TBST)室温封闭2 h,按每种目的蛋白一抗说明书建议浓度4 ℃孵育过夜,相应二抗IgG(1∶2000)室温孵育2 h。ECL法检测试剂盒显色后曝光,Image Pro-Plus 6.0软件(美国Media Cybernetics公司)分析各目的蛋白条带的灰度值,以β-actin为内参照,分别计算各目的蛋白的相对表达水平。实验重复3次。

结 果
DADS对卵巢癌SK-OV-3和OVCAR-3细胞增殖的影响MTT法检测显示,不同浓度的DADS作用SK-OV- 3(F=247.86,P=0.000)和OVCAR- 3细胞(F=302.54,P=0.000)后,随着DADS浓度增高,细胞增殖抑制率明显升高,呈浓度依赖性。DADS处理24 h时SK-OV- 3(F=335.12,P=0.000)和OVCAR- 3细胞(F=347.43,P=0.000)的增殖抑制率明显高于处理12 h和48 h时的细胞抑制率,呈明显的时间依赖性。顺铂对SK-OV- 3(F=289.35,P=0.000)和OVCAR- 3细胞(F=411.26,P=0.000)增殖的抑制呈浓度依赖性,但未观察到明显的时间依赖性(图1、表1)。

DADS:二烯丙基二硫化物;DDP:顺铂;与同一组细胞其他处理浓度、其他处理时间相比,aP<0.05
DADS:diallyl disulfide;DDP:cisplatin;aP<0.05 compared with other dose or other time in the same cell group
A.SK-OV- 3;B.OVCAR- 3
图1MTT检测不同浓度的DADS和顺铂处理不同时间对卵巢癌细胞增殖的影响
Fig1Effects of different doses of DADS and DDP on the proliferation of ovarian cancer cells at different time points measured by MTT assay

表1 DADS和顺铂处理卵巢癌细胞不同时间的IC50值(n=5,-±s,mg/L)Table 1 The IC50 values of DADS and DDP in ovarian cancer cells at different time points(n=5,-±s,mg/L)
DADS:二烯丙基二硫化物;DDP:顺铂;与同一组细胞处理12、48 h相比,aP<0.05
DADS:diallyl disulfide;DDP:Cisplatin;aP<0.05 compared with 12,48 h in the same cell group
DADS对卵巢癌SK-OV-3和OVCAR-3细胞凋亡的影响流式细胞术检测结果显示,不同浓度的DADS作用SK-OV- 3、OVCAR- 3细胞后,随着DADS浓度的增高,细胞凋亡率明显升高,呈明显的浓度依赖性(P<0.05)。DADS处理24 h时SK-OV- 3和OVCAR- 3细胞的凋亡率明显高于处理12 和48 h时,呈明显的时间依赖性(P<0.05)。顺铂对SK-OV- 3和OVCAR- 3细胞凋亡的影响呈浓度依赖性(P<0.05),但未观察到明显的时间依赖性(表2、3)。
DADS对卵巢癌SK-OV-3和OVCAR-3细胞裸鼠移植瘤体积的影响所有裸鼠均形成皮下移植瘤,处死裸鼠后空白处理组、DADS处理组和顺铂处理组SK-OV- 3细胞移植瘤体积分别为(2050.95±215.75)、(575.17±85.94)和(206.83±16.29)mm3;空白处理组、DADS处理组和顺铂处理组OVCAR- 3细胞移植瘤体积分别为(799.74±70.71)、(534.11±24.89)和(246.57±56.78)mm3;与空白处理组相比,腹腔注射DADS溶液可明显抑制卵巢癌细胞的裸鼠移植瘤体积(F=548.23,P=0.000;F=311.84,P=0.000),但其抑瘤效果明显弱于顺铂(F=291.46,P=0.001;F=175.12,P=0.007)(图2)。
DADS对卵巢癌SK-OV-3和OVCAR-3细胞周期的影响分别将30 mg/L的DADS和顺铂作用于SK-OV- 3和OVCAR- 3细胞24 h后,与空白处理细胞相比,DADS处理后的SK-OV- 3和OVCAR- 3细胞中处于G2期的细胞百分率明显增加(F=375.11,P=0.000;F=256.48,P=0.000),而顺铂处理后则增加卵巢癌细胞S(F=315.43,P=0.000;F=208.49,P=0.000)和G2期细胞数目(F=387.16,P=0.000;F=223.53,P=0.000)(图3、4)。

表2 流式细胞术检测不同浓度DADS作用于卵巢癌细胞后的凋亡率(n=3,-±s,%)Table 2 The apoptosis rates of ovarian cancer cells after treatment with different doses of DADS measured by flow cytometry(n=3,-±s,%)
与相同处理时间细胞其他处理浓度相比,aP<0.05;与同浓度细胞处理12、48 h相比,bP<0.05
aP<0.05 compared with other dose in the same time point group;bP<0.05 compared with 12 h and 48 h in the same dose group

表3 流式细胞术检测不同浓度顺铂作用于卵巢癌细胞后的凋亡率(n=3,-±s,%)Table 3 The apoptosis rates of ovarian cancer cells after treatment with different doses of DDP measured by flow cytometry(n=3,-±s,%)
与相同处理时间细胞其他处理浓度相比,aP<0.05
aP<0.05 compared with other dose in the same time point group
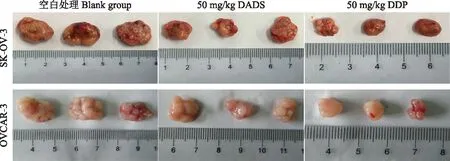
图2腹腔注射DADS和顺铂溶液对卵巢癌细胞裸鼠移植瘤体积的影响
Fig2Effects of DADS and DDP intraperitoneal injection on the xenograft tumor volumes of ovarian cancer cells

图3流式细胞术检测 DADS和顺铂作用卵巢癌细胞24 h后的细胞周期分布情况
Fig3Effects on the cell cycle phase distribution of ovarian cancer cells treated with of DADS and DDP for 24 h(measured by flow cytometry assay)

与空白处理组细胞S期细胞数目相比,aP<0.05;与空白处理组细胞G2期细胞数目相比,bP<0.05
aP<0.05 compared with the S phase cell numbers of blank groups;bP<0.05 compared with the G2 phase cell numbers of blank groups
A.SK-OV- 3;B.OVCAR- 3
图4流式细胞术检测DADS和DDP作用卵巢癌细胞24 h后的细胞周期分布情况
Fig4Effects on the cell cycle phase distribution of ovarian cancer cells treated with of DADS and DDP 24 h measured by flow cytometry
DADS对卵巢癌细胞中G2/M检验点、增殖和凋亡相关蛋白表达的影响将30 mg/L DADS分别作用于SK-OV- 3和OVCAR- 3细胞24 h后,p-Chk1(ser345)(F=108.89,P=0.013;F=97.58,P=0.018)、p-CDC25C(ser216)(F=87.25,P=0.025;F=114.25,P=0.009)、p-P53(ser15)(F=112.41,P=0.011;F=255.87,P=0.000)、P21WAF1(F=246.38,P=0.001;F=141.36,P=0.005)和p-CDK1(Thr14/Tyr15)蛋白(F=298.12,P=0.000;F=233.15,P=0.000)的表达明显增加,CDK1(F=308.24,P=0.000;F=257.55,P=0.000)和CyclinB1蛋白(F=223.15,P=0.001;F=241.28,P=0.000)的表达明显减少,Chk1、Chk2、p-Chk2(Thr68)、CDC25C、P53、GADD45α、14- 3- 3σ蛋白的表达无明显变化(P均>0.05)。此外,增殖和凋亡相关蛋白PCNA(F=77.36,P=0.031;F=157.28,P=0.001)、Ki- 67(F=205.64,P=0.007;F=315.22,P=0.000)和Survivin蛋白(F=122.13,P=0.013;F=188.24,P=0.000)表达明显减少,Cleaved-caspase3蛋白表达明显增加(F=86.46,P=0.023;F=99.11,P=0.009)(图7、8)。

Mr:相对分子质量
Mr:relative molecular mass
图5Western blot检测DADS对卵巢癌细胞G2/M检验点相关蛋白表达的影响
Fig5Effects of DADS on the expressions of G2/M checkpoint related proteins of ovarian cancer cells measured by Western blot

与空白处理组细胞相比,aP<0.05
aP<0.05 compared with blank cell group
A.SK-OV- 3;B.OVCAR- 3
图6Western blot检测DADS对卵巢癌细胞G2/M检验点相关蛋白表达的影响
Fig6Effects of DADS on the expressions of G2/M checkpoint related proteins of ovarian cancer cells(measured by Western blot)

图7Western blot检测DADS对卵巢癌细胞增殖和凋亡相关蛋白表达的影响
Fig7Effects of DADS on the expressions of proliferation and apoptosis related proteins of ovarian cancer cells(measured by Western blot)
讨 论
持续的生长信号刺激、逃避生长抑制和抵抗程序性死亡都是肿瘤细胞重要的生物学特性,细胞增殖和凋亡的关系失调是造成肿瘤发生、发展的重要因素[11- 12]。大蒜的主要有效成分为多种烯丙基硫化物,合称为大蒜素,其主要成分为脂溶性的二烯丙基三硫化物(diallyl trisulfide,DATS)和DADS,大蒜素具有抗菌、抗血小板聚集、抗氧化应激、调节免疫反应、抗肿瘤等较多生物学作用[13- 14]。大蒜素的主要成分之一DADS可抑制多种致癌物质导致的肿瘤性疾病的发生,还对多种肿瘤细胞具有直接抑制作用[15- 17]。研究表明,DADS可以通过抗氧化应激、调节癌基因和抑癌基因表达、调控凋亡相关调节蛋白表达、影响端粒酶活性、诱导细胞周期G2/M期阻滞等多个环节抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡,进而发挥抗肿瘤的作用[18- 20]。

与空白处理组细胞相比,aP<0.05
aP<0.05 compared with blank group
图8Western blot检测DADS对卵巢癌细胞增殖和凋亡相关蛋白表达的影响
Fig8Effects of DADS on the expressions of proliferation and apoptosis related proteins of ovarian cancer cells(measured by Western blot)
G2/M检验点是细胞周期中除G1/S检验点之外最重要的细胞检测点,CDK1蛋白是G2/M期传导网络的核心因子,CyclinB1/CDK1复合物是真核细胞有丝分裂G2/M期转换所必需的蛋白激酶[21]。在细胞周期G2/M期,细胞内外DNA损伤信号可通过调节CDC25C通路和P53通路活性,进而抑制CyclinB1/CDK1复合物的活性和进入细胞核,最终引起细胞周期 G2/M期阻滞[10]。在哺乳动物中,DNA损伤信号主要由信号传导蛋白共济失调毛细血管扩张症突变基因(ataxia telangiectasa mutated,ATM)和ATM及Rad3同源基因(ATM and Rad3 related,ATR)传递至效应蛋白Chk1和Chk2,ATM/ATR可分别磷酸化Chk1的Ser345位点、Chk2的Thr68位点而激活Chk1、Chk2,进而磷酸化CDC25C的Ser216位点,导致CDC25C失活而不能去磷酸化激活CDK1,最终引起细胞G2/M期阻滞[22]。此外,DNA损伤后还可以直接或间接通过ATM/ATR磷酸化P53的Ser15位点而激活P53,P53进而通过其下游3个转录靶因子GADD45α、P21WAF1及14- 3- 3σ抑制CDK1活性,最终引起细胞G2/M期阻滞,其中P21WAF1是野生型p53基因最主要的调控靶因子[23]。CDK1蛋白的Thr14/Tyr15位点磷酸化和去磷酸化是调节CDK1活性的关键,CDK1的Thr14/Tyr15位点去磷酸化激活后进而调节CyclinB1/CDK1复合物的活性,只有活化的CyclinB1/CDK1复合物才能触发有丝分裂[24]。
近来有研究表明,DADS可引起胃癌BGC823细胞G2/M期阻滞,细胞中CyclinB1表达减少,P21、P53和GADD45α表达增加,沉默Chk1可部分消除DADS引起的CDC25C、CyclinB1表达减少和G2/M期阻滞[25]。另有研究显示,DADS处理食管癌细胞后导致细胞增殖受抑、G2/M期阻滞,可能与CyclinB1、CDK1、p-CDK1、CDC25C表达减少有关,同时伴有p53、p21 mRNA表达增加和MEK1/2-ERK1/2通路活性降低[26]。
本研究观察了DADS对卵巢癌细胞增殖和凋亡的影响,结果显示,DADS可以显著抑制卵巢癌SK-OV- 3和OVCAR- 3细胞的增殖,诱导其凋亡,具有明显的浓度和时间依赖性,并可明显抑制卵巢癌细胞裸鼠移植瘤的体积。进一步研究显示,DADS可使SK-OV- 3和OVCAR- 3细胞G2期细胞百分率增加,p-Chk1(ser345)、p-CDC25C(ser216)、p-P53(ser15)、P21WAF1、p-CDK1(Thr14/Tyr15)蛋白表达增加,提示DADS可引起卵巢癌细胞CDK1活性降低、细胞G2/M期阻滞,可能与G2/M检验点Chk1-CDC25C和P53-P21WAF1通路激活有关。此外,在本研究中还观察到CDK1、CyclinB1、PCNA、Ki- 67、Survivin蛋白表达明显减少,Cleaved-caspase3蛋白表达明显增加,提示DADS除了可以引起卵巢癌细胞CDK1活性降低之外,还可能直接抑制CDK1、CyclinB1蛋白表达,参与DADS诱导的卵巢癌细胞G2/M期阻滞,进而引起细胞增殖和凋亡能力发生变化。
综上,本研究结果提示DADS处理卵巢癌细胞后可引起细胞增殖受抑和凋亡增加,并呈时间和浓度依赖性,初步分析其分子机制可能与DADS引起卵巢癌细胞G2/M检验点Chk1-CDC25C和P53-P21WAF1信号通路激活、CDK1活性降低、CDK1和CyclinB1蛋白表达减少,最终导致卵巢癌细胞G2/M期阻滞等多个环节有关。卵巢癌患者原发性或获得性化疗耐药是临床亟待解决的问题,与传统抗肿瘤药物相比,大蒜素具有无不良反应、体内无残留等应用优势,进一步研究大蒜素主要成分之一DADS的卵巢癌抗肿瘤效果,有望为卵巢癌患者的临床治疗提供新的药物选择,具有潜在的临床价值和社会效益。
