衰老对于实验性小鼠结肠炎的影响及机制
2019-03-06刘爱玲汪红英钱家鸣
刘爱玲,汪红英,吕 红,钱家鸣
1中国医学科学院 北京协和医学院 北京协和医院消化科,北京 1007302中国医学科学院 北京协和医学院 肿瘤医院分子肿瘤学国家重点实验室,北京 100021
炎症性肠病(inflammatory bowel disease,IBD)患者多青年起病,但仍有约25%~35%患者老年起病[1]。老年患者的临床表现与青年患者有诸多不同,是否存在机制不同有待深入研究,其机制无外乎涉及免疫、肠道菌群、肠黏膜屏障改变等[2- 3]。衰老伴随着多种生理功能进行性减退[4]。免疫系统的老化,即免疫衰老,使机体易患感染、自身免疫性疾病、慢性炎症和肿瘤等。免疫衰老包括适应性和获得性免疫功能减退。年龄相关的免疫功能失调在衰老中发挥重要作用,研究发现炎症介质在其中起到一定作用[5]。正常的肠黏膜屏障可以阻挡病原微生物入侵,对于维持机体的健康具有重要作用[6]。肠黏膜屏障功能损伤可引起肠道渗透性增高、炎性因子增加、肠道菌群失调,从而引发IBD、肠易激综合征(irritable bowel syndrome,IBS)、乳糜泻等疾病。目前衰老是否引起肠黏膜屏障功能减退尚有争议[7]。Thevaranjan等[8]研究显示,衰老相关的肠道菌群失调可引起肠黏膜屏障功能减退和肠道渗透性增加,细菌及其产物进入循环系统,激活巨噬细胞,引发炎症反应。而Valentini等[9]研究认为,小肠黏膜屏障功能并未随机体衰老而减退。可见,衰老、肠黏膜屏障和炎症之间密切相关。目前关于老年和青年IBD发病机制差异方面的研究甚少,国内外尚未见老年和青年实验性小鼠结肠炎肠黏膜屏障方面的比较研究。本研究通过建立青年和老年实验性小鼠结肠炎模型,比较了炎症程度和肠黏膜屏障,研究了衰老对于实验性小鼠结肠炎的影响和与青年实验性小鼠结肠炎的不同及可能的机制。
材料和方法
实验动物和材料老年和青年雄性C57BL/6小鼠各10只,购自维通利华公司,老年鼠选取28周(体质量30~35 g)饲养至老年(56周,体质量40~43 g);青年组为6~8周(体质量20~25 g),适应性喂养1周后开始实验。葡聚糖硫酸钠(dextran sodium sulfate,DSS),相对分子质量36 000~50 000,购自美国MP Biomedicals公司;Trizol 和逆转录试剂盒均购自美国Life technology公司,SYBR Green染料采用日本Takara公司的SYBR Premix Ex TaqlI,抗体E-cadherin购自美国Cell Signaling公司,抗体occludin购自英国Abcam公司。
动物模型和分组青年和老年小鼠各分为对照组和实验组,每组5只,实验组小鼠急性结肠炎的造模方法为给予2%DSS 饮用水1~7 d,第8天处死;对照组小鼠给予自由饮用水,第8天处死。小鼠在建模和喂养过程中无死亡。
结肠炎症评估每天记录小鼠体质量、大便形态及大便带血情况,参照表1,给每只小鼠每天的3项指标评分,将3项评分相加得到当日疾病活动指数(disease activity index,DAI)。处死小鼠后取出结肠,测量结肠长度;切取远段结肠标本固定于福尔马林中,请病理科医生进行病理炎症评分。参照表2,3项指标各按受累范围的比例乘以相应系数(×1:0~25%;×2:26%~50%;×3:51%~75%;×4:76%~100%),相加即得病理评分。

表1 疾病活动指数计算方法Table 1 Disease activity index evaluation

表2 小鼠实验性结肠炎病理评分Table 2 Histological colitis scores in mice
实时荧光定量PCRTrizol一步法提取小鼠结肠组织总RNA,按试剂盒说明书进行逆转录。实时荧光定量PCR根据SYBR Green I方法进行相对定量分析,引物序列见表3。
透射电镜观察肠黏膜屏障超微结构小鼠处死后取近肛门的结肠组织0.5 cm固定于2.5%戊二醛溶液中,4 ℃保存。锇酸固定,乙醇脱水后包埋于环氧树脂中,制成超薄切片,透射电镜观察肠黏膜屏障。
Westernblot检测小鼠结肠组织E-cadherin和occludin蛋白将分离出的结肠组织用RIPA裂解液裂解后提取总蛋白,采用BCA蛋白测定法测定蛋白浓度,经过SDS-PAGE电泳、转膜、室温下封闭处理后加入1∶1000稀释的E-cadherin、1∶1000稀释的occludin、1∶10 000稀释的β-actin 一抗,4 ℃孵育过夜,TTBS洗涤3次,再加入二抗(山羊抗兔HRP抗体)室温孵育1 h,滴加ECL混合液,最后用富士LAS- 4000荧光化学发光成像仪显像。
免疫组织化学染色按常规步骤进行,抗原修复采用微波法,一抗 E-cadherin 1∶400稀释、occludin 1∶200稀释,4 ℃过夜,二抗采用二步试剂法。

表3 引物序列Table 3 Primer sequences in RT-PCR
TNF-α:肿瘤坏死因子-α;IL- 6:白细胞介素- 6;GAPDH:甘油醛- 3-磷酸脱氢酶
TNF-α:tumor necrosis factor-α;IL- 6:interleukin- 6;GAPDH:glyceraldehyde- 3-phosphate dehydrogenase
统计学处理采用GraphPad Prism 5.0软件进行绘图及统计学分析[10],符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两样本比较采用Mann-WhitneyU检验;P<0.05为差异有统计学意义。
结 果
老年和青年小鼠结肠炎症状比较
体质量:青年对照组小鼠平稳上升,老年对照组小鼠基本不变。实验组小鼠在DSS处理第4天开始出现持续下降,以老年实验组小鼠下降更明显(t=3.679,P=0.006)(图1A、B)。
DAI:老年实验组小鼠上升更明显(t=2.496,P=0.037)(图1C、D)。
结肠长度:实验组较对照组小鼠结肠长度明显缩短(青年实验组比青年对照组:t=5.583,P<0.001;老年实验组比老年对照组:t=6.162,P<0.001),老年和青年实验组小鼠间的结肠长度差异无统计学意义(t=1.983,P=0.083)(图1E、F)。
结肠病理:实验组小鼠可见结肠上皮破坏,隐窝丢失,炎症细胞浸润;老年实验组较青年实验组病理表现更为严重(U=0.000,P=0.008)(图2A、B)。
炎症因子:实验组小鼠TNF-α表达(青年实验组比青年对照组:U=2.169,P=0.062;老年实验组比老年对照组:U=6.500,P=0.246)和IL- 6表达(青年实验组比青年对照组:U=0.000,P=0.016;老年实验组比老年对照组:U=1.000,P=0.032)较对照组明显升高;老年对照组TNF-α(U=0.000,P=0.008)和IL- 6表达(U=1.000,P=0.032)较青年对照组明显升高,老年实验组IL- 6表达较青年实验组明显升高(U=4.000,P=0.191)(图2C、2D)。

aP<0.05,bP<0.01
A.小鼠体质量变化情况(n=5);B. 葡聚糖硫酸钠给药第7天各组小鼠体质量变化的比较(n=5);C.小鼠疾病活动指数变化情况(n=5);D. 葡聚糖硫酸钠给药第7天各组小鼠疾病活动指数比较(n=5);E.小鼠结肠大体表现;F.各组小鼠结肠长度比较(n=5)
A. body weight change (n=5);B. comparison of body weight changes of mice in each group on the 7st day from dextran sodium sulfate administration(n=5);C. disease activity index change(n=5);D. comparison of disease activity index of mice in each group on the 7st day from dextran sodium sulfate administration(n=5);E. macroscopic appearance;F. comparison of length of colon in each group(n=5)
图1青年和老年小鼠结肠炎症状比较
Fig1Comparison of colitis symptoms between young and aged mice
老年和青年小鼠结肠炎肠黏膜屏障功能比较
肠黏膜屏障结构:电镜下观察小鼠结肠上皮细胞间超微结构,可见青年对照组小鼠肠上皮细胞排列紧密,上皮细胞表面绒毛排列整齐,细胞间紧密连接(tight junction,TJ)、桥粒结构清晰;青年实验组小鼠肠上皮细胞表面绒毛稀疏,细胞间TJ结构的连续性和完整性被破坏;老年对照组小鼠肠上皮细胞间TJ结构不连续;老年实验组小鼠肠上皮表面绒毛稀疏,细胞间TJ模糊、肿胀,连续性和完整性被破坏(图3)。
结肠上皮细胞TJ和黏附连接蛋白表达:Western blot检测结果显示,老年(t=0.981,P=0.382;t=3.035,P=0.039)和青年(t=6.110,P=0.004;t=3.860,P=0.018)实验组小鼠结肠组织E-cadherin和occludin表达均明显低于相应对照组,老年对照组小鼠结肠组织E-cadherin(t=3.092,P=0.037)和occludin表达(t=2.564,P=0.062)明显低于青年对照组,老年实验组小鼠结肠组织E-cadherin(t=0.184,P=0.863)和occludin表达(t=0.399,P=0.710)明显低于青年实验组(图4)。免疫组织化学染色结果显示,E-cadherin、occludin主要表达在肠上皮细胞的胞浆和胞膜上,青年对照组E-cadherin和occludin染色的细胞数量较多且染色较深,青年实验组染色的细胞数量较少;老年对照组E-cadherin和occludin染色较浅,老年实验组基本上无染色(图5)。

TNF-α:肿瘤坏死因子-α;IL- 6:白细胞介素- 6;aP<0.05,bP<0.01
TNF-α:tumor necrosis factor-α;IL- 6:inter leukin- 6;aP<0.05,bP<0.01
A.小鼠结肠病理表现(HE);B.各组小鼠结肠病理评分比较(n=5);C.各组小鼠结肠组织TNF-α mRNA相对表达水平比较(n=5);D.各组小鼠结肠组织IL- 6 mRNA相对表达水平比较(n=5)
A. histologic images of mice colon(HE);B. comparison of histological colitis score in each group(n=5);C. comparison of TNF-α mRNA relative expression of colon in each group(n=5);D. comparison of IL- 6 mRNA relative expression of colon in each group(n=5)
图2青年和老年小鼠结肠病理表现和炎症因子表达的比较
Fig2Comparison of pathological manifestations and inflammatory cytokines between young and aged mice
讨 论
目前国内外对于老年和青年IBD发病机制的研究甚少。本研究通过建立老年实验性小鼠结肠炎模型,比较了老年和青年实验性小鼠结肠炎肠黏膜屏障功能,结果显示,衰老本身不会引起结肠炎,但会加重DSS诱发的小鼠结肠炎;衰老引起肠上皮细胞间TJ、黏附连接(adherent junction,AJ)损伤,直接影响肠黏膜屏障功能,从而加重结肠炎症状。
研究衰老机制的动物模型包括自然衰老小鼠和快速衰老小鼠 (senescence accelerated mouse,SAM)。普通小鼠寿命为2~2.5年,SAM寿命约1年。后者的特征为出现快速老化症状,如学习功能障碍等,故较广泛用于中枢神经系统疾病的研究中[11]。目前尚不清楚两者在肠道菌群、肠黏膜屏障等方面的差异。现采用的自然衰老小鼠寿命多大于1年,故本研究采用大于56周龄的自然衰老小鼠。DSS诱导的结肠炎与人类溃疡性结肠炎存在众多相似性,因而应用广泛[12]。本研究给予2%DSS饮用水7 d,小鼠出现体质量下降、腹泻、便血,结肠病理可见结肠上皮破坏,隐窝丢失,炎症细胞浸润等。提示DSS诱导的小鼠结肠炎模型建立成功。

图3透射电镜观察肠上皮细胞超微结构
Fig3Ultrastructure of intestinal epithelial cells by transmission electron microscopy

Mr:相对分子质量;aP<0.05,bP<0.01
Mr:relative molecular mass;aP<0.05,bP<0.01
A.小鼠结肠组织E-cadherin蛋白表达情况;B.各组小鼠结肠组织E-cadherin蛋白相对表达量比较(n=5);C.小鼠结肠组织occludin蛋白表达情况;D 各组小鼠结肠组织occludin蛋白相对表达量比较(n=5)
A. protein expression of E-cadherin in colon by Western blotting;B. quantitative analysis of E-cadherin protein in each group (n=5);C. protein expression of occludin in colon by Western blotting;D. quantitative analysis of occludin protein in each group(n=5)
图4小鼠结肠组织E-cadherin蛋白和occludin蛋白表达情况
Fig4Protein expressions of E-cadherin and occludin in colons of aged and young mice
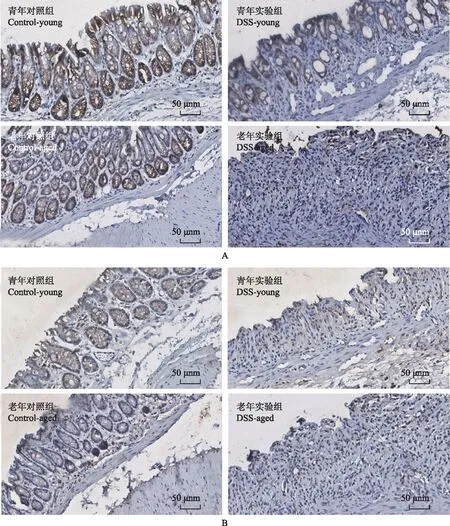
A.E-cadherin在肠上皮细胞的表达分布;B.occludin在肠上皮细胞的表达分布
A. E-cadherin expression in intestinal epithelial cell;B. occludin expression in intestinal epithelial cell
图5免疫组织化学染色结果
Fig5Immunohistochemical results
本研究中,老年小鼠在饲养过程中,进食、饮水量减少,活动减少,体质量基本保持不变。与青年对照组比较,老年对照组结肠组织IL- 6表达水平较高,与多数研究结果一致,即衰老过程伴随促炎因子水平升高[13]。年龄相关的炎症因子水平升高常伴有免疫系统损伤,引起老年人的健康状况下降[5]。年龄相关的炎症因子水平升高是老年患者感染、住院、死亡的危险因素[14- 15]。目前尚不清楚衰老过程中炎症水平升高的具体机制。
本研究结果显示,衰老加重了实验性小鼠结肠炎。具体表现为,与青年实验组比较,老年实验组体质量下降更为明显、DAI评分更高,病理表现严重及炎症因子表达增加。与Albert等[16]研究结果一致,该研究显示,Toll样受体(Toll like receptor,TLR)缺乏会加重DSS小鼠结肠炎。而Boulard等[17]进一步研究显示,TLR对于维持正常的肠黏膜屏障功能具有重要作用。
肠上皮细胞呈单层柱状紧密排列,细胞间存在多种连接复合物,包括TJ、AJ和桥粒等,在维持肠黏膜屏障功能及其通透性中发挥重要作用。Claudin和occludin共同组成TJ主体,并通过Zo- 1与细胞内骨架蛋白连接[18]。E-cadherin为钙离子依赖的细胞间AJ分子,在形成组织结构、抑制肿瘤方面均具有重要作用[19]。本研究从TJ、AJ方面进行老年和青年小鼠肠黏膜屏障功能比较。通过电镜观察肠上皮细胞的超微结构,结果发现老年对照组小鼠肠上皮细胞间TJ结构不连续,而青年实验组和老年实验组肠上皮细胞表面绒毛疏松,细胞间TJ结构破坏。另外,通过检测结肠组织的E-cadherin和occludin的蛋白表达量还发现,老年小鼠肠黏膜E-cadherin和occludin的表达量均较青年小鼠低,提示老年肠道黏膜的屏障功能较青年弱。Ren等[20]发现,老年小鼠肠黏膜屏障功能损伤可能与TJ结构破坏、TJ蛋白(Zo- 1、occludin)表达减少相关,本研究结果与之一致。除了进行老年和青年健康小鼠肠黏膜屏障功能的比较外,本研究还进行老年和青年实验性小鼠结肠炎肠黏膜屏障方面的比较。在给予相同浓度的DSS处理后,我们发现老年小鼠E-cadherin和occludin表达亦较青年小鼠下降;可见无论是肠道黏膜的基础屏障功能还是DSS处理后的屏障功能在老年鼠均较青年鼠下降更明显,推测衰老本身可能是其中的危险因素之一,而老年结肠炎的症状较为严重可能与之有关。衰老导致肠黏膜屏障功能减退的机制尚不明确。Suzuki等[21]发现,IL- 6通过增加肠上皮细胞的claudin- 2蛋白表达升高肠黏膜的渗透性,其作用依赖于MEK/ERK和PI3K/Akt信号通路。本研究结果显示,老年小鼠的结肠组织IL- 6表达较青年小鼠高,而这可能与肠黏膜屏障功能减退、渗透性升高有关。
综上,本研究结果发现,衰老会加重DSS诱发的小鼠结肠炎,其机制可能与年龄相关的肠上皮细胞的TJ、AJ损伤,从而导致肠黏膜屏障功能减退有关;而后者可能通过衰老过程中IL- 6水平升高引起。本研究的不足之处在于,小鼠的数量较少,存在个体差异,需要后续深入研究其机制。
