ABI Quantistudio Dx实时定量PCR仪HBV-DNA检测的性能验证
2019-03-06李鹏飞张艳辉
李鹏飞,高 峰,张艳辉
乙型肝炎严重影响人们的生活质量。目前,由于乙肝疫苗的推广及抗病毒药物的使用,乙肝发生率大大降低[1],但乙肝感染仍然是威胁人类健康的主要原因。乙肝病毒DNA检测定量对于评估抗病毒治疗、免疫应答监控及耐药检测至关重要。实时定量PCR是定量检测HBV-DNA的常用方法。检测系统性能评价是临床实验室检验质量管理的重要内容之一。GB/T 22576-2008文件规定:临床实验室应当验证厂家提供的检验方法或试剂盒相关分析性能以评估其性能指标是否符合预期[2]。要求性能验证至少应包括精密度、正确度、线性、测量和(或)可报告范围等内容[3]。本研究通过对相关文件进行认真解读,设计实验方案,参考实验室所用中山达安公司生产的HBV-DNA定量试剂盒中有关产品性能指标,旨在验证本室ABI QuantistudioDx实时荧光定量 PCR仪性能。
1 材料与方法
1.1 仪器与试剂 实时定量PCR仪(美国ABI Quantistudio Dx公司),高速冷冻离心机5804R(德国eppendorf Centrifuge公司),MK-10干式恒温器(杭州奥盛公司)、SteriGard 生物安全柜(Baker公司)及配套有关型号的加样枪等。乙型肝炎病毒核酸检测试剂盒PCR-荧光探针法由中山达安公司提供,试剂批号:2017001。
1.2 标本 质控品和标准品为中山达安乙型肝炎病毒核酸检测试剂盒配套。室间质评标本由卫生部临床检验中心发放。检测样本取自南京中医药大学附属医院门诊及住院患者。
1.3 方法
1.3.1 HBV提取及检测 按照本实验室提供的SOP操作规程进行核酸提取及HBV DNA PCR扩增。
1.3.2 精密度验证 选取配好的高浓度(1.00×106U/ml)、低浓度(1.00×104U/ml)样本进行检测。批内精密度评价标本测定按照规定的操作方法[4],在1 d内各做20次重复测定,计算均值、标准差与变异系数。批间精密度选择室内质控作为衡量批间精密度的依据。选取检测20 d的数据,计算均值、标准差与变异系数。与厂家声明的批内精密度进行比较,做出判断。依据 CNAS-CL02-A009:2018《医学实验室质量和能力认可准则在分子诊断领域的应用说明》[3],以PT/EPA评价界限(靶值±0.4对数值)作为允许总误差(TEa),要求批内精密度小于3/5 TEa,批间精密度小于4/5 TEa。
1.3.3 正确度评价 检测卫生部临检中心2017年提供的室间质评样本,检测结果与已知靶值和可接受限进行比对。项目能力验证成绩≥80%,则判定通过。
1.3.4 检出限验证 根据EP6-A文件[5],将中山达安乙型肝炎病毒核酸检测试剂盒提供的2.00×103浓度标准品(试剂批号:2017001)用阴性血清进行梯度稀释,浓度分别为1000、100、50、30、15、10、5、2.5 U/ml。ABI Quantistudio Dx实时定量PCR仪对每份样本进行重复检测10次。然后,计算CV%, 以检出率为100%的浓度定为检出限。
1.3.5 线性范围评价 根据 EP6-A 文件[5],用阴性血清将患者血清(浓度为3.00×108U/ml)梯度稀释,样本终浓度为1.00×108、1.00×107、1.00×106、1.00×105、1.00×104、1.00×103、1.00×102U/ml,样本在当天完成全部检测。每个浓度样本重复测定3次,检查数据有无离群值。根据检测结果得出线性回归方程,计算线性相关系数,进行线性范围验证。
1.4 统计学处理 采用SPSS 16.0 软件计算其均值、标准差与变异系数,所有 HBV-DNA 浓度数据均转化为对数进行分析。
2 结 果
2.1 精密度验证结果 待验证的样本与室内质控品以及标准品同时进行DNA提取及HBV DNA的定量扩增,并进行数据分析及计算。按照CNAS-CL02-A009:2018医学实验室质量和能力认可准则在分子诊断领域的应用说明附件A.2说明,以PT/EPA评价界限(靶值±0.4对数值)作为允许总误差(TEa),要求批内精密度小于3/5 TEa,批间精密度小于4/5 TEa。从表1中可以看出,精密度验证结果符合相关要求,结果通过。而且,厂家声明的批内及批间的检测浓度对数值的CV小于5%,本次结果在其范围之内。

表1 实时定量PCR仪精密度结果
2.2 正确度结果 利用ABI Quantistudio Dx 实时定量PCR仪检测2017年卫生部临床检验中心室间质评样本5例。从表2可以看出,阳性标本检测结果,均在评价允许范围内。其中最大的偏倚为-7.10%。室间质评PT成绩100分,测量准确。
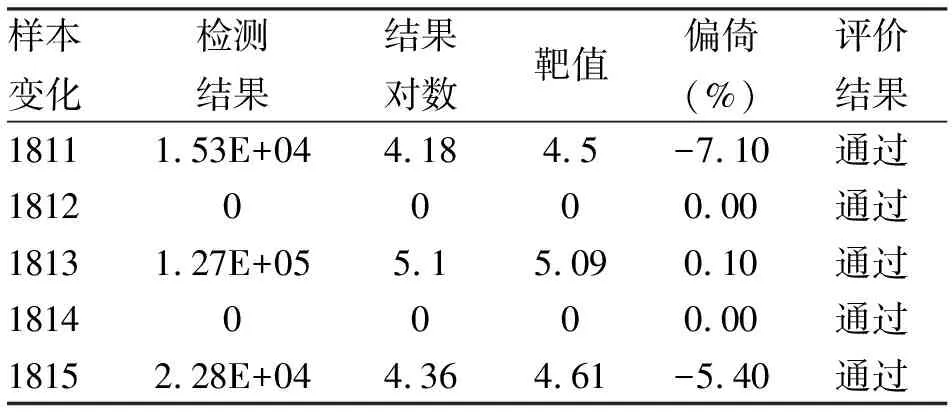
表2 2017年卫生部临检中心实时定量PCR仪HBV-DNA定量室间质评结果
2.3 检出限验证结果 评价浓度为1000、100、50、30 、15 、10 、5 、2.5 U/ml的样本的检出情况。结果显示,检出率分别为100%、100%、100%、60%、20%、0%、0%、0%。再计算各浓度样本的总CV%。检出率100%对应浓度样本的CV%都小于5%。根据厂家声明,以检出率为100%的浓度作为检出限。由此可以看出,本系统的检出限为50 U/ml。
2.4 线性范围验证结果 本研究选取的患者标本,其浓度为3.00×108U/ml。将该浓度进行10倍梯度稀释,最终浓度分别为1.00×108、1.00×107、1.00×106、1.00×105、1.00×104、1.00×103、1.00×102U/ml。检测结果以对应标本浓度对数为横坐标,Ct值为纵坐标,进行相关线性回归分析。相关系数R2=0.99794,方程为Y=-3.54050X+35.20098(图1)。进一步以标本浓度的期望对数值为横坐标,实测对数值为纵坐标,做线性回归分析(图2),Y=1.0001X,R2=0.9976线性关系符合要求,线性范围为1×102~1×108U/ml。符合厂家声明的线性范围。

图1 实时定量PCR仪检测标准曲线

图2 实时定量PCR仪检测线性范围验证回归曲线
3 讨 论
临床基因扩增实验室检测项目操作步骤繁琐,包括标本处理、核酸提取及基因扩增,与临检、生化及免疫项目检测步骤相比,自动化程度较低,且不同的操作人员及实验室硬件条件都会影响检测结果。因此,性能验证是基因检测实验室欠缺和亟待提高的重要内容。对于一些自建检测系统,应有方法学验证过程[6]。
HBV-DNA实时定量PCR检测所用仪器及检测试剂种类较多。有学者研究罗氏、美国应用生物系统公司及安捷伦等公司生产的实时定量PCR仪的性能验证[7-9]。尽管文献[10-12]报道了美国应用生物系统公司生产的7300、7500及ViiA7等型号的性能验证。然而,迄今为止,国内外尚无ABI Quantistudio Dx仪器性能验证的研究。本研究依据NCCLS颁布的EP文件,对ABI Quantistudio Dx实时荧光定量 PCR 仪 HBV-DNA 检测系统进行性能验证,有助于完善本实验室临床基因扩增的质量控制体系。
本研究依据CLIS EP15-A2文件的有关方法进行精密度评价。结果表明,高浓度(1.00×106U/ml)和低浓度(1.00×104U/ml)样本的批内精密度CV分别为1.3%和2.09%,批间精密度分别为2.88%和3.92%,均低于厂家声明的5%。精密度实验反映检测结果的重复性和一致性。由于本次操作系作者全程参与,人员比较固定,操作熟练,精密度可得到保证。
正确度性能评价主要有两种方法:(1)实验方法与参考方法进行比对;(2)使用参考物质。由于大多数PCR检测项目尚无比较公认的实验方法。本研究使用2017年卫生部临床检验中心室间质评样本进行检测,最终室间质评PT成绩100分,结果合格。说明该仪器测量准确。本研究结果发现,当HBV-DNA浓度≥50 U/ml时,Quantistudio Dx实时荧光定量 PCR 仪阳性检测率均为100%。当浓度为30 IU/ml时,阳性检测率为60%。然而,厂家声明的检出限为30 U/ml。我们推测,可能与标本的基质效应及实验过程中的随机误差有关。
本研究利用不同浓度的样本进行线性范围验证,线性回归方程为Y=1.0001X,截距为0。相关系数R2=0.9976。由此可以认为,该检测系统线性范围良好。杨佳佳等[13]认为,当血红蛋白浓度≤28 g/dl、总胆红素浓度≤30 mg/dl、三酰甘油浓度≤3200 mg/dl时,HBV-DNA检测结果不受明显干扰。我们前期结果发现,严重脂浊时PCR检测结果偏低[14]。因此,未来研究应增加抗干扰能力测定。因此,建立检测系统性能验证的规范化文件,熟悉定量检测系统性能验证内容[15],制定相关方案,以保证检测结果准确。
总之,本研究对ABI Quantistudio Dx实时荧光定量 PCR 仪 HBV-DNA 检测系统精密度与准确度良好、检测线性范围宽,符合临床实验室质量管理要求。本研究验证结果与厂家声明一致,可用于临床标本检测。
