外周调节性细胞在接受非小细胞肺癌放疗患者中的运用
2019-03-01
肺癌是临床最常见的恶性肿瘤之一,在中国城市人口恶性肿瘤死亡原因中占首位。研究数据显示,肺癌中80%患者属于非小细胞肺癌(non-small cell lung cancer,NSCLC),75%患者在确诊时已处于中晚期,NSCLC患者的5年生存率极低[1-2]。肺癌包括鳞状细胞癌、腺癌、大细胞肺癌等几种常见的类型,与小细胞肺癌相比NSCLC癌细胞生长分裂较慢、扩散及转移均较晚[3]。放射治疗(radiotherapy,RT)已成为NSCLC的主要治疗手段,尤其是早期治疗除了直接杀伤作用外,辐射还可诱导免疫反应,从而消除未受辐射的肿瘤细胞[4]。根据RT的免疫机制,提示放疗前的免疫状态可能影响肿瘤对辐射的反应,从而影响肿瘤的长期生存[5]。肿瘤免疫编辑理论,包括免疫消除、平衡和逃避,描述了免疫在肿瘤抑制和保护中的双重作用[6]。癌症患者的免疫功能与肿瘤的发生、发展密切相关。淋巴细胞为人体细胞免疫的重要组成部分,根据不同的表型和功能,可观察到不同的淋巴细胞亚群。已有多项研究对NSCLC患者外周血淋巴细胞亚群的表达进行探讨[7]。如肺癌患者CD4+细胞(T辅助细胞)、CD4/CD8比值和B细胞比例下降,CD8+CD28-T淋巴细胞和CD4+CD25+Foxp3+调节性T细胞水平升高调节性T细胞(Treg)增多。除了淋巴细胞亚群的表达外,研究人员还测试了其在NSCLC中的预测和预后作用,多项研究证实了CD3+、CD4+、CD8+、Treg细胞等不同亚型肿瘤浸润淋巴细胞的预后价值[8]。然而,淋巴细胞亚群在外周血中的预测作用尚无充分的研究。因此,本研究采用流式细胞仪检测CD4+CD25+Foxp3+调节性T细胞、T淋巴细胞及NK细胞的含量,并分析其对接受放疗的NSCLC无进展生存期患者预后的预测价值。
1 材料与方法
1.1 病例资料
选择2016年1月至2017年12月九江市第三人民医院105例NSCLC患者及同期体检的45例健康受试者进行研究,其中62例为初诊患者,43例为复发患者。纳入标准:1)NSCLC患者符合《2014版NCCN临床实践指南》[8]中的相关诊断;2)初诊患者在就诊前未接受过抗癌治疗,复发患者在就诊前3个月内未接受过肿瘤治疗、免疫治疗及类固醇治疗;3)患者神智清晰可与医护人员进行正常交流;4)患者已获知情同意并签署相关文件。排除标准:1)合并其他恶性肿瘤的患者;2)合并自身免疫疾病的患者。
1.2 方法
1.2.1 治疗和随访 初诊62例NSCLC患者分别接受RT或联合靶向治疗,同时或连续行RT。23EX直线加速器(购自美国瓦里安医疗系统公司)30~50 Gy/5级,常规放射治疗为60~66 Gy/30~33次,采用直线加速器。根据患者病情采用克唑替尼、厄洛替尼和吉非替尼进行靶向治疗。放疗后每3个月定期随访1次,随访2017年12月20日结束。中位随访时间为12.5(5~22)个月,以无进展生存为主要终点。
1.2.2 采集 患者在抗癌治疗之前和志愿者身上采集的空腹外周静脉血5 mL。用10种特异性单克隆抗体(mAbs),包括:抗CD3(APC和PerCP)、CD4(FITC和 APC)、CD8(FITC 和 APC)、CD16(PE)、CD19(APC)、CD25(APC)、CD28(PE)、CD56(PE)、CD127(PE)和TCR(PE)的特异性单克隆抗体对淋巴细胞亚群进行分化。开始时,将100 μL新鲜血液与上述mAb混合,在室温下在黑暗中孵育15 min。使用FACS裂解液(购自美国BD生物科学公司)在混合中溶解红细胞,然后用磷酸盐缓冲液(PBS)冲洗2次。然后,用流式细胞仪分析残余白细胞,应用Flowjo Version 10数据分析软件计算淋巴细胞亚群的比例及CD4+CD25+Foxp3+调节性T细胞比例。
1.2.3 放疗疗效评估 标准参照实体肿瘤疗效判定标准《实体瘤疗效评价标准(RECIST 1.1)》[9],分为完全缓解:目标病灶消失,病理性淋巴结短轴值在10 mm以下;部分缓解:以临界半径总和为参照物,病灶半径总和缩小30%以上;疾病进展:目标病灶半径总和增加20%以上且绝对值在5 mm以上;疾病稳定:目标半径总和最小值为参照,未达到缓解标准同时也未达到恶化标准。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计数资料采用χ2检验,计量资料多组间比较采用F检验,两两比较采用LSD-t检验,并以ROC分析外周CD4+CD25+Foxp3+调节性T细胞的预测价值。均以P<0.05为差异具有统计学意义。
2 结果
2.1 初诊NSCLC患者与复发NSCLC患者基线特征分析
初诊NSCLC患者与复发NSCLC患者性别、年龄、吸烟史、组织学特征、分化程度、基因突变、T分期、N分期、转移等基线特征差异均无显著性差异(P>0.05,表1)。
2.2 NSCLC患者与健康人群淋巴细胞亚群比例对比
与健康对照组相比,NSCLC患者CD4+CD25+Foxp3+调节性T细胞的比例显著升高(P<0.05);NSCLC患者复发时CD4+CD25+Foxp3+调节性T细胞调节高表达与初诊患者相比得到进一步验证,CD19+B细胞、CD4+T细胞和CD4/CD8比值显著下降,NSCLC患者CD8+T细胞和CD8+CD28-T细胞明显增加(P<0.05),而NK、NKT、γδT、CD3+、CD8+CD28+T细胞在患者与对照组之间无显著性差异(P>0.05)。40例复发患者中,转移患者与复发患者相比,CD4+CD25+Foxp3+调节性T细胞增多;CD4+T细胞比例、CD4/CD8比值下降。差异具有统计学意义(P<0.05,表2,3)。
2.3 无进展生存期患者的单因素分析
CD4+CD25+Foxp3+调节性T细胞比例高与无进展生存期相关(HR=2.55,95%CI:1.07~6.11,P=0.019)。其他淋巴细胞亚群与无进展生存期之间无显著性关联。除淋巴细胞亚群外,其中性粒细胞/淋巴细胞比率与无进展生存期呈负相关(HR=2.66,95%CI:1.01~7.05,P=0.033)淋巴细胞与无进展生存期呈正相关(HR=0.42,95%CI:0.17~-1.03,P=0.042)根据临床病理特点,NSCLC患者的肿瘤分化程度、T分期、N分期与临床预后相关(HR=4.87,95%CI:1.65~14.30,P=0.018;HR=3.40,95%CI:1.11~12.49,P=0.020,表4)。
2.4 无进展生存期患者的多因素分析
多因素分析结果显示,无进展生存的独立性影响因素为CD4+CD25+Foxp3+调节性T细胞及N分期(P≤0.010,0.004,0.05,表5)。
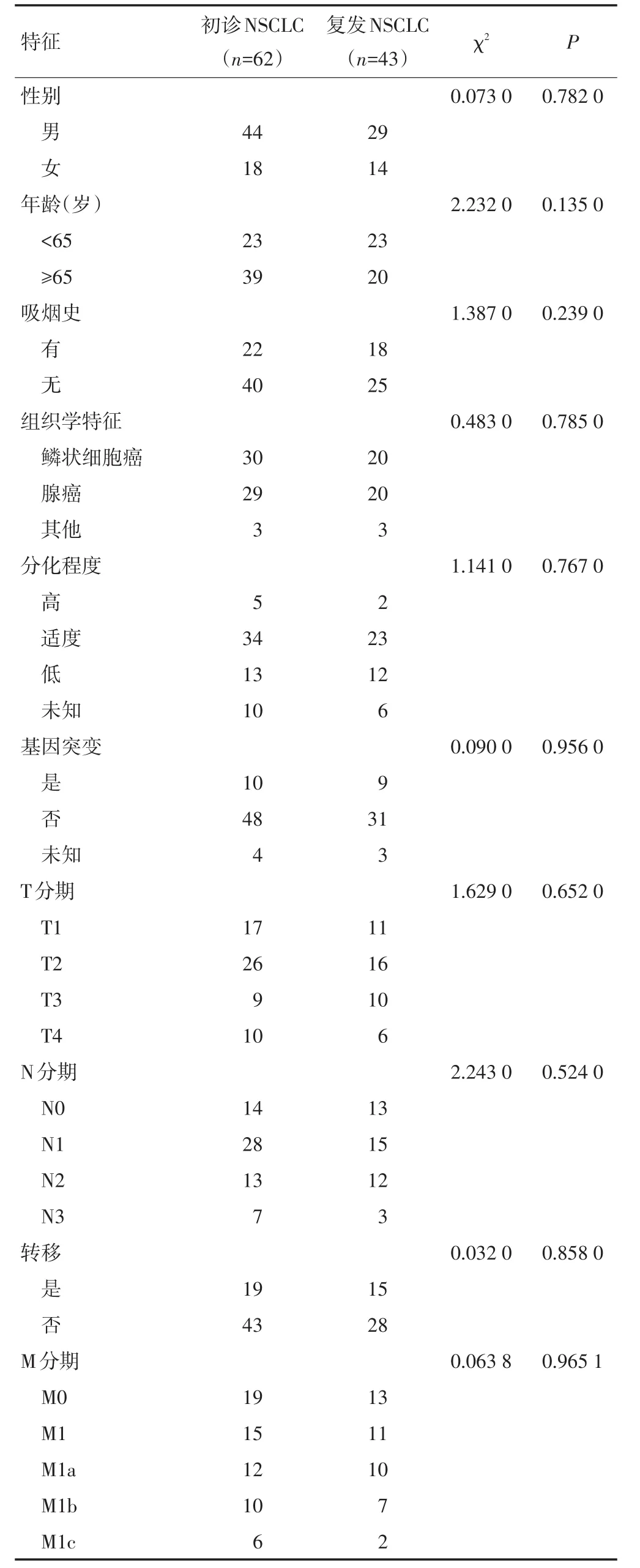
表1 两组患者基线特征对比
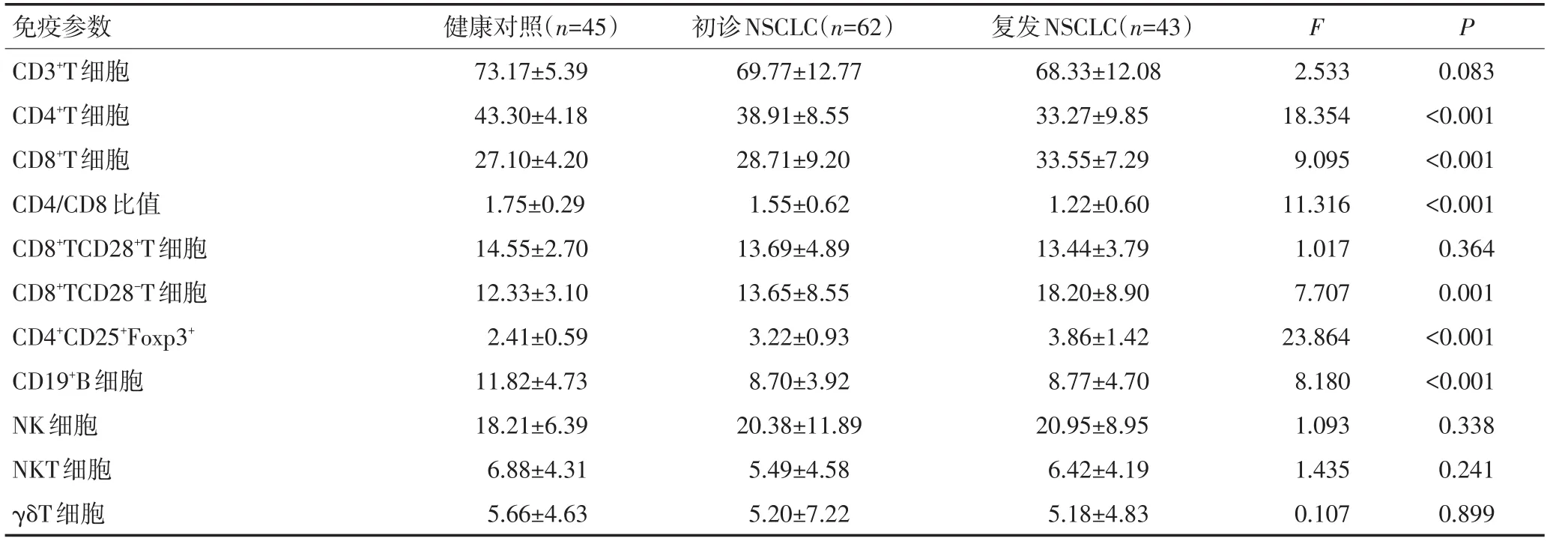
表2 NSCLC患者与健康人群淋巴细胞亚群比例对比

表3 局部复发与转移NSCLS患者淋巴细胞亚群差异分析
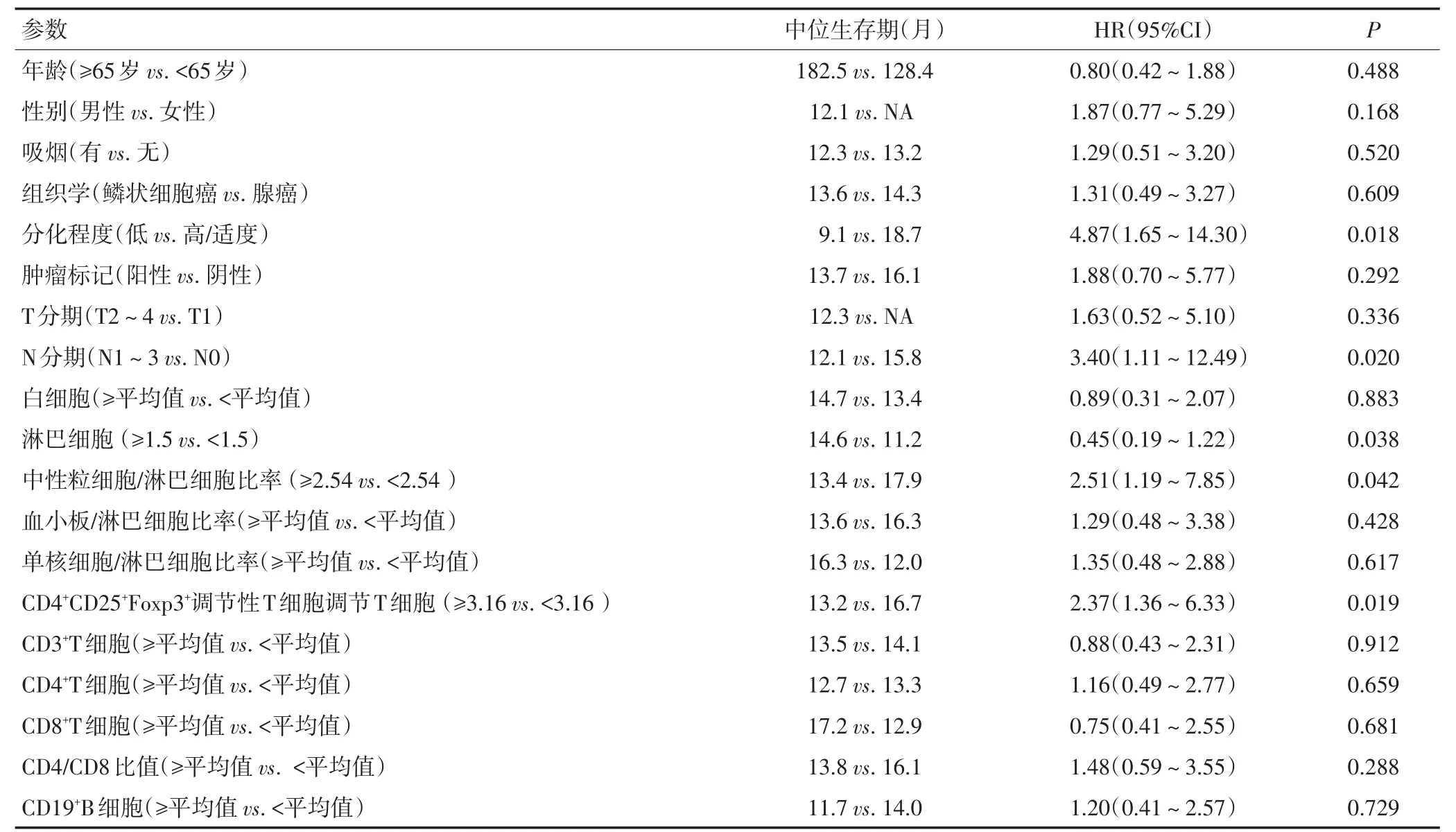
表4 无进展生存期患者的单因素分析

表4 无进展生存期患者的单因素分析(续表4)

表5 无进展生存期患者的多因素分析
2.5 放疗后不同疗效患者外周T细胞表达情况对比
疾病进展期患者调节性T细胞高表达比例明显高于疾病稳定、部分缓解及完全缓解的患者(χ2=18.417,P<0.000 1,P<0.05,表6)。
2.6 ROC分析
通过受试者工作特征曲线(ROC)对外周调节性T细胞预测NSCLC患者无进展生存的诊断效能进行分析,AUC为0.915,当最佳阈值取2.85时,外周调节性T细胞预测NSCLC患者无进展生存的预测敏感度为87.7%,特异性为71.4%,见图1。

表6 放疗后不同疗效患者外周T细胞表达情况对比
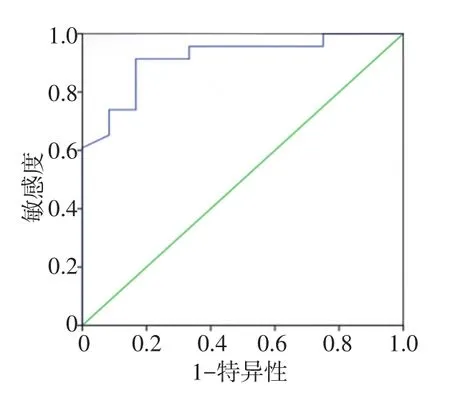
图1 ROC分析
3 讨论
免疫监视是机体在生理状态下免疫系统可及时发现突变细胞及早期肿瘤细胞而防止肿瘤发生的功能,同时肿瘤负荷使宿主的免疫系统功能失衡,因此可反映肿瘤发生及发展[10]。近年来,NSCLC患者的免疫状态、病理状态和预后关系已成为临床研究的重点[9-10]。近年来,多项研究结果显示调节性T细胞对于机体免疫自稳、调控免疫应答起到重要作用,在抗肿瘤免疫中发挥抑制效应[11-12]。本研究结果显示在接受放疗的NSCLC患者中,外周CD4+CD25+Foxp3+调节性T细胞的升高与无进展生存的改善存在独立联系。此外,单因素分析中,NLR和淋巴细胞计数与NSCLC的进展有关。此外,本研究进一步证实NSCLC患者初发时外周CD4+CD25+Foxp3+调节性T细胞、CD8+T细胞和CD8+CD28-T细胞比例增加,CD4+T细胞和CD4/CD8比值降低。
多项研究证实,外周CD4+CD25+Foxp3+调节性T细胞在肺癌手术和化疗中的预后和预测意义[13]。在本研究中,证实了其在NSCLC放疗中的预测作用。疾病进展期患者CD4+CD25+Foxp3+调节性T细胞高表达比例明显高于疾病稳定、部分缓解及完全缓解的患者(P<0.05)。调节性T细胞比例升高提示放疗后肿瘤进展迅速,可能是由于调节性T细胞的抑制作用及其对辐射的抵抗力所致[14]。除淋巴细胞亚群调节性T细胞外,本研究还观察到淋巴细胞计数和中性粒细胞/淋巴细胞比率与无进展生存期相关,这与已发表的研究一致。通过ROC对外周CD4+CD25+Foxp3+调节性T细胞预测NSCLC患者无进展生存期的诊断效能进行分析,AUC为0.915,当最佳阈值取2.85时,外周CD4+CD25+Foxp3+调节性T细胞预测NSCLC患者无进展生期存的预测敏感度为87.7%,特异性为71.4%。作为免疫抑制细胞,在各种肿瘤和转移性疾病,包括NSCLC患者中,可观察到CD4+CD25+Foxp3+调节性T细胞增多[15]。本研究结果与上述观察结果相一致,并支持在初诊患者与复发患者结果相一致。此外还发现,与局部复发相比,NSCLC转移性患者的CD4+CD25+Foxp3+调节性T细胞水平较高,提示该细胞调节性T细胞的增加与肿瘤的进展有关。然而,本研究发现其他淋巴细胞亚群在转移性疾病和局部复发之间无显著性差异,可能是由于样本量有限。本研究显示,NSCLC患者CD4+T细胞、CD4/CD8比值及CD19+B细胞比例下降,与以往研究结果一致[16],其中CD4+T细胞是限制自身免疫反应的重要因素,可通过不同途径抑制自体或异体反应性T细胞的活化及增殖,而外周CD4+CD25+Foxp3+调节性T细胞对肿瘤效应性T细胞有明显的抑制作用,在抗肿瘤免疫中起到介导肿瘤免疫逃逸的作用[17]。NSCLC患者CD8+CD28+T淋巴细胞作为预防肿瘤进展的重要免疫细胞,其表达虽未达到显著水平,但仍低于正常人。研究显示,CD4+、CD25+调节性T细胞可限制CD8+CD28-T细胞在NSCLC患者中表现出免疫抑制作用,这可能与CD8+T细胞的增加有关[18]。此外,NSCLC患者初发与初诊时相比,上述免疫细胞的表达出现异常均得到证实,可能提示了适应性免疫系统在NSCLC患者中的重要作用。
综上所述,本研究结果提示外周CD4+CD25+Foxp3+调节性T细胞水平可作为NSCLC的预测指标。但存在局限性:1)样本量较小;2)患者临床分期不一致;3)使用不同的辐射剂量和组分,亟需开展进一步研究。
