伴有肠母细胞分化的胃癌临床病理特征
2019-03-01陆敏雅滕理送朱国良石麒麟王照明夏慧张晓岚王伟力胡丕伟
陆敏雅 滕理送 朱国良 石麒麟 王照明 夏慧 张晓岚 王伟力 胡丕伟
伴有肠母细胞分化的胃癌(gastric cancer with en⁃teroblastic differentiation,GCED)可能是典型的“原始表型”癌。Ratajczak等[1]提出“胚胎休眠假说”的概念,表明成熟组织中存在胚胎样细胞,而癌症则起源于这些胚胎样细胞休眠状态的激活。有研究显示[2-4],多种癌症中原始细胞样基因表达特征已被确认,且与肿瘤侵袭性有关。原始细胞的特征,包括自我更新、多能性和无限增殖能力,均与癌细胞的高增殖能力和表型可塑性平行,胚胎发育程序的上调可能与高度侵略性有关。GCED的组织学形态与早期胎儿肠上皮相似,具有促进AFP和GPC3表达的能力[5]。部分研究报道[6-7],一些胚胎干细胞标记基因,如SALL4,在GCED多为阳性表达。如在肠母细胞分化和产生AFP的胃癌中,这些原始表型标记的上调与胃癌高度侵袭性均有关。本研究回顾性分析2013年3月至2017年3月浙江大学医学院附属第一医院就诊的胃肠型腺癌337例,其中8例诊断为GCED,2例治疗前血清AFP≥200 μg/L。收集临床资料,根据组织病理学形态,采用免疫组织化学法分析免疫学表型,采用逆转录PCR(RT-PCR)方法检测SALL4基因,结合文献复习分析和探讨GCED的临床病理特征、组织学起源、生物学行为、鉴别诊断及治疗与预后。
1 材料与方法
1.1 病例资料
回顾性分析2013年3月至2017年3月浙江大学医学院附属第一医院就诊的胃肠型腺癌337例,排除其中使用新辅助化疗、姑息性手术或复发性疾病的第二次手术案例后,8例诊断为GCED。其中,男性6例,女性2例。年龄68~83岁,平均年龄76.6岁。2例表现为早期胃癌,其余均为进展性胃癌。8例患者临床症状均有腹部不适,无便血,偶有腹痛及发热等全身症状。胃镜检查肿瘤位置结果显示,5例位于胃窦,2例位于胃体小弯侧,1例位于贲门。胃镜表现为溃疡型肿物或隆起型肿物,2例早期胃癌表现为浅表溃疡。所有患者均行手术治疗,其中5例行术后化疗。随访采用电话联系方式,时间为1~5年,其中5例出现肝及其他脏器转移,2例死亡,1例无瘤生存(表1)。
1.2 方法
1.2.1 H&E染色和免疫组织化学 标本经10%中性福尔马林溶液固定,常规脱水、透明,石蜡包埋,切片厚4 μm,并采用H&E进行染色。免疫组织化学采用EnVision法。所使用的一抗分别为AE1/AE3、EMA、CK7、CDX2、AFP、GPC3、SALL4、TP53和Ki-67,均购自北京中杉金桥生物技术有限公司。
1.2.2 RT-PCR 采用Trizol法提取RNA,并逆转录合成cDNA。扩增反应条件为:37℃15 min,85℃5 s,4℃1 s。引物由上海生工有限公司协助合成。以βactin为参照,共检测8例患者及1例健康对照。
2 结果
2.1 病理学检查
巨检结果显示,肿瘤直径为1.2~4.5 cm,5例位于胃窦,2例位于胃体小弯侧,1例位于贲门。肿瘤边界不清,切面灰白色,质地中等,表面可见坏死物。
光学显微镜下可见肿瘤浸润性生长,6例进展期胃癌,2例早期胃癌。肿瘤细胞排列成管状、乳头状、筛状、腺管样结构(图1,2),肿瘤细胞呈立方或柱状,异型性小,核分裂可见,可见特征性的透明胞质,似妊娠早期胎儿肠样的结构(图3)。8例患者特征性的原始肠样结构占50%以上外,且多伴有经典型胃腺癌的其他组织学结构特征,如腺样、管状及实性等,肿瘤细胞异型性明显,核分裂易见。其中1例血清AFP升高者部分区域伴有肝样腺癌结构(图4),肿瘤细胞排列成索状,血窦丰富,部分细胞胞质呈粉红色(表2)。
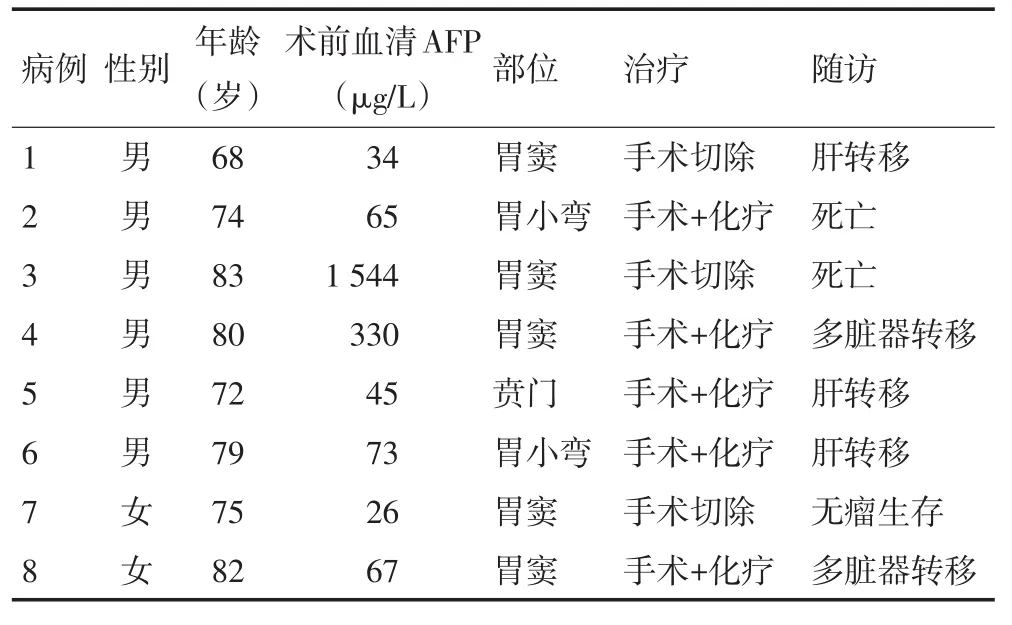
表1 8例GCED患者的临床资料
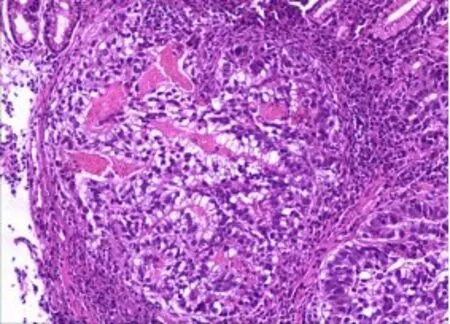
图1 肿瘤细胞排列成筛状(H&E×100)

图2 肿瘤细胞呈腺管状样(H&E×200)
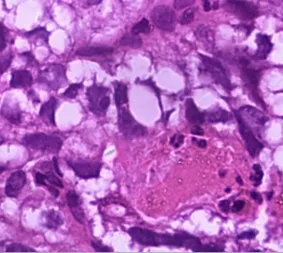
图3 肿瘤细胞胞质透明(H&E×400)

图4 肿瘤细胞呈肝样(H&E×200)
2.2 免疫组织化学法检测及RT-PCR检测结果
8例患者肿瘤细胞除表达普通肠型胃腺癌的免疫组织化学标记以外,如AE1/AE3、EMA、CK7、CDX2等,还表达SALL4、AFP和GPC3。8例患者SALL4均为弥漫性肿瘤细胞核阳性表达(图5)。GPC3有4例弥漫阳性(图6),3例局灶阳性,1例阴性。AFP有1例弥漫阳性(图7),2例局灶阳性,5例阴性(表2)。
RT-PCR检测结果显示,内参β-actin稳定表达,证明本实验RNA提取以及逆转录反应成功。SALL4基因位于142 bp,6例条带亮度显著高于其余患者的无瘤处胃黏膜(健康对照)检测结果,即SALL4基因表达阳性(图8)。

表2 8例GCED患者的病理学特征及免疫组织化学结果
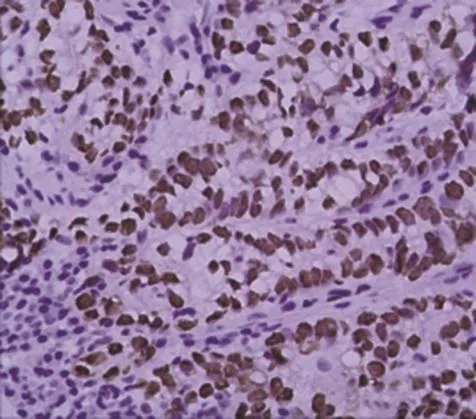
图5 肿瘤细胞SALL4核阳性(EnVision法×200)
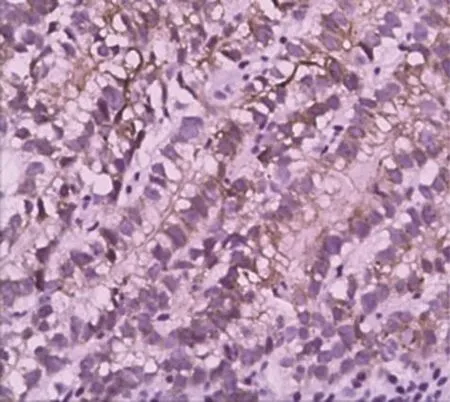
图6 肿瘤细胞GPC3胞质阳性(EnVision法×200)
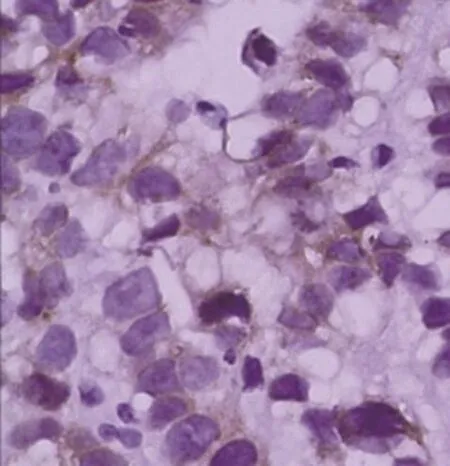
图7 肿瘤细胞AFP胞质阳性(EnVision法×400)
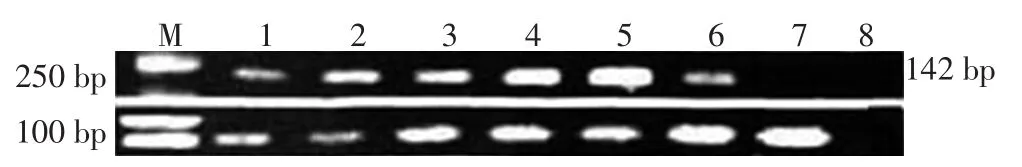
图8 RT-PCR法检测6例GCED患者肿瘤细胞中SALL4和β-actin基因的表达
3 讨论
GCED具有原始肠样结构,由胞质清晰的立方或柱状细胞组成,易见肿瘤细胞侵犯脉管,进而发生淋巴结转移、肝转移及其他多脏器转移。1981年Koda⁃ma等[8]研究首先描述了AFP阳性的胃腺癌中有分化较好的管状或乳头样亚型,胞质透明,似早期胚胎的胃肠道腺上皮。Matsunou等[9]报道2例伴有肠母细胞分化且产生AFP的胃癌(AFPGCs)。另有研究[10]提出AFPGCs分为3个亚型:1)肝样型;2)卵黄囊型;3)胎儿胃肠型。而胎儿胃肠型应相当于GCED。目前,关于GCED的临床研究报道较少,多为个案报道,鲜见关于其发展早期阶段的报道。Matsumoto等[11]回顾性分析了6例早期GCED和186例早期传统胃癌的病例资料,发现即使在早期,GCED也有较高的恶性潜能,术前诊断较难。Yamazawa等[12]使用一组原始表型标记,应用组织芯片技术对386例胃癌患者根据表达谱分为3组,发现原始表型组中13例伴有肠母细胞分化的特征。原始表型基因激活的机制有待于进一步研究。有研究表明[13],一种类似于细胞重新编程的表观遗传机制,可能激活胚胎干细胞样基因在多种恶性肿瘤中表达。在本研究中,即使是早期病变,GCED也有其独特的临床病理特征,特别是H&E染色下可见透明的胞质以及肿瘤的高度侵袭性,而免疫组织化学法检测SALL4为GCED最敏感的标记物(阳性率为100%)。综合文献复习和本组病例显示,GCED患者男性较为多见,临床症状及检查、胃镜检查等与普通的胃腺癌并无显著性差异。大部分病例疾病进展迅速,易发生肝转移及多脏器转移,预后差。病理检查低倍镜下可见肿瘤呈管状、乳头状、筛状和腺管样结构,细胞轻度异型性,核分裂为2~5个/10 HPF。GCED特征性的形态学改变为肿瘤细胞胞质透明,似肾脏透明细胞癌,前者免疫组织化学不表达PAX8、CD10等可做为鉴别标准。GCED患者可伴有血清AFP升高,光镜下也可伴有肝样腺癌的组织学特征,且肿瘤易发生肝脏转移,故其也应与肝细胞肝癌转移至胃部相鉴别,免疫组织化学法染色可显示肿瘤细胞表达AE1/AE3、EMA、CK7、CDX2等。由于其与普通高分化肠型腺癌相似,仅有胞质透明的原始肠上皮特征,且大部分病例与其他常见类型的胃腺癌混合存在,易误诊为普通的肠型腺癌,而低估了其高度侵袭性的生物学特征,在显微镜下应仔细观察所有切片中有无原始肠上皮的特征。免疫组织化学法染色结果显示,肿瘤细胞表达普通肠型胃腺癌的免疫组织化学标记物以外,还表达一些原始标记物,如SALL4、AFP和GPC3。所有病例应用RTPCR证实,75%有SALL4基因扩增。
综上所述,本研究根据组织学形态、免疫组织化学的表达、基因检测和临床资料的分析,推测GCED为肠型腺癌的侵袭性亚型。本研究的病例有限,亟需大样本量的病例进行评估,从而建立GCED的最佳治疗途径。鉴于GCED的侵袭性,针对SALL4基因的靶向药物开发前景较为广阔。
致谢:感谢上海生工有限公司对本研究作出的贡献。
