3D打印技术在心血管药物制剂中的应用研究进展
2019-03-01杨梦汝曾庆源
杨梦汝 ,宋 丽 ,龙 璇 ,崔 蔚 ,曾庆源
(1.湖北中医药大学药学院,湖北 武汉 430065; 2.武汉大学附属同仁医院·武汉市第三医院,湖北 武汉 430074)
3D打印技术(3DP)又称三维打印,即快速成型技术、增材制造技术或固体自由成型技术[1-2],为一种基于三维数字模型,根据离散、堆积成型的原理,采用“逐层打印,层层叠加”的形式将材料结合起来的工艺。该技术融合了计算机辅助设计、数控技术、新材料技术等当代高新技术,具有成型速度快、高度柔性、绿色省材和重复性好等特点[3]。在制药领域中,3D打印可实现药物精准释放、药物剂量可控及多药分布等目的[4],突破了传统制药工艺的局限,在个性化用药、制备复方制剂等方面的应用发展迅速。美国食品药物管理局(FDA)于2015年批准世界首例3D打印技术制备的左乙拉西坦(levetiracetam)上市,此速溶片可在5 s内迅速崩解,临床用于治疗老人或儿童的癫痫发作[5],这为临床创新和制备高端制剂提供了依据。近年来,3D打印技术被越来越多地应用于心血管药物的制备,在此总结了3种3D药物打印技术的原理、特点及其在心血管药物制剂中应用的研究进展,为3D打印技术在制药领域的发展提供新的方向和思路。
1 常用的3种3D打印技术
1.1 粉末层喷头打印(PP)
PP为一种非撞击、点阵式打印技术[6],由打印喷头、铺粉辊、步进电机和操作台等构成,工作原理见图1[7]。铺粉辊将粉末平铺于操作台或上一层已固化的粉末层中,打印喷头程序控制喷出粘结剂与粉末进行粘结,操作台下移,并如此循环,直至制备出三维产品。PP在室温条件下即可完成,且可供选择的材料多,与传统制药工艺相比,较易生成多孔结构,在药物可控释放方面具有一定优势[8],缺点是会大量浪费粉末,药物分辨率降低。2005年至 2007年,余灯广等[9-10]分别以不同模型药物,研究出了基于胃漂浮缓释给药系统、材料梯度控释给药系统及零级控释给药系统的3D打印产品。其中,2007年该团队以豆腐果苷为模型药物[11],应用LTY-200型打印机制备出了具有局部差异的口腔速崩片,利用中间含粉末区的结构加快崩解速率和崩解时限,增加药物溶出速率,较好地解决了药物难溶于水、起效慢等问题,更好地发挥止痛、镇静催眠作用,改善和调节记忆力与思维力。2014年,WU等[12]利用PP制备了异烟肼植入片,以无毒性聚乳酸(PLLA)为缓释材料,可在结核病灶部位有序、稳定释药,从而降低抗结核药物的不良反应,对于改善骨结核的治疗具有积极作用,同时也改善了因患者不规律服药而导致的耐药性。
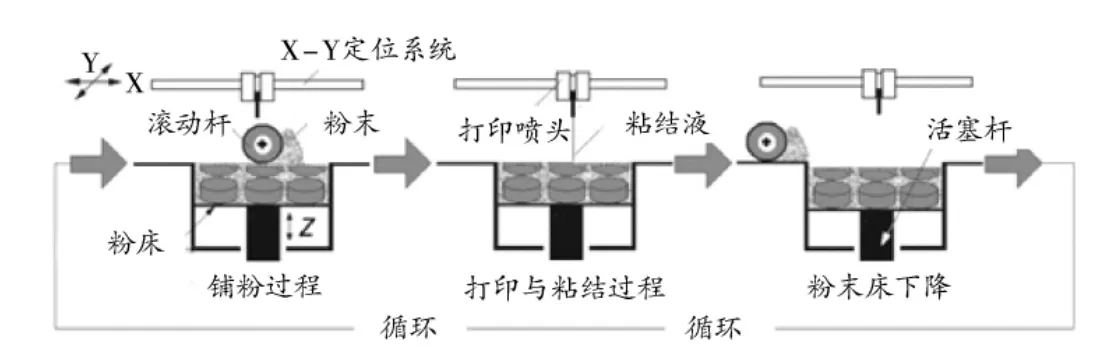
图1 粉末层喷头打印工作原理
1.2 熔融沉积成型打印(FDM)
FDM技术是一种新颖的多功能制造技术,原理是将载药高分子材料熔化并由微细热熔喷嘴喷出,在计算机软件控制下按设计参数沉积在操作台或已固化材料上,逐渐形成有特定轮廓的3D药物,操作过程见图2[13]。FDM技术具有低成本、药物均匀度高、操作简单和机械性能优良等优势,但其局限于热塑性聚合物,对于所有热处理或需要热处理的药物,其稳定性不佳,精度较低。2015年,JUSTYNA等[14]以泼尼松龙为模型药物制备缓释片,将高分子材料聚乙烯醇(PVA)浸泡在泼尼松龙的甲醇溶液中充分载药,再通过打印参数(包括工艺参数和剂型参数)制备得6种规格的片剂,采用流通池法测定药物体外溶出含量;研究证明,规格为 2,3,4,5,7.5,10 mg的片剂,药物累积释放达80%以上的时间需12~18 h,大部分以溶蚀机制进行释放,载药量越高,片剂填充百分比越大,药物构造紧密,片剂的溶蚀及扩散变慢,故药物的溶出逐渐降低。2015年,GOYANES等[15]以PVA为熔融载体,以对乙酰氨基酚为活性成分制备5种3D打印模型:金字塔形、环形、圆柱形、球形和立方体形,测定不同外形药物体外溶出量,结果药物溶出速率与制剂形状、表面积与体积比等因素有关,故可通过外部形状的差异调节和控制药物的释放和溶出度,同时也能影响药物在人体内的转运情况。2017年,KEMPIN等[16]通过荧光标记奎宁作为模型药物,通过FDM技术制成空心圆柱体植入剂,评价了不同聚合物(丙烯酸树脂、聚己内酯、聚乳酸、乙基纤维素)载药释放行为,在pH 7.4的磷酸盐缓冲溶液(PBS)中测定药物释放情况,结果差异显著,说明可通过调节不同熔融材料改变药物释放特征,也为今后应用该模型打印植入剂的研究提供了新方向。
1.3 压力挤出成型打印(EXT)
EXT起初多用于软组织支架的制备,因其打印环境温和、打印速度较快,逐渐应用到药物制剂领域。其原理是原辅料粉末和黏合剂混合均匀后制成半固体(凝胶或糊剂),通过程序控制挤出于操作台上,最终获得3D打印药片,详见图3[17]。EXT在常温下即可完成,载药量较高(达90%),在单个片剂中能实现多种释放模式,但制备出的药物硬度低、脆碎度高,打印分辨率受喷嘴尺寸限制,半固体通过喷嘴的流动状态亦难以控制[7]。2014年,KHALED等[18]以愈创甘油醚为模型药物,利用双喷头挤出成型技术制备速释缓释双层片,速释层为愈创甘油醚、羟丙甲基纤维素2910、羟基乙酸淀粉钠和微晶纤维素,缓释层为愈创甘油醚、羟丙甲基纤维素2208和卡波姆,通过研究不同含量的缓释材料观察片剂脆碎度和硬度的变化,且在pH 6.8 PBS中呈现不同溶出情况,而速释层体外溶出无显著差异。2018年,LI等[19]以羟丙基甲基纤维素(HPMC K4M)和羟丙基甲基纤维素(HPMC E15)为亲水基质,微晶纤维素(MCC PH101)为挤出成型剂,通过测定机械性能,含量均匀性和质量变化进行3D打印胃漂浮片剂的体外评估。

图2 熔融沉积成型打印操作过程

图3 压力挤出成型打印仪器
2 3D打印技术在心血管药物制剂中的应用
2.1 我国心血管疾病(CVD)及其危险因素流行病学现状
据《中国心血管病报告2017》[20]显示,中国CVD患病率和死亡率仍处在上升期;估算CVD现患人数2.9亿,其中患病人数位居前3位的为高血压(约2.7亿),脑卒中(约1 300万)和冠心病(约1 100万),CVD死亡比例居居民疾病死亡首位;作为导致心血管疾病的一些危险因素,如高血压、吸烟、血脂异常、糖尿病、大气污染等也呈增长趋势,其中高血压是心血管疾病最关键和重要的危险因素。《中国高血压防治指南2010》中指出[21],我国每10名成年人中就有2名患有高血压,且其知晓率、治疗率及控制率总体水平均较低。此外,我国成人血脂异常总体患病率达40.40%,较2002年大幅升高[22]。同时,《中国 2型糖尿病防治指南(2013年版)》中提到[23],2007年至2008年我国一些地区展开的糖尿病流行病学调查研究显示,20岁以上的人群中糖尿病患病率为9.7%,且我国糖尿病的患病率呈增长趋势。《中国心血管病报告2015》[24]中首次关注了大气污染问题,研究表明,PM2.5与 CVD 密切相关。
可见,我国CVD情况日渐严重,随着患病率和死亡率的增加,人口老龄化趋势的逐渐增长,CVD在一定程度上已成为严峻的社会问题,防治工作刻不容缓。考虑我国CVD流行病学特点和现状,将3D打印技术应用于心血管药物制剂领域,不仅能解决传统心血管药物制剂存在的问题,而且制作工艺简单、操作灵活,可实现个体化精准用药,达到最佳防治效果。
2.2 3D打印技术在心血管药物制剂应用的实现
2.2.1 心血管单方制剂
2017年,LI等[25]利用FDM技术以 PVA为载药熔丝,选择用于治疗糖尿病的格列吡嗪作为模型药物。该片剂采用双室设计,每个隔室包含不同含量的格列吡嗪,通过合理安排药物在隔室中的浓度分布,设计控制药物释放或延迟药物释放的行为,发现释放曲线符合Korsmeyer-Peppas释放动力学。同年,GIOUMOUXOUZIS等[26]以水溶性聚合物PVA、甘露醇和氢氯噻嗪(HCTZ)为模型药物,通过FDM技术打印出三室空心圆柱剂型的内部部分,外部部分由不溶于水的聚乳酸(PLA)组成,通过差示扫描量热法(DSC)、X 射线衍射(XRD)和热重分析(TGA)方法研究所产生的制剂,溶出度研究结果表明,HCTZ呈现出零级动力学。
2.2.2 心血管复方制剂
2015年,KHALED等[18]采用压力挤出成型打印技术制备出具有3种活性成分(硝苯地平、卡托普利和格列吡嗪)的复方制剂,可治疗伴有高血压和糖尿病的患者,其中格列吡嗪和硝苯地平分别以溶蚀和扩散的方式释药,呈现为一级释放动力学,而卡托普利则以渗透泵的原理呈现零级释放动力学。同年,该课题组在原有基础上进行相应改进,制备出含有5种主药的心血管复方制剂(Polypill)[17],且具有缓释、控释 2种释药方式,经X射线衍射和傅立叶红外光谱试验证明,药物与所选用辅料之间无显著相互作用。速释层阿司匹林与氢氯噻嗪30 min内溶出率约为90%,同时缓释层阿替洛尔、普伐他汀和雷米普利可于12 h持续释放,使同一制剂多种药物分别实现预期疗效,很大程度上提高了患者的顺应性,通过个性化用药以适应特定患者的需求。
3 展望
3D打印技术在心血管药物制剂领域中的应用,是对传统制剂的发展和创新,可与传统制药方式相辅相成、互为补充。有研究表明,通过3D打印技术设定不同制剂外形和内部构造,可制备出拥有多种释放方式的药物;3D打印技术灵活性好,生产工艺过程简单,对操作环境要求较低,临床药师可通过患者的性别、年龄、种族等基本资料制订最适合患者的给药剂量与形式,然后利用3D打印技术制备个体化制剂(见图4)[8],与传统制剂相比,其配伍比例和给药剂量的精准性更高。
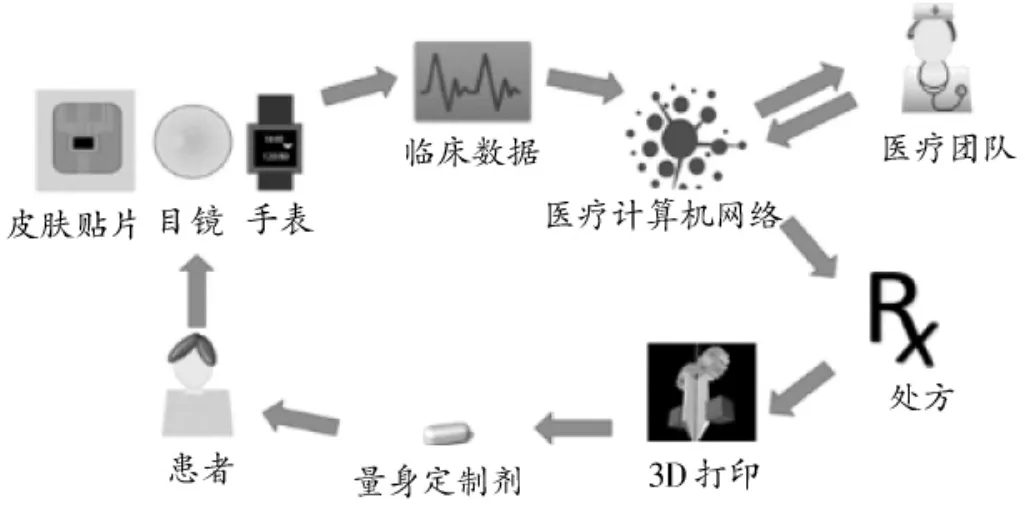
图4 以患者为中心的个体化治疗3D打印技术
现阶段,关于3D打印技术用于心血管药物制剂的研究较少,尚处于起步阶段。而CVD作为一种复杂疾病,大多为多种因素共同造成,致病机制较复杂,传统的单一药物难以做到有效预防、控制及治疗。因此,多靶点治疗CVD逐渐成为关键因素,心血管复方制剂(polypill)应运而生。Polypill首次由WALD等[27]提出,系指在1粒药丸中混合多种药物(多类药物合一的制剂),认为通过服用这种“多效药丸”将大大降低人群心血管事件发生率和病死率[27-28];由于传统给药方案复杂,药物疗效达不到预期效果,浪费时间和精力,Polypill携带方便,可大大提高患者的依从性;较传统单一的给药模式,患者服用 Polypill后,疗效提高。目前,市售剂型及在研Polypill均采用传统制剂技术[29],因其工艺复杂烦琐,故制作复杂剂型难以实现规模化工业生产,且外形单一,需要设备仪器种类多,成本较高且耗时。利用3D打印技术制备Polypill,操作、制备工艺简单,重复性高,能与不同类型和性质的辅料结合,可得到由简单到复杂、特定外形或复杂内部构造的指定释药高端制剂,且运行费用低,适合偏远地区或医疗水平尚不发达的国家研究医疗制剂;成型速度快,可突破传统制剂技术的局限,真正实现个体化精准用药,为临床个体化治疗提供更好的选择。
4 结语
自20世纪90年代中期,美国麻省理工学院成功发明了基于粉末黏合原理快速成型技术后,3D打印技术历经30年的发展,在建筑、医学、物理学、化学、材料科学和生命科学等领域受到了广泛关注和青睐。3D打印技术在药学领域的广泛应用,逐渐改变了传统制剂的制备模式,真正体现了从概念设计向个性化药物打印的过渡。虽然现阶段3D打印技术在药学领域有了较多的研究进展,但其在治疗CVD的领域,相关制剂研究少且尚未完备,采用3D打印技术制备的上市药物到目前为止仅有美国的左乙拉西坦速溶片,制剂的剂型也较单一,大多为片剂,故要将3D打印技术在CVD药物制剂领域中达到广泛应用,仍需面对诸多挑战。
