雷公藤甲素对肿瘤坏死因子- 介导的HCM心肌细胞生长损伤保护作用研究
2019-03-01林芸芸宋艳玲蔡海云顾申红
林芸芸 ,宋艳玲 ,蔡海云,顾申红
(1.海南医学院第一附属医院,海南 海口 570000; 2.海南医学院第一临床学院,海南 海口 570000)
肿瘤坏死因子-α(TNF-α)是一种主要由巨噬细胞和单核细胞产生的促炎细胞因子,除参与正常炎性反应和免疫反应外[1],还可作为独立因素参与心肌损伤[2],也可作为损伤心肌细胞的诱导剂。雷公藤甲素(TW)是中药雷公藤的主要活性成分,具有抗炎、抗癌等多种药理作用[3-4]。本研究中通过体外实验研究了TW干预TNF-α对HCM心肌细胞的生长抑制和凋亡诱导作用。现报道如下。
1 材料与方法
1.1 材料
细胞:人心肌细胞HCM(美国模式培养物保藏中心,ATCC,批号为 BNCC337719)。
仪器:c150型 CO2细胞培养箱(德国Binde公司);SW-CJ型超净工作台(苏州净化设备公司);A10型超纯水仪(美国Millipore);DMI8型倒置显微镜(德国莱卡公司);MDF-C8V1型-80℃超低温冰箱(日本 Sanyo公司);FC500MCL型流式细胞仪(美国Beckman公司)。
试药:高糖DMEM培养基(批号为10569010),胰蛋白酶(批号为25200056),乙二胺四乙酸(EDTA,批号为AM9260G),磷酸盐缓冲溶液(PBS,批号为 1001002),胎牛血清(FBS,批号为 10099141),均购于美国 Gibco公司;二甲亚砜(Dimethyl sulfoxide,DMSO,批号为 D2650),TW(批号为 38748-32-2,HPLC法纯度 >98%),均购于美国Sigma公司;TNF-α(北京义翘神州生物科技有限公司,批号为10602-HNAE);MTS细胞毒性检测试剂盒(美国 Promega公司,批号为 G3582);Annexin V-FITC/PI凋亡测定试剂盒(美国Sigma-Aldrich公司,批号为APOAF-20TST);肌酸激酶(CK)活性检测试剂盒(上海哈灵生物科技有限公司,批号为 HL70047,20T);乳酸脱氢酶(LDH)活性检测试剂盒(上海哈灵生物科技有限公司,批号为HL20042,48T)。
1.2 方法
1.2.1 细胞培养
人心肌细胞HCM为贴壁细胞,使用含有10%FBS、100 U/mL青霉素和100 g/L链霉素的高糖DMEM培养基培养,置5%CO2,37℃ 细胞培养箱中培养。待细胞生长至约90%时,弃去原培养基,用PBS轻轻吹吸1~2次,用0.25%胰蛋白酶消化,传代(平均2 d传代1次)。
1.2.2 四唑盐(MTT)比色法检测细胞生长抑制
TNF-α或 TW:将 HCM细胞用 0.25%胰蛋白酶消化,制成单细胞悬液,按3×104个细胞/孔的密度均匀接种于96孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。实验组分别加入不同质量浓度(50,100,150,200,250,300 ng/mL)的 TNF -α 或不同质量浓度(1,3,10,30,50 ng/mL)的TW,对照组则加等量不含药物的培养液。继续培养24 h,弃去培养上清液,每孔加MTT 20 μL和不含血清培养基 100 μL,37 ℃孵育 0.5 ~1.0 h。最后用酶标仪在480 nm波长处检测各孔吸光度值,并计算细胞存活率。细胞存活率(%)=1-[(实验组 A490-校零孔 A490)/(对照组 A490-校零孔 A490)]×100%。
TW 联合 TNF-α:将 HCM细胞用 0.25%胰蛋白酶消化,制成单细胞悬液,按3×104个细胞/孔的密度均匀接种于96孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。处理组加入245 ng/mL的TNF-α进行处理,实验组分别加入不同质量浓度(3,10,30,50 ng/mL)的 TW。继续培养24 h,弃去培养上清液,每孔加MTT 20 μL和不含血清培养基 100 μL,37 ℃孵育 0.5 ~1.0 h。最后用酶标仪在480 nm波长处检测各孔吸光度值,并计算细胞存活率。
1.2.3 流式细胞仪检测细胞凋亡
根据Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作。将HCM细胞用0.25%胰蛋白酶消化,制成单细胞悬液,按2×105个细胞/孔的密度均匀接种于6孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。处理组加入245 ng/mL的TNF-α进行处理,实验组分别加入不同质量浓度(3,10,30,50 ng/mL)的 TW。继续培养 24 h ,弃去培养上清液,胰酶消化、离心、收集细胞,用250 μL结合缓冲液重悬细胞并调整细胞浓度约为1×106个细胞/mL。向细胞悬液中依次加入Annexin V-FITC和PI溶液,混匀后室温避光孵育15 min,加入400 μL PBS,混匀后上流式细胞仪检测分析。
1.2.4 试剂盒检测细胞上清液中CK和LDH水平
将HCM细胞用0.25%胰蛋白酶消化,制成单细胞悬液,按2×105个细胞/孔的密度均匀接种于6孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。处理组加入245 ng/mL TNF-α进行处理,实验组则分别加入不同质量浓度(3,10,30,50 ng/mL)的 TW。继续培养 24 h 后取细胞上清液,按照相关试剂盒说明书进行操作,检测细胞上清液中CK和LDH水平。
1.3 统计学处理
2 结果
2.1 TNF- 或TW对细胞生长的抑制作用
MTT试验结果显示,与对照组相比,TNF-α可抑制 HCM细胞的生长,并呈浓度依赖性(P<0.01)。TNF-α 的半数抑制浓度(IC50)经 Graphpad prism 5.0软件计算,确定为 245 ng/mL,详见图 1 A。经 1.0~10.0 ng/mL的TW作用24 h后,HCM细胞生长变化无明显差异,而>30.0 ng/mL质量浓度的TW处理可明显抑制细胞生长(P<0.01),详见图 1 B。

图1 TNF- 或TW对HCM细胞生长的抑制作用( P<0.01)
2.2 TW联合TNF- 对细胞生长的抑制作用
用245 ng/mL的TNF-α处理HCM细胞的同时,加入不同质量浓度的TW进行干预。24 h后MTT结果显示,3 ng/mL TW 和10 ng/mL TW 实验组的 HCM 细胞抑制率明显低于处理组(P < 0.01),而 50 ng/mL TW实验组的 HCM细胞抑制率反而升高(P<0.01),详见图2。
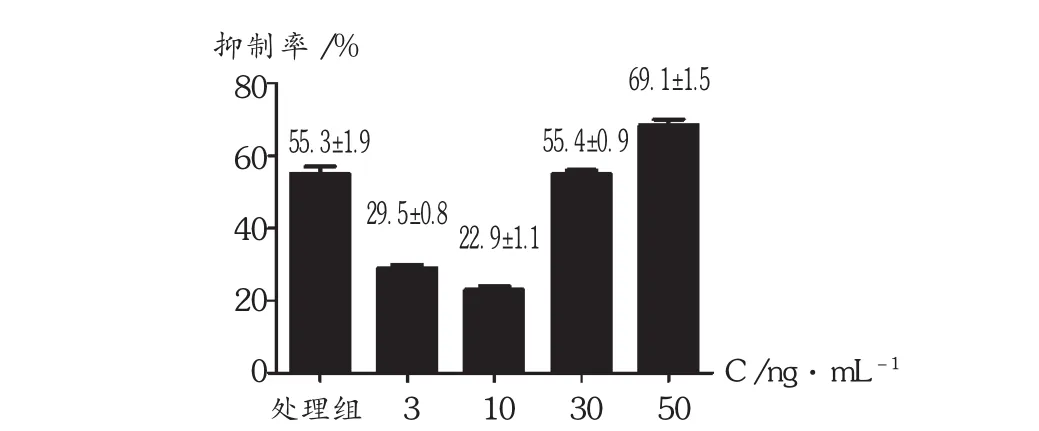
图2 TW联合TNF- 对人心肌细胞生长的抑制作用( P<0.01)
2.3 TW对TNF- 处理后细胞的凋亡诱导作用
用245 ng/mL的TNF-α处理HCM细胞的同时,加入不同质量浓度的TW进行干预。24 h后,流式结果显示,3 ng/mL TW 和 10 ng/mL TW 实验组对 HCM 细胞的凋亡诱导明显低于处理组(P <0.01),而 50 ng/mL TW实验组对HCM细胞的凋亡诱导反而增强(P<0.01)。详见表1。
表1 TW对TNF- 处理后人心肌细胞的凋亡诱导作用(±s,%)

表1 TW对TNF- 处理后人心肌细胞的凋亡诱导作用(±s,%)
注:Q2为晚期凋亡细胞比例,Q3为早期凋亡细胞比例,Q2+Q3为总的凋亡细胞比较。与处理组比较,aP<0.01。
组别处理组TW 3 ng/mL 组TW 10 ng/mL 组TW 30 ng/mL 组TW 50 ng/mL 组Q2 28.9 ± 2.5 15.8 ± 1.1a 24.3 ± 3.2 26.7 ± 1.5 42.5 ± 1.5a Q3 6.4 ± 1.8 3.2 ± 0.4a 3.7 ± 2.1a 5.3 ± 2.1 10.3 ± 2.0a Q2+Q3 35.3 ±2.3 19.0 ±1.0a 28.0 ±1.5a 32.0 ±1.7 52.8 ±4.0a P<0.01<0.01<0.01
2.4 TW联合TNF- 对CK和LDH水平的影响
与对照组相比,3 ng/mL TW 和 10 ng/mL TW 实验组中CK和LDH水平明显降低,差异有统计学意义(P < 0.01)。而 30 ng/mL TW 和 50 ng/mL TW 实验组对CK和LDH的影响不明显。详见图3。
3 讨论
TNF-α是一种多功能细胞因子,在感染与炎性反应、肿瘤细胞生长的抑制中发挥重要作用,与造血、心、肝、肾、肌肉等系统功能及器官移植的排斥反应、败血症、恶病质、心力衰竭等都密切相关。有研究发现,TNF-α对心肌细胞有诱导凋亡作用,其激活及表达上调是导致心肌功能紊乱的重要因素。可能有以下途径:1)TNF-α通过与TNF-α受体结合,激活 JNK信号通路及下游转录因子,从而诱导心肌细胞凋亡[5-6];2)TNF-α通过诱导一氧化氮的生成,与超氧阴离子结合,发挥毒性作用,引起氧化还原系统失衡,对心肌细胞发挥损伤作用[7];3)TNF-α通过诱导与细胞凋亡密切相关的 c-los,c-jun,c-Myc等原癌基因表达,从而诱导心肌细胞凋亡[8];4)TNF-α可通过鞘氨醇依赖机制诱导心肌细胞发生凋亡[9]。本研究结果显示,TNF-α处理后细胞生长受到明显抑制,细胞凋亡率明显增加,提示TNF-α有对人心肌细胞的损伤作用。
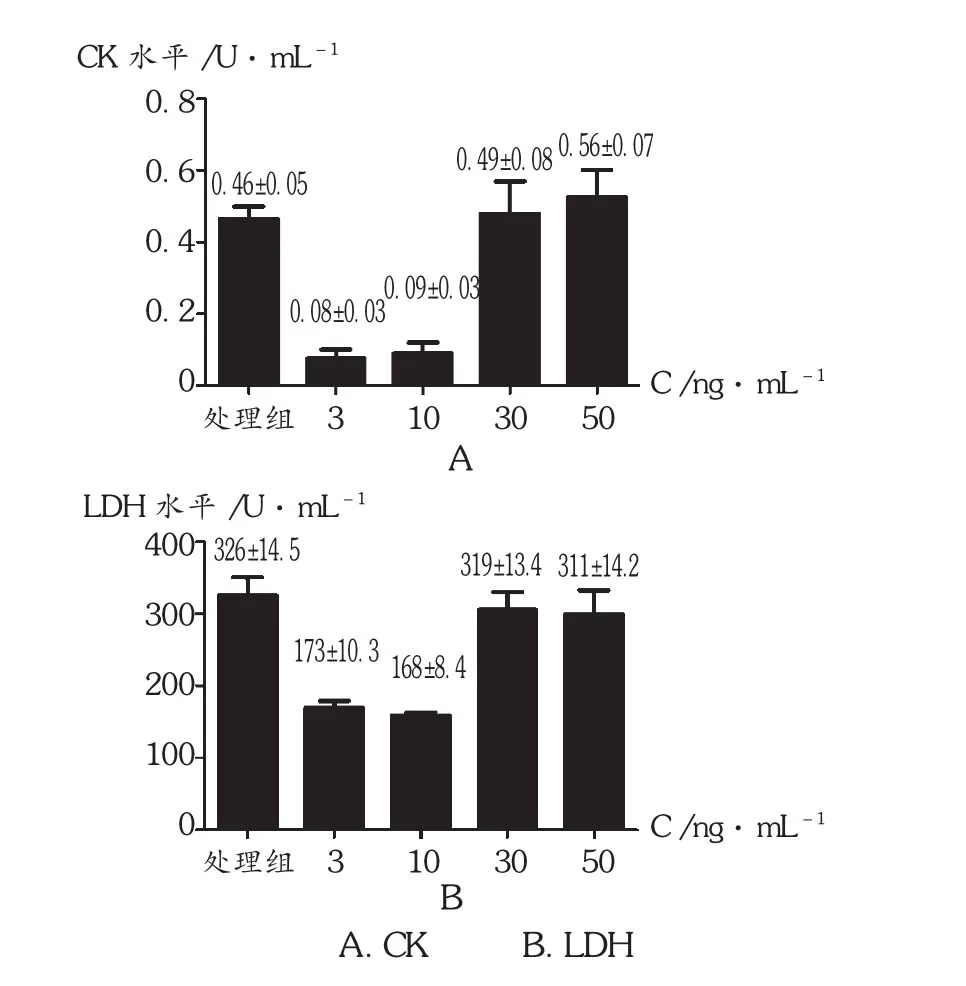
图3 TW联合TNF- 对细胞上清液中CK和LDH 水平的影响( P <0.01)
TW又称雷公藤内酯,是从卫矛科植物雷公藤中提取的环氧二萜内酯化合物,具有抗炎、抗癌等多种药理活性[10-11],临床用于治疗炎性疾病、自身免疫疾病和肿瘤,高浓度TW可调节细胞周期,通过线粒体凋亡途径诱导心肌细胞发生凋亡[12-13];此外,高浓度TW可呈剂量依赖性地抑制人类 ether-a-go-go相关基因(hERG)编码的钾通道,抑制心肌细胞复极化时钾离子外向电流,导致动作电位时程延长,明显抑制心肌细胞活性[14]。本研究结果发现,30.0 ng/mL 以上质量浓度的TW才会抑制心肌细胞生长和诱导其凋亡,并对产生损伤作用;较低质量浓度的TW对心肌细胞生长无明显生长抑制作用,与TNF-α联用时,可降低TNF-α对人心肌细胞的生长抑制作用和凋亡诱导作用,可在一定程度上降低TNF-α对人心肌细胞的损伤作用。
综上所述,安全浓度的TW降低TNF-α对人心肌细胞HCM细胞的生长抑制作用和凋亡诱导作用,心肌细胞损伤标志物CK和LDH也会有所降低,说明TW对TNF-α介导的HCM心肌细胞的生长损伤有保护作用,而具体的分子机制和参与信号途径尚未阐明,需要进一步深入研究。
