DNA紫外吸收定量法中干扰校正用沉淀剂存在的问题及改进方法
2019-02-27熊燕飞班宜辉张建坤
熊燕飞,班宜辉,张建坤,刘 东,徐 鹏,陈 燕
(武汉理工大学 化学化工与生命科学学院,湖北 武汉 430070)
紫外吸收法定量核酸具有简便、快速、不破坏样品等特点,是实验室常用的简便快速的核酸初步定量方法。该方法以核酸的组成和理化性质为基础,利用分光光度法原理和技术进行定量,为消除小分子光吸收物质的干扰,还需进行沉淀离心操作,涉及多方面基础知识和技术原理,所以,被不少生物化学实验教材收录[1-2]
但该方法受寡核苷酸、核苷酸等小分子紫外吸收物质的干扰,为消除这类干扰,采用钼酸铵-过氯酸沉淀核酸大分子后,测定小分子干扰物质的光吸收值进行校正[1-2]。实际测定中发现,钼酸铵-过氯酸沉淀剂本身在260 nm处产生一定的紫外吸收,而且其较强的酸性可能导致核酸大分子部分降解,同时,核苷酸等物质在260 nm处的紫外吸收受溶液pH值的影响,这些因素对测定结果带来严重影响。笔者对这一方法存在的问题进行了分析探讨,并提出了改进方法。改进后,所用试剂更简单安全,测定结果比原方法准确可靠,可用于核酸紫外吸收法定量测定的实验教学和核酸定量的一般快速分析检测。
1 材料与方法
1.1 材料
小牛胸腺DNA钠盐:Sigma公司,Type I。
标准DNA储备液:准确称取25.0 mg的小牛胸腺DNA钠盐,去离子水溶解并定容至25 mL,DNA的浓度为1.0 mg/mL(pH ≈ 6.5)。
标准DNA样品液:根据需要取标准DNA储备液稀释至所需浓度,本试验主要使用100 μg/mL标准DNA样品溶液。
DNA样品:常规氯仿-异戊醇抽提法[3]自制猪肝DNA 3份,均为略带灰白色固体,分别以1 mol/L NaCI溶液溶成糊状,加稀NaOH助溶至完全溶解,稀HCl调pH值至6.5,去离子水定容至25 mL,分别记为样品溶液Ⅰ、样品溶液Ⅱ和样品溶液Ⅲ,其A260/A280分别为2.059、2.048、1.870。
钼酸铵-过氯酸沉淀剂:0.25%钼酸铵-2.5%的过氯酸溶液(四水合钼酸铵、过氯酸均为分析纯,国药集团化学试剂有限公司产品)。
岛津紫外-可见分光光度计UV-2500。
高速冷冻离心机:HERMLE LABORTECHNIK。
1.2 方法
1.2.1 钼酸铵-过氯酸沉淀剂 1)钼酸铵-过氯酸的紫外吸收
采用岛津紫外-可见分光光度计UV-2500对沉淀剂及钼酸铵溶液进行全吸收谱扫描,重点检测其在紫外区的光吸收情况。
2)钼酸铵-过氯酸溶液对样品的影响
试验管:取标准DNA样品溶液0.5 mL,加入钼酸铵-过氯酸沉淀剂0.5 mL,混匀,冰浴沉淀一定时间,3 000 r/min离心10 min,取上清液0.5 mL,去离子水稀释至5.0 mL,去离子水作参比,测260 nm处光吸收值。
对照管:以去离子水替代沉淀剂,其他同试验管处理,测定光吸收值。
空白沉淀剂管:以去离子水替代样品,其他同试验管处理,测定光吸收值。
观察钼酸铵-过氯酸沉淀剂对测定结果的影响,分析钼酸铵-过氯酸沉淀剂对样品是否产生变性、降解等作用。
3)原方法检测液稀释过度
按原方法,样品经沉淀和离心后,上清液由0.4 mL稀释至50 mL,样品被稀释250倍[1],检测液中DNA浓度稀释至0.4~0.5μg/mL,稀释过度。
1.2.2 改进方法 以无水乙醇沉淀样品中DNA大分子,校正上清液中可溶性小分子物质的干扰。对乙醇pH值、用量、沉淀时间、离心速度、离心时间等条件进行考察。按摩尔磷消光系数计算样品DNA含量,确定乙醇沉淀法的测定条件。
1)乙醇pH值
以稀盐酸调节配制不同pH值的95%的乙醇,以100 μg/mL小牛胸腺DNA钠盐溶液为样品,按下述方法测定样品DNA含量,根据测定值确定乙醇沉淀适宜pH值。
试验管:取7组小试管,按样品溶液与乙醇体积比1∶2的比例加入样品溶液和不同pH值的乙醇,冰浴中沉淀30 min,高速冷冻离心机4℃、8 000 r/min离心10 min,取上清液1.0 mL,去离子水稀释至5.0 mL,去离子水作参比,测上清液在260 nm处的光吸收值,记为A。因溶液的pH值对碱基的光吸收有一定的影响,乙醇在紫外区产生微弱的光吸收,故按下述方法设置对照管和空白沉淀剂管。
对照管:以相应pH值的去离子水替代乙醇,其他同试验管,260 nm处的光吸收值记为A0。
空白沉淀剂管:以去离子水替代样品,其他同试验管,260 nm处的光吸收值记为Ai。
按下式计算DNA含量,确定乙醇适宜pH值。
DNA含量(μg/mL)=((A0-(A-Ai))/0.02)× 稀释倍数。
2)乙醇用量
用1.2.2 1)确定的适宜pH值的乙醇,按不同的样品溶液∶乙醇体积比进行沉淀,分别为1∶1,1∶2,1∶3,1∶4,加入上述确定的适宜pH值的乙醇,其他处理同方法1.2.2 1),同样设置对照管和空白沉淀剂管,并进行数据处理,根据测定结果,确定乙醇用量。
3)沉淀时间
按方法1.2.2 1)及1.2.2 2)确定的乙醇pH值及用量,冰浴条件下,分别沉淀不同时间,其他处理同方法1.2.2 1),确定沉淀时间。
4)离心速度
根据1.2.2 1)、1.2.2 2)、1.2.2 3)确定的乙醇pH值、乙醇用量和冰浴沉淀时间,4℃下,以不同速度进行离心,其他处理同方法1.2.2 1),确定离心速度。
5)离心时间
按上述确定的试验条件处理,沉淀完成后,于4℃、8 000 r/min分别离心10、20、30 min,确定有效离心时间。
1.2.3 改进方法的稳定性及回收试验 以3份自制猪肝DNA样品溶液和1份小牛胸腺DNA溶液为样品,每个样品测定5次,检验方法的稳定性。
每个样品中分别加入不同已知量的小牛胸腺DNA钠盐,测定样品回收率,检测方法的准确性,每个样品测定3次
5.0 mL自制猪肝DNA样品溶液Ⅰ,加1.0 mL去离子水,为样品Ⅰ-1;5.0 mL自制猪肝DNA样品溶液Ⅰ,加1.0 mL 200 μg/mL小牛胸腺DNA溶液,为回收试验样品Ⅰ-2。
4.5 mL自制猪肝DNA样品溶液Ⅱ,加1.5 mL去离子水,为样品Ⅱ-1;4.5 mL自制猪肝DNA样品溶液Ⅱ,加1.5 mL 200 μg/mL小牛胸腺DNA溶液,为回收试验样品Ⅱ-2。
自制猪肝DNA样品溶液Ⅲ,为样品Ⅲ-1;20.0 mL自制猪肝DNA样品溶液Ⅲ,加0.5 mg小牛胸腺DNA钠盐固体,摇匀至完全溶解,定容至25 mL,为回收试验样品Ⅲ-2。
100 μg/mL小牛胸腺DNA钠盐溶液4.8 mL,加1.2 mL H2O,为样品Ⅳ-1,100 μg/mL小牛胸腺DNA钠盐溶液4.8 mL,加0.4 mL 200 μg/mL小牛胸腺DNA钠盐溶液和0.8 mL H2O,为回收试验样品Ⅳ-2。
0.5 mL样品溶液,加pH 3.0的95%乙醇1.0 mL,混匀,冰浴中沉淀40 min,4℃、8 000 r/min离心20 min,取上清液1.0 mL,去离子水稀释至5.0 mL,去离子水调零,测A260,记为A′。参照1.2.2 1)设对照管和空白溶剂管,测260 nm处的光吸收值分别记为,计算样品DNA含量和回收率。
样品回收率=((回收样品DNA量-样品DNA量)/已知DNA加入量)×100%。
2 结果
2.1 钼酸铵-过氯酸沉淀剂存在的问题
2.1.1 钼酸铵-过氯酸沉淀剂本身的干扰 图1为稀释100倍的钼酸铵-过氯酸沉淀剂的吸收谱,在260 nm处的光吸收值达0.141 1,为保证目标物沉淀完全,沉淀剂通常是过量的,这对试验结果产生强烈干扰。
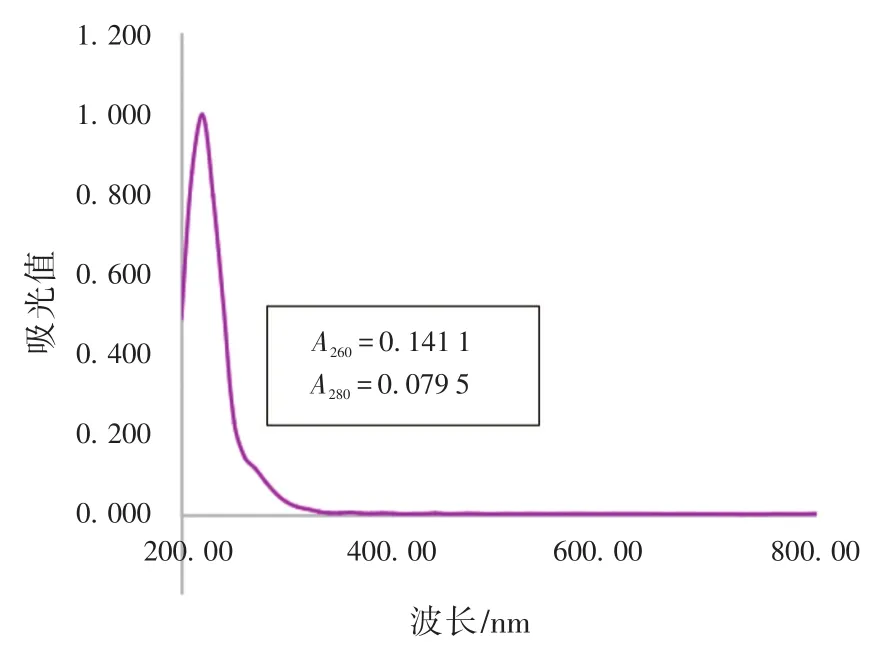
图1 稀释100倍的钼酸铵-过氯酸沉淀剂吸收谱Fig.1 Absorption spectrum of ammonium molybdate-perchloric acid precipitant with 100 times dilution
通过设置空白沉淀剂管以扣除沉淀剂本身的光吸收,可消除部分干扰,但沉淀目标物消耗的沉淀剂量无法确定,由此带来的误差不可忽略。此外,沉淀剂本身的吸收值不稳定,平行测定的相对偏差较大。
钼酸铵-过氯酸沉淀剂在紫外区产生的光吸收主要来自钼酸铵,如图2所示,0.25%的钼酸铵溶液稀释200倍后在260 nm处的光吸收值达0.115 1,钼酸铵溶液产生的紫外吸收较钼酸铵-过氯酸溶液产生的紫外吸收更强烈。试验中还观察到,钼酸铵-过氯酸溶液的pH值约为3,与样品溶液混合,冰浴沉淀后,溶液pH值下降至2,这种酸性环境可能导致DNA变性或降解,影响检测结果。
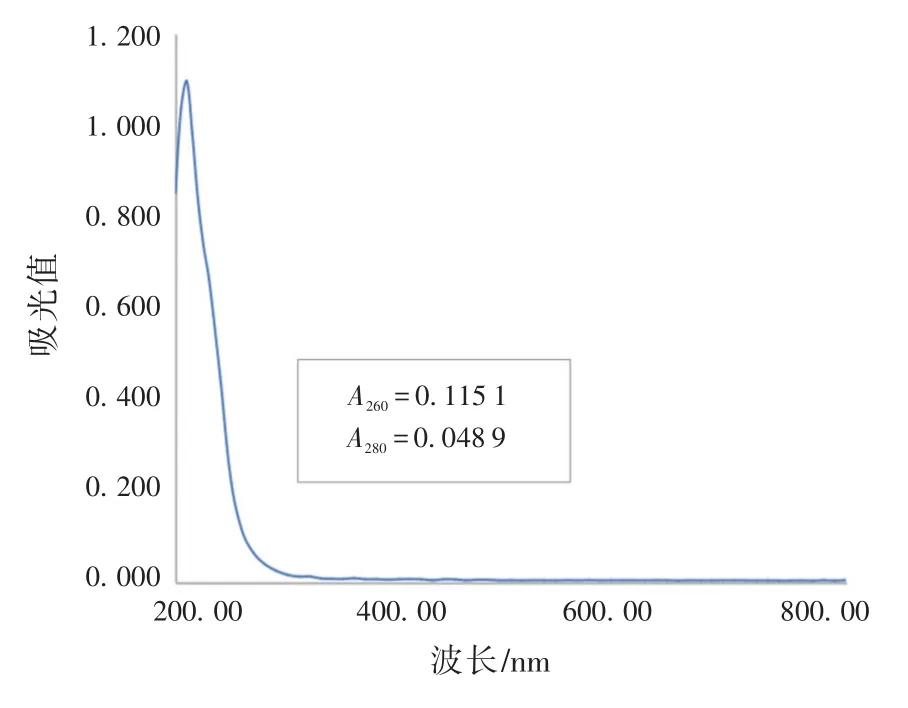
图2 0.25%钼酸铵溶液稀释200倍后的吸收谱Fig.2 Absorption spectrum of 0.25%ammonium molybdate solution with 200 times dilution
2.1.2 钼酸铵-过氯酸沉淀剂对样品的影响 图3是钼酸铵-过氯酸沉淀剂沉淀样品不同时间对上清液在260 nm处光吸收产生的影响。图3显示,随着沉淀剂与样品作用时间延长,代表小分子干扰物的上清液的A260值呈现轻微增大的趋势,从20 min延长到60 min,A260从0.573增加到0.622,意味着沉淀剂与DNA大分子作用不稳定,或沉淀物不稳定,或导致DNA变性甚至降解,对最终结果产生影响。
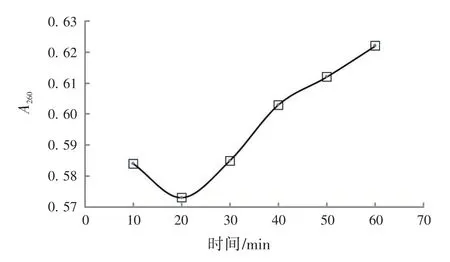
图3 钼酸铵-过氯酸沉淀样品时间对上清液A260值的影响Fig.3 Effect of precipitation time with ammonium molybdate-perchloric acid onA260value of supernatant
2.1.3 原方法过度稀释使测量误差增大 原方法中,样品经一系列处理,最后进行光吸收值测定的溶液,共稀释250倍,假设光吸收值读数至少达到0.1,则原样品浓度至少需要达到1.25 mg/mL。文献[1]提到,样品浓度达到5 mg/mL DNA,最后测定液中样品共被稀释200倍,即使样品为纯DNA,对照管溶液读数也只有0.5左右。多数情况下能够获得的DNA样品很少,难以配成高浓度溶液。同时也浪费样品。
总之,钼酸铵-过氯酸作为沉淀剂会对试验产生较大干扰,而且这种干扰难以消除,有必要对原测定方法进行改进。
2.2 改进方法
以无水乙醇代替钼酸铵-过氯酸作为沉淀剂,通过单因素分析,逐一确定新方法的测定条件。
2.2.1 乙醇沉淀DNA的适宜pH值 以100 μg/mL小牛胸腺DNA钠盐溶液为样品,按1.2.2 1)方法,以pH值分别为5.0、4.5、4.0、3.5、3.0、2.5、2.0的乙醇作为沉淀剂,测得样品的DNA含量见表1。
表1 不同pH值乙醇作沉淀剂测定的DNA含量(±s)Tab.1 DNA content determined with ethanol as precipitant with different pH

表1 不同pH值乙醇作沉淀剂测定的DNA含量(±s)Tab.1 DNA content determined with ethanol as precipitant with different pH
2.0 88.5±4.5 11.5 DNA含量和相对误差DNA含量/(μg·mL-1)相对误差/%5.0 74.8±11.5 25.2 4.5 83.8±10.2 16.2 4.0 86.1±4.7 13.9 pH值3.5 93.3±3.4 6.7 3.0 95.8±2.9 4.2 2.5 87.3±3.0 12.7
由表1可见,以pH 3.0~3.5的乙醇沉淀DNA大分子以校正小分子物质干扰时,可获得较好结果,误差可以控制在5%左右,pH值继续降低,测定结果趋于减小,误差增大。故以下试验采用pH 3.0的95%乙醇作为沉淀剂。
2.2.2 乙醇用量 以不同用量的pH 3.0的乙醇沉淀时,测得样品DNA含量见表2。
表2 不同乙醇用量时测定的DNA含量(±s)Tab.2 DNA content determined with ethanol as precipitant with different amounts

表2 不同乙醇用量时测定的DNA含量(±s)Tab.2 DNA content determined with ethanol as precipitant with different amounts
1∶5 95.0±2.9 5.0 DNA含量和相对误差DNA含量/(μg·mL-1)相对误差%1∶1 80.3±9.3 19.7 1∶2 95.7±3.4 4.3样品∶乙醇体积比1∶3 96.0±4.1 4.0 1∶4 95.8±5.6 4.2
由表2可见,试验条件下,乙醇用量达到2倍体积后,所得结果无明显差异,即2倍体积pH 3.0的95%的乙醇即可使大分子DNA基本沉淀,继续增大乙醇用量,有利于DNA大分子沉淀,但意义不大,故选择2倍体积的pH 3.0的95%乙醇作为沉淀剂。
2.2.3 沉淀时间 以2倍体积的pH 3.0的95%的乙醇分别沉淀样品20、30、40、50、60 min时,测定结果见表3。
表3 乙醇沉淀不同时间所测定的DNA含量(±s)Tab.3 DNA content determined with ethanol as precipitant with different precipitation time

表3 乙醇沉淀不同时间所测定的DNA含量(±s)Tab.3 DNA content determined with ethanol as precipitant with different precipitation time
60 96.0±3.2 4.0 DNA含量和相对误差DNA含量/(μg·mL-1)相对误差/%20 88.5±4.7 11.5 30 95.5±3.1 4.5沉淀时间/min 40 96.0±3.5 4.0 50 95.7±2.2 4.3
表3数据显示,随着沉淀时间延长,测定误差减小,冰浴沉淀30 min即可使大分子DNA沉淀完全,测定误差小于5%,继续延长时间,对沉淀DNA大分子影响不明显,为保证沉淀完全,以下试验选择沉淀40 min。
2.2.4 离心速度 沉淀完成后,采用不同速度离心,测定结果见表4。
表4 不同离心速度时所测DNA含量(±s)Tab.4 DNA content determined with different centrifugation speeds
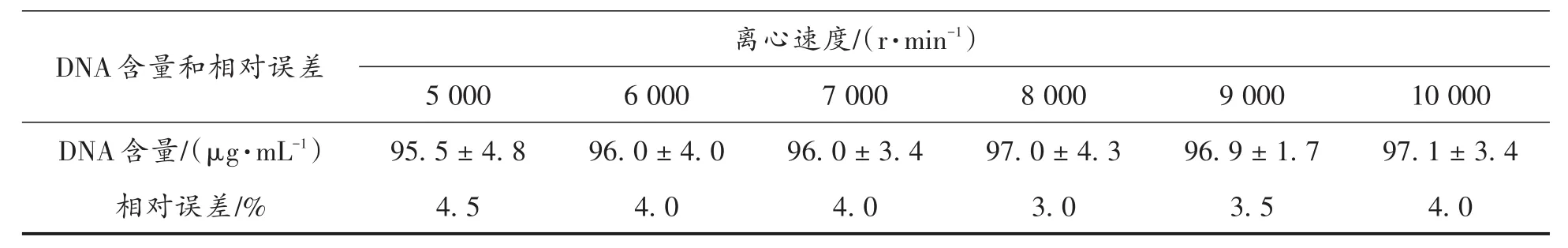
表4 不同离心速度时所测DNA含量(±s)Tab.4 DNA content determined with different centrifugation speeds
10 000 DNA含量和相对误差5 000离心速度/(r·min-1)6 0007 0008 0009 000 DNA含量/(μg·mL-1)相对误差/%95.5±4.8 4.5 96.0±4.0 4.0 96.0±3.4 4.0 97.0±4.3 3.0 96.9±1.7 3.5 97.1±3.4 4.0
由表4数据可知,在考察的离心速度下所得结果误差均小于5%,考虑到对设备的要求,选择转速8 000 r/min进行离心。
2.2.5 离心时间 pH 3.0的95%的乙醇作为沉淀剂,沉淀时间为40 min,离心速度8 000 r/min,离心时间分别为10、20、30 min,测得DNA含量见表5。
表5 离心不同时间时测得DNA含量(±s)Tab.5 DNA content determined with different centrifugation time

表5 离心不同时间时测得DNA含量(±s)Tab.5 DNA content determined with different centrifugation time
30 96.80±2.9 3.2 DNA含量和相对误差DNA含量/(μg·mL-1)相对误差/%10 95.8±1.7 4.2离心时间/min 20 96.2±2.4 3.8
由表5数据可知,离心时间为10 min时,测定结果为95.8 μg/mL,误差4.2%,基本可将DNA大分子沉淀。实际操作时,可根据混合溶液多少,选择离心10~20 min。
2.3 改进方法的稳定性及回收试验
按上述确定的测定条件,以2倍体积、pH 3.0的95%乙醇作为沉淀剂,冰浴沉淀40 min,4℃、8 000 r/min离心10 min,对1.2.3中设计的8个样品进行检测,结果见表6。
表6 方法稳定性试验及回收试验结果(±s)Tab.6 Method stability test and recycling test

表6 方法稳定性试验及回收试验结果(±s)Tab.6 Method stability test and recycling test
DNA含量和回收率DNA含量/(μg·mL-1)回收率/%平均回收率/%Ⅰ-1 141.8±3.3Ⅱ-1 156.3±3.5Ⅲ-1 74.7±5.1样品Ⅳ-1 114.8±2.7Ⅰ-2 175.3±2.2 100.5±3.4Ⅱ-2 205.0±1.6 97.0±3.8Ⅲ-2 87.5±3.4 95.2±5.6Ⅳ-2 358.8±3.8 97.6±1.8 97.7±2.1
表6中数据显示,改进后,4组样品测定结果的标准偏差最高5.1 μg/mL,样品回收率(97.7±2.1)%,方法准确度和精密度均可以满足一般常量和半微量生化组分的检测要求。其中,样品Ⅲ-2检测误差和标准偏差相对较大,主要是Ⅲ-2样品浓度较低,浓度为93.3 μg/mL。在低浓度时,一方面沉淀不完全导致结果偏低,相对误差较大,另一方面,读数误差不可忽视,致使最终检测结果的相对误差和相对标准偏差均较大。
通过对酸性乙醇的沉淀效果和沉淀条件的考察,笔者提出了在DNA紫外吸收定量分析中,校正寡核苷酸等可溶性物质干扰的改进方法,即采用pH 3.0的95%乙醇作沉淀剂,按样品∶酸性乙醇体积比1∶2的用量,冰浴沉淀40 min,4℃、8 000 r/min离心10~20 min,取上清液稀释10倍,去离子水调零,测260 nm处光吸收值,同时设对照管和空白沉淀剂管,扣除空白沉淀剂的吸收值后,根据对照管与试验管的吸光值差值和稀释倍数计算DNA大分子含量。
酸性乙醇在260 nm处的光吸收值很小,对于浓度较大或要求不高的样品可不设空白沉淀剂管。该方法可测定DNA浓度在100 μg/mL以上的样品,相对误差可控值在5%以内,样品浓度过低则误差较大。
3 讨论
原紫外吸收法定量检测DNA时,采用钼酸铵-过氯酸沉淀核酸大分子,检测上清液的光吸收值,以校正可溶性小分子物质的干扰,所用沉淀剂钼酸铵-过氯酸因自身存在紫外吸收而严重干扰检测结果,同时,可能存在对核酸的破坏作用、方法不稳定、重现性很差等问题。
改进后的方法不仅避免了沉淀剂对测定结果的影响,同时具有以下优点:所用试剂简单、安全、操作方便;对仪器设备要求低;不破坏样品,必要时可去除乙醇对核酸进行复性,回收样品;直接根据核酸的摩尔磷消光系数ε(P)进行核酸含量的计算,无需标准物质参比;因此,用于核酸的常规定量十分便利。
由于DNA的摩尔吸光系数仅1 000数量级,灵敏度较低,因此,本方法不适合微量或痕量DNA片段的检出或要求较高的样品检测,对核酸浓度大于75 μg/mL的样品测定结果较准确。测定误差主要来自以下几方面:1)乙醇对核酸大分子的沉淀作用不完全,特别是样品浓度较低时,因沉淀不完全引起的误差较大,应尽量控制样品浓度在100 μg/mL以上;2)乙醇可沉淀RNA和蛋白质等大分子,如样品含有RNA或蛋白质等杂质,将使测定结果偏高,可预先通过A260/A280加以判断,对样品进一步纯化,去除RNA或蛋白质,这是紫外吸收法测定核酸存在的共同问题。
随着核酸技术的发展,核酸定量检测技术的研究也不断向着高通量、高灵敏度和高特异性的方向发展,荧光染料法、实时荧光定量PCR法[4]、数字定量PCR法[5]、共振光散射法[6]等各种相对定量与绝对定量方法逐步建立并完善起来,为核酸的快速高通量检测提供了更灵敏的方法。但这些方法均依赖于特殊的仪器设备,不太适合于基础学科教学,并难以普及,核酸紫外吸收定量检测方法在基础学科教学中仍具有很好的实用意义。
致谢:本研究得到武汉理工大学生物技术系郭海英老师和刘念博士的大力支持和帮助,并在多届武汉理工大学生物技术专业学生参与的课外研究讨论下完成,在此,一并表示衷心的感谢!
