沉淀法处理含铜废水及其沉淀产物的表征
2011-12-08李新颖FrancisRuzagilizaInnocent陈泉源
李新颖,Francis Ruzagiliza Innocent,陈泉源,薛 罡
(东华大学环境科学与工程学院,上海 201620)
沉淀法处理含铜废水及其沉淀产物的表征
李新颖,Francis Ruzagiliza Innocent,陈泉源,薛 罡
(东华大学环境科学与工程学院,上海 201620)
采用Ca(OH)2、Na2CO3和Na2S作为沉淀剂处理模拟酸性含铜废水。实验结果表明:对铜离子去除率由高至低的顺序为Ca(OH)2>Na2CO3>Na2S;沉淀60 m in后,污泥沉降体积由高至低的顺序为Na2CO3>Ca(OH)2>Na2S;上清液浊度由高至低的顺序为Ca(OH)2>Na2CO3>Na2S。沉淀剂为Ca(OH)2时,随溶液pH升高,上清液ζ电位绝对值减小;沉淀剂为Na2CO3和Na2S时,随溶液pH升高,上清液ζ电位绝对值增大。沉淀剂为Ca(OH)2时,沉淀污泥中主要含有CaSO4·2H2O和CuO;沉淀剂为Na2CO3时,沉淀污泥中主要含有Cu4(SO4)(OH)6·2H2O;沉淀剂为Na2S时,沉淀污泥中主要含有CuS和CuSO4·5H2O。Ca(OH)2作为沉淀剂优势明显。
含铜废水;沉淀法;沉淀剂;ζ电位;浊度;污泥
在冶炼、金属加工、机器制造、有机合成等工业废水中常含有铜离子,约为几十至几百mg/L。铜离子不能被生物降解为无害物,因此有很强的环境毒性,含铜酸性废水对人体和环境造成的危害十分严重[1]。去除废水中的铜离子一般采用沉淀法,通常使用的沉淀剂有石灰、苛性碱、苏打及磷酸盐等。此外,电解法、吸附法、离子交换法、离子螯合法等也可用于去除废水中的铜离子[2-4]。这些方法虽具有净化效率高、周期短等优点,但实际操作繁琐、投资大、运行成本高,且存在二次污染的风险[5]。中和沉淀法,即向酸性废水中加入碱,提高废水pH,使铜离子与阴离子反应,生成难溶于水的沉淀,降低废水中铜离子含量而使废水达到排放标准[1]。然而中和沉淀法处理铜离子废水时产生的矾花小、易碎,不易泥水分离,容易造成重金属离子浓度超标[6]。污泥处理处置也是一个需要解决的问题,否则可能导致二次污染。因此,需要从理论上研究铜离子的化学沉淀过程及对沉淀产物进行表征。
本工作比较了Ca(OH)2、Na2CO3和Na2S对模拟酸性含铜废水的处理效果,通过测定上清液ζ电位、上清液浊度和污泥沉降体积等指标,结合溶液化学平衡分析及沉淀产物的结构表征,比较了3种沉淀剂的处理效果。
1 实验部分
1.1 试剂和仪器
CuSO4·5H2O、Ca(OH)2、Na2CO3、Na2S和HNO3均为分析纯;微孔滤膜:φ100 mm,孔径0.45μm。
DHG-9123A型电热恒温鼓风干燥箱:上海一恒科技有限公司;Max-2550PC型X射线衍射(XRD)仪:日本Rigaku公司;WRT-2P型热重(TG)分析仪:上海精密科学仪器有限公司;Z-2000型原子吸收分光光度计:日本日立公司;GG317-Zeta Meter-3.0型电位仪:英国Malvern公司;WGZ-1型散射光浊度仪:上海昕瑞仪器有限公司;PHS-3C型精密pH计:上海盛磁仪器有限公司。
1.2 实验方法
采用CuSO4·5H2O配制铜离子质量浓度为100 mg/L的模拟含铜废水。向含铜废水中分别加入一定量的Ca(OH)2、Na2CO3和Na2S沉淀剂,快速搅拌3min,再慢速搅拌7 min,测定溶液pH,测定沉降过程中不同时间的上清液浊度和沉降污泥体积。沉降后上清液分两部分,一部分用于测量ζ电位,另一部分经0.45μm滤膜过滤后用HNO3酸化至pH小于2,通过原子吸收分光光度计测定溶液中铜离子剩余浓度,计算铜离子去除率。沉降污泥于105℃干燥24 h,研磨至粒径小于1 mm。
1.3 分析表征方法
采用原子吸收分光光度计测定溶液中铜离子质量浓度;采用散射光浊度仪测定上清液的浊度;采用XRD仪测定污泥中主要的物质存在形式;采用TG分析仪测定污泥的TG-DTG曲线。
2 结果与讨论
2.1 n(沉淀剂)∶n(铜离子)对铜离子去除率的影响
n(沉淀剂)∶n(铜离子)对铜离子去除率的影响见图1。由图1可见:Ca(OH)2作沉淀剂时,铜离子去除率几乎为100%;Na2CO3作沉淀剂时,n(沉淀剂)∶n(铜离子)为2.0时,铜离子去除率最大,为99.80%,这是因为沉淀不完全或形成了可溶性的碳酸化合物Cu(CO3)22-和CuCO3[6];Na2S作沉淀剂时,n(沉淀剂)∶n(铜离子)为2.0时,铜离子去除率最大,为99.89%,因为形成了CuS(HS)22-或CuS(HS)33-等可溶性硫化物[7],或因溶液饱和度过高,某些直径小于0.45μm的沉淀物透过滤膜所致。故3种沉淀剂对铜离子去除率的高低顺序是Ca(OH)2>Na2CO3>Na2S。

2.2 溶液中金属离子形态的模拟计算
n(沉淀剂)∶n(铜离子)对溶液pH的影响见图2。由图2可见:随着n(沉淀剂)∶n(铜离子)的增大,溶液pH增大;沉淀剂为Ca(OH)2时,溶液pH范围为9.38~11.46;沉淀剂为Na2CO3时,溶液pH范围为6.00~9.92;沉淀剂为Na2S时,溶液pH范围为5.52~11.33。

溶液中金属离子的水解和聚合形态与溶液pH有密切关系。根据溶液中化学平衡常数、溶度积常数、离解平衡常数[5,7-9]可绘制元素的各种存在形态随溶液pH变化的分布曲线[10-11]。
溶液中钙元素形态和硫元素形态分布的模拟计算结果见图3和图4。

由图3可见:溶液pH小于10.00时,Ca2+为主要存在形态;溶液pH为10.00~14.00时,Ca2+含量逐渐下降,溶液pH为12.60时,CaOH+含量达到最大值;从11.50开始随溶液pH升高,Ca(OH)02含量逐渐上升。沉淀剂为Ca(OH)02时,溶液pH范围为9.38~11.46,溶液中主要含有 Ca2+、CaOH+。由图4可知:沉淀剂为Na2S时,溶液pH范围为10.04~11.33,硫离子基本上以HS-形式存在。
溶液中铜离子分布的模拟计算结果见图5。由图5a可知,沉淀剂为Ca(OH)02时,溶液pH小于7.30,主要以Cu2+及少量CuOH+和Cu(OH)02存在;溶液pH为7.30~11.59,主要以Cu(OH)02形态存在,及少量的Cu(OH)3-和CuOH+等;溶液pH为9.10,Cu(OH)02的摩尔分数超过90%;pH为10.68~11.59时,Cu(OH)02含量逐渐减少,Cu(OH)3-含量显著增加;pH大于11.59时,主要以Cu(OH)3-以及少量Cu(OH)24-和Cu(OH)02形态存在。本实验沉淀剂为Ca(OH)02时,溶液 pH为9.38~11.46,主要以Cu(OH)02、Cu(OH)3-及少量Cu(OH)24-形态存在,因此推测沉淀将以CaSO4·2H2O、Cu(OH)02和CuO等形式存在。
由图5b可知,沉淀剂为Na2CO3、n(Na2CO3)∶n(铜离子)=1.0时,溶液pH为5.60~9.10,主要以CuCO03形态存在;溶液pH为8.00~14.00时,主要以Cu(OH)02、Cu(OH)-3和Cu(OH)2-4存在。沉淀剂为 Na2CO3,本实验溶液 pH范围为6.00~9.92,溶液中主要含有Cu2+、CuOH+、Cu(OH)02和CuCO03,推测沉淀将以Cu4(SO4)(OH)6·2H2O、Cu4(SO4)(OH)6或Cu2(OH)2CO3等形式存在。

沉淀剂为Na2S、n(Na2S)∶n(铜离子)=1.0时,溶液 pH为0~5.00时,CuHS+摩尔分数从100%降至几乎为0,Cu(HS)02迅速上升成为优势存在形态。沉淀剂为Na2S时,本实验溶液pH范围为5.52~11.33,由图5c可知溶液中含有Cu(HS)02,实际还应含有CuS(HS)2-2和CuS(HS)3-3等[12],这可能是沉淀剂为Na2S时,铜离子去除率比较低的原因,推测沉淀将以CuS形式存在。
2.3 溶液pH对上清液ζ电位的影响
溶液pH对上清液ζ电位的影响见图6。由图6可见,在所测pH范围内,上清液ζ电位均呈负值,未出现等电点,由此证明胶体颗粒表面带有负电荷。

沉淀剂为Ca(OH)2时,随溶液pH升高,上清液ζ电位绝对值减小,ζ电位从-19.6 mV变为-6.9 mV,溶液稳定性降低,可能是因为与胶体粒子带电符号相反的Ca2+和CaOH+吸附在表面造成的;随着溶液pH继续升高,上清液ζ电位从-6.9 mV变为-8.3 mV,可能是由于OH-与Cu(OH)2作用逐渐形成Cu(OH)-3和Cu(OH)2-4,导致Cu(OH)2胶体颗粒稳定性升高。
沉淀剂为Na2CO3时,随溶液pH升高,上清液ζ电位绝对值增大,ζ电位从-11.43 mV变为-33.5 mV,溶液稳定性升高。
沉淀剂为Na2S时,随溶液pH升高,上清液ζ电位绝对值增大,ζ电位从-13.3 mV变为-29.0 mV,溶液稳定性升高。根据溶液中硫离子形态的模拟计算可知,溶液pH为5.52~11.33时,HS-含量增加,故可能是因为固体微粒 CuS表面吸附了HS-,形成了带负电荷的CuS(HS)2-2和CuS(HS)3-3胶体粒子。
2.4 溶液pH对污泥沉降体积的影响
溶液pH对污泥沉降体积的影响见图7。由图7可见:沉淀剂为Ca(OH)2时,搅拌结束后沉淀时间较短时,污泥体积随溶液pH的增大先升高后降低,沉淀60 min后污泥体积则表现为随溶液pH的增大而降低;沉淀剂为Na2CO3时,沉淀时间较短时,污泥体积随溶液pH的增大先降低后升高,沉淀60 min后污泥体积稳定在20 m L左右;沉淀剂为Na2S时,污泥体积随溶液pH的增大而降低,当溶液pH大于10.8时,沉淀60 min后污泥体积稳定在3 m L。经60 min沉淀后,沉淀剂为Na2CO3的污泥沉降体积最高,为16~23 m L;Ca(OH)2次之,为8~21 m L;Na2S最小,为3~8 m L。污泥沉降体积由高至低的顺序为Na2CO3>Ca(OH)2>Na2S。溶度积常数从大到小的排列是:CuCO3>Cu(OH)2>CuS,即CuS污泥体积最小,可能是因为形成的CuS颗粒小,易凝聚成大颗粒的缘故。

2.5 沉淀剂对上清液浊度的影响
沉淀剂对上清液浊度的影响见图8。由图8可见,3种沉淀剂处理后上清液浊度均在沉淀5 min后迅速下降,沉淀5~60 min内上清液浊度变化不明显。沉淀剂处理后按上清液浊度大小排列顺序为Ca(OH)2>Na2CO3>Na2S。
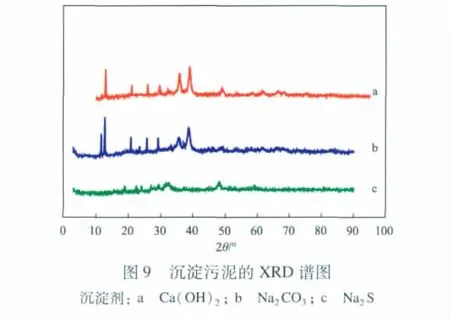
2.6 沉淀污泥中物质的存在形式
沉淀污泥的XRD谱图见图9。由图9可见:沉淀剂为Ca(OH)2时,沉淀污泥中主要含有CaSO4· 2H2O和CuO;沉淀剂为Na2CO3时,沉淀污泥中主要含有Cu4(SO4)(OH)6·2H2O;沉淀剂为Na2S时,沉淀污泥中主要含有CuS和CuSO4·5H2O。

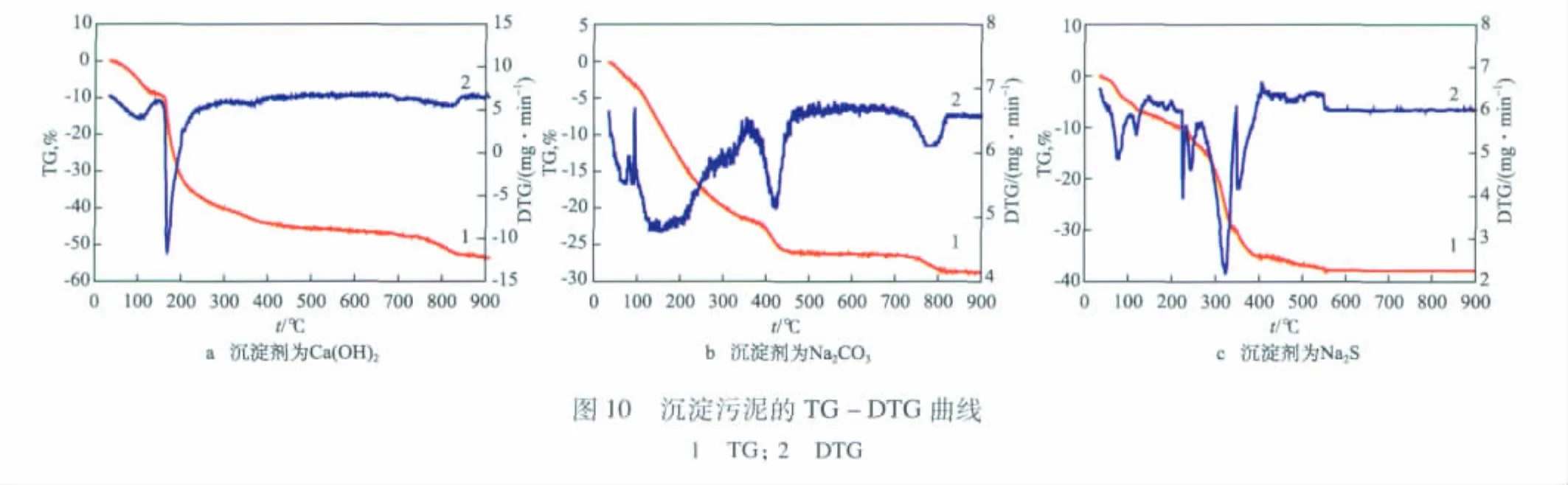
沉淀污泥的TG-DTG曲线见图10。由图10 a可见,Ca(OH)2为沉淀剂时,沉淀污泥在32~148℃阶段失重,原因可能是沉淀物失去结晶水;在148~ 300℃阶段失重,原因可能是CaSO4·2H2O失去结晶水;在720~850℃阶段失重,原因可能是CuSO4分解生成CuO。
由图10 b可见,Na2CO3为沉淀剂时,沉淀污泥在34~350℃阶段失重,原因可能是Cu4(SO4)(OH)6· 2H2O脱掉结晶水;在350~500℃阶段失重,原因可能是Cu4(SO4)(OH)6分解时脱羟基生成了Cu4SO4O3和3H2O;在700~830℃阶段失重,原因可能是CuSO4分解生成CuO。
由图10 c可见,Na2S为沉淀剂时,在100℃之前有两个失重峰,可能是沉淀物失去结晶水;在100~350℃阶段失重,原因可能是CaSO4失去结晶水;在650~830℃阶段失重,原因可能是CuSO4分解生成CuO。
从铜离子去除率、污泥处理处置以及处理成本等方面考虑,Ca(OH)2作为沉淀剂具有明显的优势。
3 结论
a)采用Ca(OH)2、Na2CO3和Na2S作为沉淀剂处理模拟酸性含铜废水,对铜离子去除率由高至低的顺序为Ca(OH)2>Na2CO3>Na2S;沉淀60 m in后,污泥沉降体积由高至低的顺序为 Na2CO3> Ca(OH)2>Na2S;上清液浊度由高至低的顺序为Ca(OH)2>Na2CO3>Na2S。
b)沉淀剂为Ca(OH)2时,随溶液pH升高,上清液ζ电位绝对值减小,ζ电位从-19.6 mV变为-6.9 mV;沉淀剂为Na2CO3时,随溶液pH升高,上清液ζ电位绝对值增大,ζ电位从-11.43 mV变为-33.5 mV;沉淀剂为Na2S时,随溶液pH升高,上清液ζ电位绝对值增大,ζ电位从-13.3 mV变为-29.0 mV。
c)沉淀剂为Ca(OH)2时,沉淀污泥中主要含有CaSO4·2H2O和CuO;沉淀剂为Na2CO3时,沉淀污泥中主要含有Cu4(SO4)(OH)6·2H2O;沉淀剂为Na2S时,沉淀污泥中主要含有 CuS和 CuSO4· 5H2O。
d)从铜离子去除率、污泥处理处置及处理成本等方面考虑,Ca(OH)2作为沉淀剂优势明显。
[1] 陈津,王克勤.冶金环境工程[M].湖南:中南大学出版社,2009:67-151.
[2] 姜力强,郑精武,刘昊,等.电解法处理含氰含铜废水工艺研究[J].水处理技术,2004,30(3):153-156.
[3] 谢德华,施周,谢鹏,等.颗粒物对无电压作用下离子交换膜分离去除铜离子的影响[J].环境工程学报,2010,4(6):1247-1250.
[4] 莫瑜,潘蓉,黄海伟.毛木耳和白木耳子实体对Cd(Ⅱ)、Cu(Ⅱ)、Pb(Ⅱ)、Zn(Ⅱ)的吸附特性研究[J].环境科学,2010,31(7):1566-1574.
[5] 吴佳,张振忠,赵芳霞.硼氢化钠还原法回收电镀废液中的铜[J].化工环保,2010,30(4):327-331.
[6] 李博,刘述平.含铜废水的处理技术及研究进展[J].矿产综合利用,2008,5:33-37.
[7] Demopoulos G P.Aqueous precipitation and crystallization for the production of particulate solids with desired properties[J].Hydrometallurgy,2009,96:199-214.
[8] Alison E L.Review ofmetal sulphide precipitation[J].Hydrometallurgy,2010,104:222-234.
[9] Stumm W,Morgan J J.Aquatic chem istry:Chem ical equilibria and rates in naturalwaters(3rd edition)[C].New York:John W iley&Sons,1996:16-204.
[10] Bratland D H,Grong O,Shercliff H,et al.Modelling of precipitation reactions in industrial process[J].Acta Materialia,1997,45:1-22.
[11] 常皓,柴立元,王云燕,等.Cu2+-H2O系羟合配离子配位平衡研究[J].矿冶工程,2007,27(6):37-40.
[12] 王淀佐,胡岳华.浮选溶液化学[M].湖南:湖南科学技术出版社,1988:336-337.
[13] Luther W,Rickard D T,Theberge S,et al.Determ ination of(bi)sulfide stability constants of Mn2+,Fe2+,Co2+,Ni2+,Cu2+and Zn2+by voltammetric methods[J].Environ Sci Technol,1996,30:671-679.
Treatment of Copper-Containing W astewater by Precipitation and Characterization of Precipitate
Li Xinying,Francis Ruzagiliza Innocent,Chen Quanyuan,Xue Gang
(School of Environmental Science and Engineering,Donghua University,Shanghai201620,China)
The simulated acidic copper-containing wastewater was treated using Ca(OH)2,Na2CO3and Na2S as precipitants.The experimental results show that:The order of copper ion removal rates is Ca(OH)2>Na2CO3>Na2S;After precipitation for60m in,the order of sludge sedimentation volumes is Na2CO3>Ca(OH)2>Na2S;The order of the supernatant turbidities is Ca(OH)2>Na2CO3>Na2S.with the increasing of the solution pH,the absolute value ofζpotential of the supernatant decreases for Ca(OH)2precipitant.but increases for Na2CO3and Na2S precipitants.When Ca(OH)2is used as precipitant,the main precipitates are CaSO4·2H2O and CuO;When Na2CO3is used as precipitant,themain precipitate is Cu4(SO4)(OH)6·2H2O;When Na2S is used as precipitant,the main precipitates are CuS and CuSO4·5H2O.The advantage of using Ca(OH)2as precipitant is evident.
copper-containing wastewater;precipitation method;precipitant;ζpotential;turbidity; sludge
TQ116.2
A
1006-1878(2011)04-0298-06
2011-02-15;
2011-04-05。
李新颖(1987—),女,湖北省黄石市人,博士生,主要研究方向为重金属污染治理。电话021-67792540,电邮wcchenwei@mail.dhu.edu.cn。
上海市重点学科建设项目基金资助项目(B604)。
(编辑 祖国红)
