肝段显色技术在解剖性肝切除中的应用价值
2019-02-26陈继业刘志伟辛宪磊任为正蔡守旺
陈继业,刘志伟,辛宪磊,任为正,蔡守旺
(解放军总医院第一医学中心肝胆外科,北京 100853)
由于肝细胞癌沿门脉系统扩散的生物学特性,解剖性肝段切除是其最佳外科治疗方案[1-4]。然而,术中对肝段边界的精确标定是实施解剖性肝段切除的关键。我们常规采用持久美蓝染色法,该法不仅可以明确肝段表面界限,同时还可以进一步明确肝实质内的肝段边界[5-6]。然而,对于存在解剖变异由多支肝蒂供血或供血肝蒂位置深在的病人,单纯采用循肝门肝蒂解剖的技术往往比较困难。鉴于此,我们将现有技术有机结合,采用以持久美蓝染色法为主结合超声引导下肝段门脉穿刺染色和Glisson蒂横断技术来施行解剖性肝段切除。本研究回顾分析2018年1月至2018年11月解放军总医院第一医学中心肝胆外科收治的19例采用该技术方法进行解剖性肝段切除肝细胞癌病人的临床资料,旨在探讨肝段显色技术联合应用在解剖性肝段切除中的价值。
资料与方法
一、一般资料
本组肝癌病人19例,其中男性14例,女性5例;年龄37~72岁,平均年龄54岁。所有病人肝功能均Child-Pugh A级,吲哚菁绿(indocyanine gree,ICG)15 min滞留率<10%。所有病人均常规进行增强CT或MRI检查明确诊断,了解肝脏解剖、血管胆管与肿瘤毗邻关系,同时通过EDDA公司软件进行三维重建从三维角度进一步明确拟切除荷瘤门脉流域。
二、手术方法
所有病例均采用开腹方式进行。常规采用右上腹反“L”型切口。肝十二指肠韧带预置阻断带。打开肝门板,于Glisson鞘外解剖,游离出拟切除肝段相应的左和(或)右侧肝蒂。根据术前影像提示,继续于鞘外向上一级肝蒂解剖。如拟切除流域为多支肝蒂供血或供血肝蒂位置深在,单纯采用循肝门肝蒂解剖技术向上寻找拟切除肝段供血肝蒂困难,我们结合采用超声引导下肝段门脉穿刺染色技术或(和)Glisson蒂横断技术来确定拟切除范围及肝实质内离断切面。随后离断肝周韧带,入肝血流阻断,采用钳夹法离断肝实质,所遇管道予以结扎后切断,完整切除目标肝段。
以肿瘤位于肝S8病人为例(图1)。术前影像检查明确肝S8血供来自腹侧支及背侧支。术中于鞘外游离出右前肝蒂,动脉夹阻断后观察肝脏表面缺血范围进一步证实。由于肝S8两支肝蒂位置深在,循肝门肝蒂解剖技术难以达到,遂于肝正中裂离断肝实质。于实质内先行寻找到S8腹侧支,直视下用20G套管针穿刺该肝蒂门脉,拔除针芯。当血液流出后注入美蓝5 ml,拔除套管针并立即结扎S8腹侧支。此时可见S8腹侧亚段染色明显。沿蓝染边界进一步离断肝实质,寻找到S8背侧支,同法进行美蓝染料注射,可见S8染色完全、清晰。随后沿蓝染边界(包括肝实质内界限)将染色肝段完整切除。
以肿瘤位于肝S6+S5d病人为例(图2)。术前影像明确肿瘤位于S6+S5d,S6供血肝蒂分散且与肿瘤关系密切,难以逐支鞘外游离。术中先于鞘外解剖出右后肝蒂,动脉夹试行阻断,标记出肝右后叶缺血边界。于肝门处继续鞘外游离出S5背侧肝蒂,直视下用20G套管针穿刺该肝蒂门脉,拔除针芯。当血液流出后注入美蓝5 ml,拔除套管针并立即结扎S5背侧支。术中超声探查,探寻到供应S7门脉分支,超声引导下20G穿刺针穿刺S7门脉,注入美蓝染料5 ml,可见肝S7明显蓝染。通过对染法标定出S6边界,随后沿标记边界(包括肝实质内界限)将目标肝段完整切除。
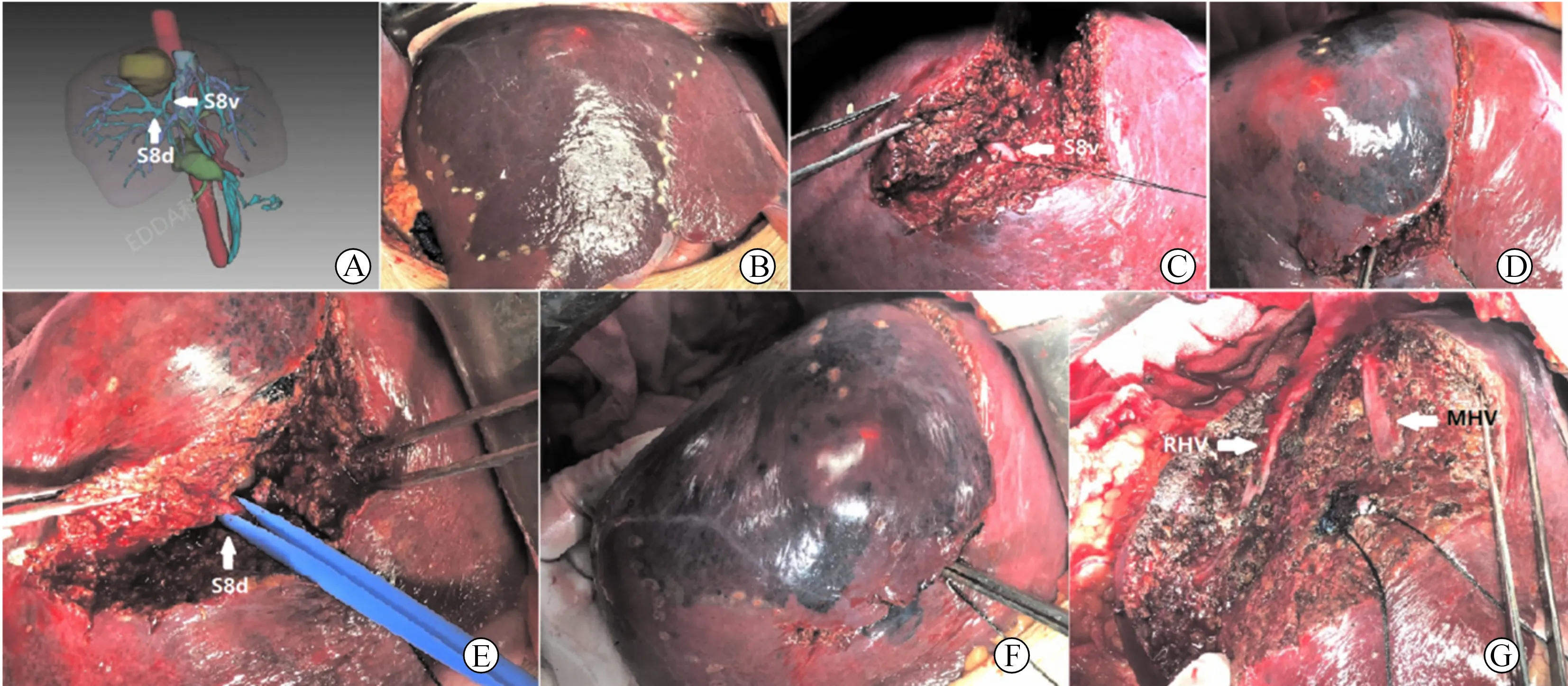
图1 肝S8切除实例 A.术前3D重建显示肝S8供应肝蒂为两支,分别为腹侧支及背侧支;B.鞘外游离出右前肝蒂,试阻断后显示右前区域肝缺血边界;C.肝正中裂离断肝实质,于实质内寻找到S8腹侧支;D.于S8腹侧支注入美蓝染料后肝表面出现S8腹侧段蓝染范围;E.于肝实质内寻找到S8背侧支;F.于S8背侧支注入美蓝染料后肝表面出现S8蓝染范围;G.肝切除后肝段面情况,可见裸露的右肝及中肝静脉,丝线结扎处为S8腹侧及背侧肝蒂断端
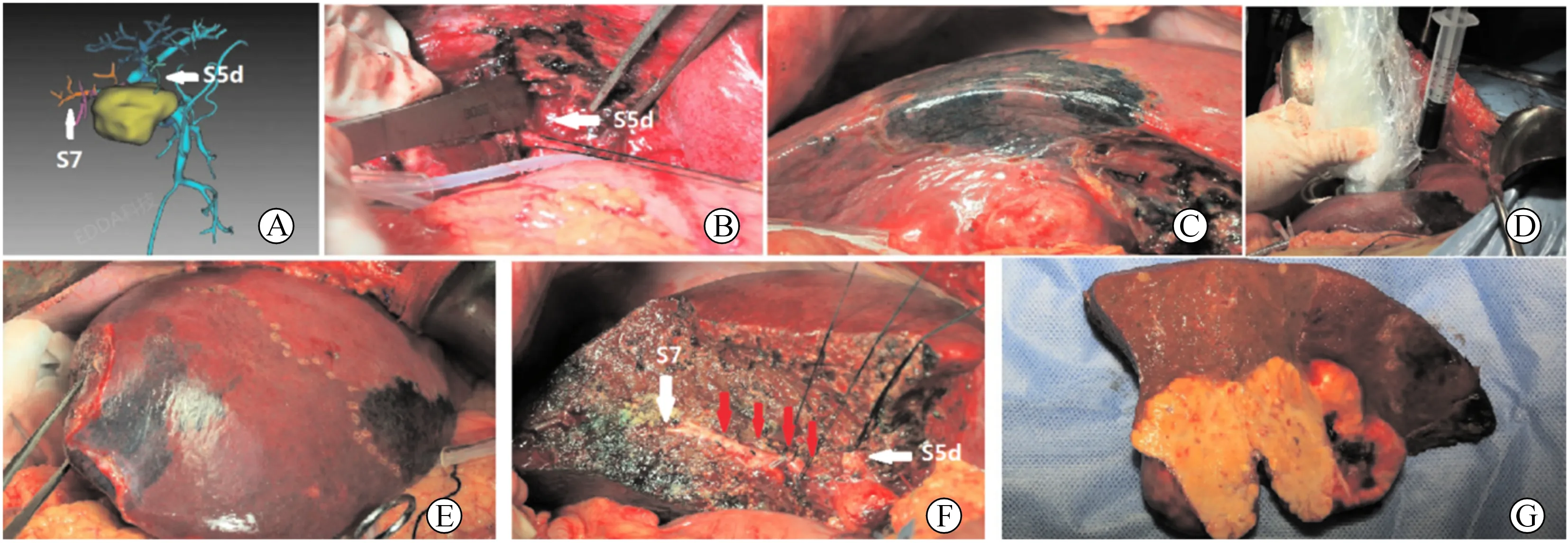
图2 肝S6+S5d切除实例 A.术前3D重建显示肝S6供血肝蒂分散且与肿瘤关系密切,同时S5d参与肿瘤供血;B.鞘外游离出S5背侧肝蒂;C.于S5背侧支注入美蓝染料后肝表面出现S5背侧段蓝染范围;D.术中超声探查,探寻到供应S7门脉分支,超声引导下穿刺S7门脉,注入美蓝染料;E.图片显示肝右后缺血区域,以及蓝染的S5d及S7区域;F.肝切除断面,标红色箭头显示为S6肝蒂断端,肝段面保留蓝染区域为肝S7;G.术后肿瘤大体标本情况
结 果
本组病人中,染色成功率为100%。根据持久的染色效果,可以精确地选择手术离断面。其中肝段切除9例,包括S5 2例,S6 2例,S7 2例,S8 3例;亚肝段切除5例,包括S4b 1例,S8v 2例,S8d 2例;联合肝(亚)段切除5例,包括S5+S8v 2例,S5+S8d 2例,S6+S5d 1例。手术时间为(178±48) min,术中出血量为(256±106) ml,无病例术中输血。术后病人均恢复良好,2例病人出现腹腔腹水,拔除引流管予以对症利尿治疗后腹水控制良好,所有病人术后均未出现出血、胆瘘、腹腔感染等严重并发症。术后住院时间为(8±1)d。所有病人术后病理回报均证实为肝细胞癌,切缘未见癌组织浸润。
讨 论
肝细胞癌易侵犯癌旁门静脉,形成门静脉癌栓及其相应支配区域卫星灶,具有沿荷瘤肝段门静脉支进行播散的生物学特性,因而解剖性肝段切除可以在完整去除病灶同时最大限度地保护剩余肝脏功能,目前认为是肝细胞癌最佳外科治疗方案[1-4]。文献报道解剖性肝段切除可以显著提高肝细胞癌病人预后,5年生存率可以达到60%~65%;我们的研究结果也进一步证实了解剖性肝段切除在肝细胞癌治疗上的优越性[1,7]。
然而,术中对肝段边界的精确标定一直是困扰肝胆外科医生的一大难题,亦是施行解剖性肝段切除的关键。目前临床常用的技术方法有以下四种:①表面解剖标志联合术中超声;②Makuuchi等[8]提出的在术中超声引导下向目标肝段的门静脉支注射美蓝,使相应肝段染色;③Takasaki等[9-12]提出的Glisson蒂横断式肝切除法;④Launois 等[13]提出的循肝门肝蒂解剖技术。然而,这些方法均存在自身的局限性。随着数字外科技术平台以及三维可视化肝脏模型技术的应用,越来越多的证据显示通过解剖标志以及肝静脉门静脉分支来进行肝段划分的Couinaud分段法并不能准确地划分实际的肝脏门脉流域[14-15],因此采用第一种方式进行的肝段标定并不能准确地反应出拟切除肝段的实际范围。Makuuchi等[8]提出的染色技术对术中超声定位以及穿刺技术的要求较高,对于多支肝蒂供血的病例进行逐支穿刺完成难度大。Takasaki等[9-12]提出的技术由于寻找肝蒂过程中需要劈离部分肝实质,在此过程中会损失部分肝组织。Launois 等[13]提出的方法需循肝门向上鞘外游离肝蒂分支,解剖难度大,尤其对于肝硬化的病人该技术会增加手术时间及出血量。另外,上述四种技术均存在共同的问题,即这些方法标定的肝段边界只能在肝脏表面显示,其实质内的界限并不能精准标记。鉴于此,我们创用了持久美蓝染色技术[5-6],该方法采用Launois 等[13]提出的循肝门肝蒂鞘外解剖技术同时结合美蓝染色,它不仅可以标定出肝脏表面边界,同时在实质内亦可显示肝段界限,提高了手术的精准性。但这一技术同样存在手术难度相对大,操作复杂的问题,尤其对于多支肝蒂供血或供血肝蒂位置深在的病人更增加了应用难度,因此临床推广受限。
针对上述方法的局限性,我们将现有技术有机结合,采用以持久美蓝染色法为主结合超声引导下肝段门脉穿刺染色和(或)Glisson蒂横断技术来施行解剖性肝段切除。该技术方法具有三大优势:①相对于单纯的持久美蓝染色法,肝段显色技术的综合应用提高了肝段染色的成功率;本组病例中大部分为复杂联合肝(亚)段切除以及中央区域肝段(例如S7、S8)切除手术,应用常规技术难以达到满意的肝段染色效果,我们的染色成功率达到100%。②肝段显色技术降低手术操作难度,提高手术安全性;本组病例手术出血量显著低于我们既往病例统计数据[(256±106) ml比(478±508) ml][7],也进一步证实了这一点。③不论是通过循肝门鞘外解剖亦或是结合Takasaki等[9-12]技术,寻找到目标肝蒂后我们均采用肝蒂注射美蓝结扎的持久染色方法,这样同样可以在实质内显示肝段界限,提高了手术的精准性。
在临床实践过程中我们体会到:①精确的术前影像评估尤其是三维重建技术非常重要,术前需要明确拟切除肝段的供应肝蒂以及其供应的门脉流域,这样才能做好术前规划,便于术中精准实施;②应根据病人肿瘤的部位以及相应肝段的解剖学特征选择个体化的联合应用技术方案。对于位于中央区域肝段(例如S7、S8)切除手术,由于肝蒂位置深在,我们通常采用循肝门肝蒂鞘外解剖技术联合Glisson蒂横断技术来寻找相应的供血肝蒂。对于拟切除肝段血供来源于多支门脉分支或肿瘤位于2个肝段之间需行联合肝(亚)段切除手术,由于需要染色肝蒂数目较多,难以逐支寻找,我们通常采用循肝门肝蒂鞘外解剖技术联合术中超声引导门静脉穿刺染色技术来达到明确切除肝段边界的目的。
综上,目前的肝段边界标定技术均存在各自的局限性,在解剖性肝段切除治疗领域,这些技术并不是孤立存在的,他们互为补充,治疗中应充分利用其各自的技术优势,针对病人的具体情况作出个体化的联合应用方案。本研究数据显示应用这一联合肝段显色技术模式可以使解剖性肝段切除手术更加安全、简便,可重复性高,利于临床进一步推广,进而提高肝细胞癌的远期疗效。
