吲哚菁绿荧光显像引导在腹腔镜肝中叶切除术中的应用
2019-02-26张中林张潇李锟常磊潘定宇杨智勇何跃明刘志苏袁玉峰
张中林,张潇,李锟,常磊,潘定宇,杨智勇,何跃明,刘志苏,袁玉峰
(武汉大学中南医院肝胆胰外科,湖北 武汉 430071)
临床上一般将位于Couinaud分段4、5、8段的良恶性肿瘤称为中央区肝脏肿瘤。该部位肿瘤常常紧邻第一、二肝门及肝后下腔静脉等特殊解剖位置,手术难度大,风险高。对于中央区肝肿瘤的病人,既往多采用半肝切除及扩大半肝切除术,该术式需大范围切除肝实质,损失功能肝体积达70%~80%。我国绝大部分肝癌病人合并慢性肝病及肝硬化背景[1],如此大范围的肝切除无疑加重了病人术后发生肝衰竭及其他并发症的潜在风险[2]。因此,肝中叶切除术成为部分中央区肝肿瘤的重要治疗手段。自2016年以来,我们中心将术前三维可视化评估、术中吲哚菁绿(indocyanine green,ICG)荧光显像引导及B超定位等精准肝切除技术应用于腹腔镜下的肝中叶切除,积累了初步的经验,现报告如下。
资料与方法
一、临床资料
2016年9月至2018年11月,我科实施肝中叶切除术治疗中央区肝肿瘤24例,其中开腹肝中叶切除术11例,ICG荧光显像引导腹腔镜下中肝切除术13例。男性17例,女性7例,年龄39~73岁,平均52.3岁。其中肝细胞癌15例,胆管细胞癌1例,混合性肝癌2例,乳腺癌肝转移1例,结直肠癌肝转移2例,胰腺癌肝转移1例,肝血管瘤1例,肝血管脂肪瘤1例。24例中有4例合并乙型肝炎肝硬化。依据肿瘤部位,参照四川大学华西医院提出的分型方法[3],分型如下:Ⅰ型:肿瘤局限于中肝下区(S5,S4b,或S5+S4b);Ⅱ型:肿瘤位于中肝上区邻近第二肝门(S4a,S8,或S4a+S8);Ⅲ型:肿瘤局限于中肝中区(S4a-S5-S4b交界区)较表浅(Ⅲa型)或位置较深邻近下腔静脉肝内段时(Ⅲb型);Ⅳ型:肿瘤较大累及第一二肝门之间的大部分中肝区域(S4,S5,S8)甚至直接侵犯其中主要管道。本组Ⅰ型4例,Ⅱ型3例,Ⅲa型7例,Ⅲb型3例,Ⅳ型7例。临床资料见表1。病例纳入标准:肿瘤位于肝脏中央区(4、5、8段)范围内,术前肝储备功能评估及三维可视化影像评估及肝体积测定肿瘤有可切除性(中肝部分或全部切除)且预留肝体积充足,重要脏器功能良好,能够耐受手术操作,肿瘤影像学评估无肝外转移,开腹或腹腔镜下的可切除性等。肝继发性肿瘤经术前多学科协作模式(MDT)讨论并确认手术指征。排除标准:肝功能Child-Pugh C级或终末期肝病模型(MELD)评分>15,残余肝脏体积不足,肝外转移。肾小球滤过率<55 ml/min,怀孕或哺乳期,甲状腺功能亢进,对碘剂或ICG过敏等不纳入ICG荧光引导手术。
二、方法
1.荧光染色方法 荧光操作系统采用加拿大Pinpoint Novadaq腹腔镜荧光成像系统。注射用ICG(25 ml/安瓿,带10 ml灭菌注射用水)由卫材(辽宁)制药有限公司生产。荧光染色根据染色目标分为肿瘤染色和目标肝段染色两种,后者有可分为正显影法和负显影法。肿瘤染色可于术前2~5 d内经外周静脉注射ICG(剂量0.5 mg/kg),大多数肿瘤在术中可发现不同程度的染色。此外,根据具体手术规划可于术中实施目标肝段显影(正显影或负显影),以实施解剖性肝段或肝叶切除。①术中目标肝段正显影法,即通过向目标肝段肝蒂门静脉注射ICG实现成像:通过术中解剖目标肝蒂后或直接在超声引导下穿刺所在门静脉,根据肝段体积大小缓慢注射ICG 1.25~2.5 mg,结扎或不结扎相应肝段或肝叶之肝动脉。②目标肝段负显影法:术中解剖目标肝段或肝叶的肝蒂并经鞘外阻断Glisson鞘后经外周静脉注射ICG 1.25~2.5 mg。由此,目标肝段以外的肝脏因ICG蓄积而呈绿荧光,而目标肝段无荧光,术中藉此荧光分界线引导肝实质离断。
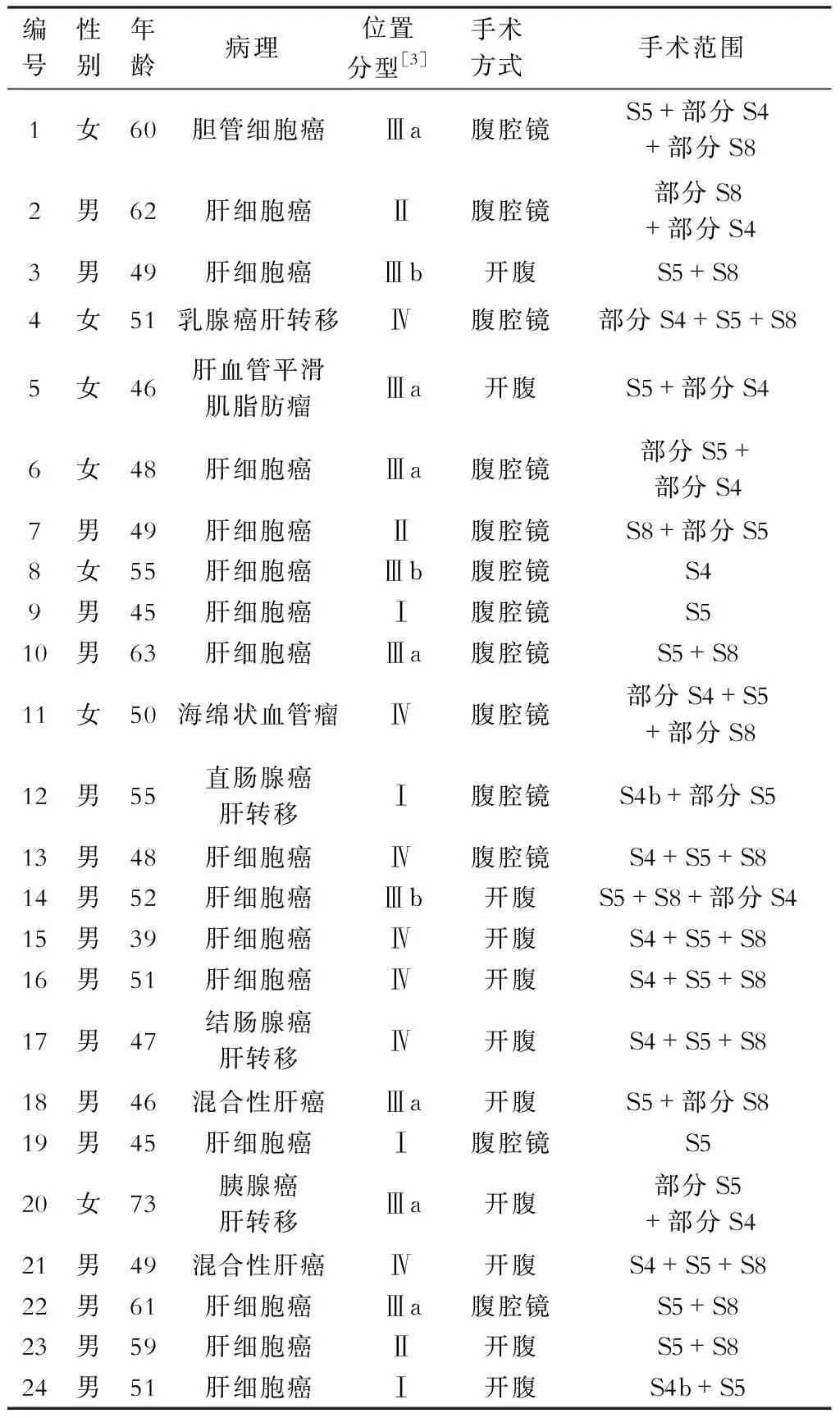
表1 24例行中肝切除手术病人的临床资料
2.手术方式 根据肿瘤性质及所在部位行个体化的手术方案,手术方式包括规则性肝段/叶切除或不规则肝切除。原则上保持肿瘤切缘至少1 cm,但紧邻预留肝脏的重要功能性管道时,则优先保留重要管道,同时达到阴性切缘即可。离断肝实质过程中采用Pringle法间断阻断肝门,手术结束后统计总的肝门阻断时间。
3.观察指标 包括ICG荧光染色效果,术中出血量,手术时间,并发症,术后肝功能恢复时间(术后第1、3、5天丙氨酸转氨酶和天冬氨酸转氨酶测定)及术后住院天数。术后并发症依照Clavien-Dindo分级系统[4]分级。
三、统计学分析

结 果
本组24例中央区肝肿瘤手术病人均实施术前三维可视化影像评估及术中超声辅助定位,全部成功实施中肝切除手术。行开腹中肝切除11例,ICG荧光显像引导下的腹腔镜中肝切除13例。无手术死亡病例。腹腔镜组手术时间长于开腹手术(P<0.05),住院时间要短于开腹组(P<0.05)。但入肝血流阻断时间及手术失血量,二者之间差异均无统计学意义(表2)。
表2 两组围手术期主要统计指标对比
术前2~5 d经外周静脉注射ICG的病人,术中发现肿瘤均有不同程度的显影,术中以荧光显影为引导完成规则或不规则肝中叶切除,如图1、图2。根据手术规划,拟行荧光引导的解剖性中肝切除者加做术中ICG注射,实施正显影3例,成功2例;术中负显影4例,成功2例;总体中肝显影成功率为57.1%。全部ICG荧光引导腹腔镜及开腹手术的病人均按计划完成手术,术后病检证实切缘均阴性。
腹腔镜肝中叶切除术后肝功能恢复更快。术后第1天腹腔镜组天冬氨酸转氨酶明显低于开腹组(P<0.05),术后第3天腹腔镜组丙氨酸转氨酶明显低于开腹组(P<0.05),见表3。
术后共发生Clavien-DindoⅢ级并发症3例(其中开腹手术和荧光腹腔镜手术术后胆漏各1例,开腹术后肝断面脓肿形成1例),所有并发症病人均经对症治疗后痊愈,无手术死亡病例。
讨 论
肝中叶解剖位置特殊,区域内肿瘤常常邻近或直接侵犯第一、二肝门及肝后下腔静脉等重要入肝及出肝管道。相对于半肝或扩大半肝切除而言,肝中叶切除有左右两个断肝平面以及更为复杂的第一、二肝门处理程序,需要更为精细地保护左右残肝域出入肝血流及胆管,手术时间长,出血风险大,术后胆漏及积液更易发生。Qiu等[3]对比292例中肝切除病人和138例扩大半肝切除病人的资料,发现中肝切除手术时间更长,术中输血更多,但术后高胆红素血症发生率更低、持续时间更短,并发症如腹水、胸腔积液、黄疸更少,因此认为肝中叶切除尤其适用于有肝硬化、肝功能储备相对较差、需要保留尽可能多肝组织的病人。Chen等[5]随访256例中央区肝肿瘤行肝中叶切除的病例,5年生存率达35.1%,与半肝或扩大半肝切除疗效相当。
关于肝脏肿瘤的切除方式,是否必须行解剖性切除,仍存争议[6-7]。理论上,解剖性肝切除术中切除了肿瘤及所在肝段,清除门静脉分支区域潜在的微病灶,较非解剖性肝切除在降低术后复发上应该更具有优势[8-9],但是多项重要的临床研究表明并非所有肝癌病人均可从解剖性肝切除获益。笔者认为,对规则性或者不规则性、解剖性或者非解剖性肝切除方式的选择,应根据肿瘤分型与分布、肝储备功能状态、病人全身状况等情况综合考虑,个体化寻找肿瘤学根治性与外科学安全性上的最佳平衡点,而不是一味地单方面强调根治性或安全性。Chen及Cucchetti等[10-11]报道的中央区肝肿瘤手术病人行解剖性肝中叶切除与不规则肝中叶切除病人5年生存率差异无统计学意义。分布于第二肝门(Ⅱ型)或紧邻第一肝门(Ⅳ型)的中央区肿瘤,特别是肿瘤紧贴重要的大血管主干时,强行“解剖性”切除或机械地坚持“大于1 cm切缘”,势必导致大血管支配区大范围预留肝组织额外损失,置病人于危险境地。在这种情况下,利用ICG肿瘤荧光引导及术中超声等技术,在切除肿瘤的同时,最大程度保留功能性肝组织,再结合腹腔镜肝切除的微创化,将能使病人最大获益。本组病人腹腔镜肝中叶切除手术的术中出血及术后并发症与开腹组并无明显区别,但术后肝功能恢复速度、术后住院时间等显著优于开腹中肝切除手术。这说明,合理选择病人,术前精确评估,合理规划手术,实施腹腔镜下中肝切除并不增加手术风险。

表3 腹腔镜组与开腹组术后肝功能恢复情况对比
术前ICG注射引导的肿瘤荧光显像,在肝切除手术中确保足够的切缘、降低切缘阳性率、获得更好肿瘤学效益等方面,已获广泛认可[12]。我们体会,术前ICG注射引导的肿瘤荧光显像对肿瘤深在的或紧邻第二肝门的中央区肝肿瘤手术,具有特别重要的价值。中央区深部肿瘤,即使结合术中超声,切肝过程中仍存在深部肝组织中肿瘤不易定位、容易误伤肿瘤的难题,若结合术中ICG荧光,则可实现实时定位肿瘤,避免切少(切破肿瘤或切缘不足)或切多(误切可保留或必须保留的重要管道)的危险;当肿瘤与第二肝门的重要管道关系紧密时,肿瘤荧光显像非常有利肿瘤边界识别,保障切缘,保护血管,提高手术的根治性和安全性。术中经目标肝段肝蒂的门静脉注射ICG,能够实现目标肝段的“正显影”,与相邻肝脏产生持久的荧光分界线。与之对应的是,阻断目标肝段肝蒂后经外周静脉注射ICG,可实现目标肝段以外肝脏的荧光显影,与目标肝段间产生荧光分界线,即所谓“负显影”[13-14]。术中通过荧光分界线引导,实现腹腔镜手术断肝过程的离断平面的全程化、立体化引导,结合术中超声及血流阻断,可实现接近真正意义上的“精准解剖性切除”。值得注意的是,由于肝脏血管的诸多解剖变异,目前术中ICG肝段显影成功率不高,本组中,计划实施术中正显影和负显影的7例病人中,仅4例获得成功。如何提高术中肝段显影的成功率,是下一步需要深入研究的问题。
(本文图1~图2见封二)
