苓甘五味姜辛汤对脂多糖诱导的急性肺损伤大鼠免疫细胞和炎性细胞因子的影响*
2019-02-26王宝娟崔利锋李冬霞张云虹杨伟锋马国安
王宝娟 崔利锋 李冬霞 张云虹 杨伟锋 马国安
(1.河北省衡水市第二人民医院,河北 衡水 053000;2.河北省衡水市哈励逊国际和平医院,河北 衡水 053000)
急性肺损伤(ALI)是由各种肺内外致病因素引起的以肺内大量炎症细胞浸润和渗出、肺泡上皮及毛细血管内皮屏障发生急性炎症损伤,肺泡、肺间质水肿等为主要特征的肺部炎性综合反映,临床上主要表现为急性进行性血氧过低的呼吸窘迫症、非心源性肺水肿等,最终导致呼吸衰竭,其临床病死率高达30%~50%[1-2],是呼吸系统的危急重症之一,严重威胁到人类的生命健康。细菌内毒素是临床上造成ALI的主要病因之一,其中又以革兰阴性细菌内毒素为主导,而其内毒素的主要活性成分为脂多糖(LPS)。气管内滴入LPS与呼吸道细菌感染的过程相似,LPS进入肺内后能够引起肺内炎症细胞增多、肺微血管通透性增高等病理改变[3],从而造成肺部的严重炎性反应及炎性损伤,进而影响肺部结构功能改变,最终导致ALI的发生[4]。
苓甘五味姜辛汤源于《金匮要略》,全方由茯苓、甘草、五味子、干姜、细辛组成。方中干姜为君,既能温肺散寒以化饮,又能温运脾阳以化湿;细辛温肺散寒,助干姜治其已聚之痰;茯苓健脾渗湿利水,既能杜其生痰之源,又能导水饮之邪从小便而去,二者共为臣药,从源流配合消除痰湿,以复肺之宣降之用;五味子敛肺气以平咳喘,与细辛配伍,一收一散,共奏敛不留邪、散不伤正之功,且能调节肺司开合之职;甘草调和诸药。全方共奏具有温肺化饮之功效,常用于寒饮内停之咳喘。目前临床多用于治疗咳嗽、慢性支气管炎、慢性阻塞性肺疾病、支气管哮喘等肺系疾病[5-8]。本研究拟观察苓甘五味姜辛汤对LPS致ALI大鼠动脉血T淋巴细胞亚群和支气管肺泡灌洗液 (BALF)中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)的影响,并探讨其对ALI的可能作用及其机制。现报告如下。
1 材料与方法
1.1 实验动物 选取健康清洁级的2月龄SD大鼠90 只,雌雄各半,体质量(200±20) g,由中国食品药品检定研究院提供,合格证号:SCXK(京)2012-0068。饲养条件:无特殊病原菌(SPF)级环境,恒温22~25℃,恒湿50%~65%。
1.2 试药与仪器 苓甘五味姜辛汤方药组成:茯苓12 g,甘草 9 g,五味子 5 g,干姜 9 g,细辛 5 g,桂枝 9 g。将药材加4倍量水煎煮60 min,纱布过滤后将滤液另器置放,滤渣再加入3倍量水煎煮30 min后过滤,2次煎煮液混合后水浴浓缩至原药材含量为0.8 g/mL,4℃放置备用,临用时用蒸馏水稀释。地塞米松注射液(批号130257,天津天药药业股份有限公司);LPS(批号20161019,Sigma公司,德国);FITC标记的抗大鼠CD3单克隆抗体、PE标记的抗大鼠CD4和CD8单克隆抗体(美国 Caltag公司);IL-1β、IL-6、IL-8 和 TNF-α 酶联免疫吸附测定试剂盒(法国Diaclone公司)。主要仪器设备:大鼠固定操作台 (PENN-CENTURY公司,美国);3K15 型低温高速离心机(Sigma公司,德国);CO2培养箱(Yamato公司,日本);光学显微镜(Olympus公司,日本);DYZ-22A型双恒定时电泳仪(北京市六一仪器厂);DYY-Ⅲ桥式电泳槽 (北京市六一仪器厂);BD-LSR型流式细胞仪 (Becton Dichinson公司,美国);2016型切片机(上海莱卡仪器有限公司)。
1.3 动物分组 90只大鼠实验前适应性喂养1周后,按随机数字表法分成6组,每组15只,分别为空白对照组、ALI模型组、地塞米松组和苓甘五味姜辛汤高、中、低剂量组(以下简称中药高、中、低剂量组)。
1.4 造模与给药 1)动物造模。采用LPS暴露式气管滴注方法制备大鼠ALI模型[10]:末次给药24 h后,除空白对照组外的5组大鼠用10%水合氯醛3.5 mL/kg腹腔麻醉后,仰卧位固定于手术板上,颈部消毒,纵向切开颈部皮肤,剥离皮下组织,暴露气管,用2 mL注射器从气管两气管环间快速刺入,在大鼠直立位下滴入脂多糖溶液10 mg/kg,轻度晃动数次以使液体能够均匀分布于肺内后缝合切口以制作ALI模型。大鼠自然清醒后自由活动,禁食,未禁水。2)干预方法。大鼠给药剂量按人与大鼠之间体表面积折算[9]等效剂量为4 g/kg,高剂量为2倍等效剂量,低剂量为1/2倍等效剂量,按上述给药量,用蒸馏水将苓甘五味姜辛汤煎煮液配置成中药高、中、低剂量浓度分别为0.8、0.4、0.2 g/mL。空白对照组和模型组给予等剂量的0.9%氯化钠注射液灌胃,地塞米松组取地塞米松注射液1.0 mg/kg腹腔注射,每日1次,连续用药27 d。
1.5 标本采集与检测 1)实验取材:10%水合氯醛腹腔注射麻醉大鼠,经舌静脉注入肝素抗凝,收集大鼠腹主动脉血保存待用;处死大鼠后将其仰卧位固定,使用无菌剪刀剪开大鼠颈部和胸部的皮肤组织,暴露胸腔,将大鼠右主支气管结扎后,用注射器在主气管上向肺部注入磷酸盐缓冲液2 mL进行左肺灌洗,重复3次后留取支气管肺泡灌洗液(BALF)备用。2)肺组织病理学检测及病理学评分:取大鼠右肺中叶组织,用10%甲醛溶液固定,常规石蜡包埋后切片(片厚5 μm),取切片进行苏木精-伊红(HE)染色;光镜下观察肺组织病理形态学改变,并进行病理学评分[11]。 3)肺湿/干质量比测定:取大鼠右肺下叶组织,先除去表面脂肪组织,再用滤纸吸干组织表面的液体后称量肺组织的湿质量;将肺组织置于70℃烘箱48 h至恒重后再次称量其干质量,并计算肺组织湿/干质量比(W/D)值,用来评估肺组织水肿程度。4)大鼠动脉血中CD3+、CD4+和CD8+的测定[12]:按照试剂盒说明书的步骤,采用流式细胞技术对大鼠腹主动脉血中T淋巴细胞亚群进行测定[1]。5)大鼠 BALF 中 IL-1β、IL-6、IL-8 和 TNF-α水平的测定[13]:按试剂盒说明书方法,采用ELISA法测定 IL-1β、IL-6、IL-8和 TNF-α 因子的浓度。
1.6 统计学处理 应用SPSS22.0统计软件。计量资料以(x±s)表示,组间比较用单因素方差分析,两组间比较用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肺组织病理形态改变及病理学评分见图1,表1。显微镜下观察见空白对照组大鼠肺组织形态、肺泡结构正常,肺泡壁薄,间隔无水肿,无明显炎症改变。ALI模型组大鼠肺组织结构出现破坏,部分肺泡塌陷,肺泡水肿明显,肺泡间隔明显增厚,肺泡壁有大量中性粒细胞浸润及渗出物,肺泡腔内炎症细胞浸润,肺间质弥漫性充血水肿。地塞米松组及中药高剂量、中剂量组的肺组织上述变化较模型组明显减轻,炎症细胞浸润数量减少,充血、水肿程度减轻,且肺组织结构明显改善。中药低剂量组肺组织结构改善不明显,肺泡腔内仍有大量炎症细胞浸润,肺间质部分充血水肿。病理学评分方面,ALI模型组评分明显高于空白对照组(P<0.05),经不同药物干预后,地塞米松组和中药高、中剂量组评分均明显降低(P<0.05),中药低剂量组评分降低不明显(P>0.05),中药各组与地塞米松组比较,差异无统计学意义(P>0.05)。

图1 各组大鼠肺组织病理形态改变(HE染色,200倍)
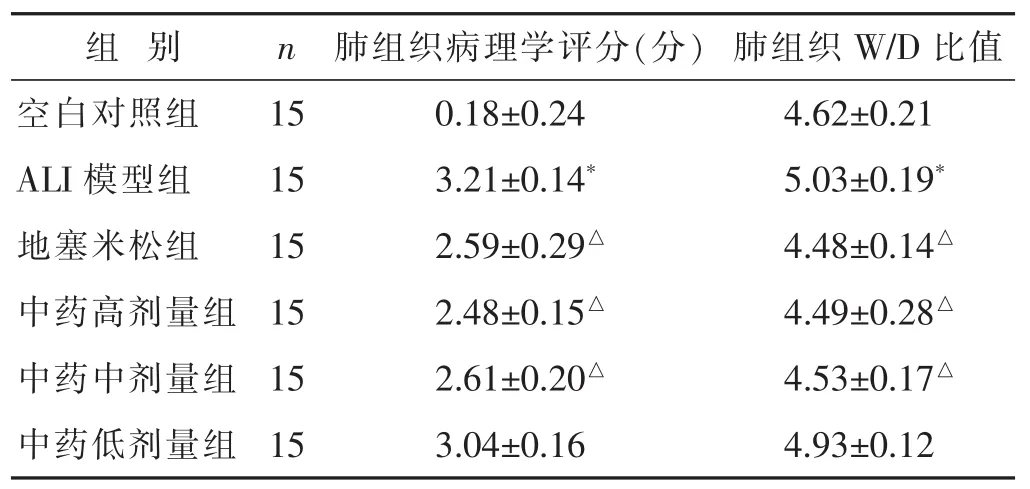
表1 各组大鼠病理学评分及W/D比值比较(x±s)
2.2 各组大鼠肺组织W/D比值情况比较 见表1。与空白对照组相比,ALI模型组肺组织水肿明显,W/D比值明显增加,差异存在统计学意义(P<0.05)。地塞米松组与中药高剂量组、中剂量组肺组织水肿现象较ALI模型组明显减轻,W/D比值降低,有显著差异(P<0.05)。中药低剂量组肺组织W/D比值较ALI模型组降低不明显(P>0.05)。
2.3 各组大鼠动脉血 CD3+、CD4+、CD8+和 CD4+/CD8+水平比较 见表2。ALI模型组动脉血中CD3+、CD4+、和CD4+/CD8+水平较空白对照组明显降低(P<0.05),CD8+水平明显升高(P<0.05)。 与 ALI模型组比较,中药高剂量组、中剂量组动脉血中CD3+、CD4+和CD4+/CD8+水平明显升高(P<0.05),CD8+水平明显降低(P<0.05);地塞米松组和中药低剂量组与ALI模型组相比各项指标变化不明显(P>0.05)。
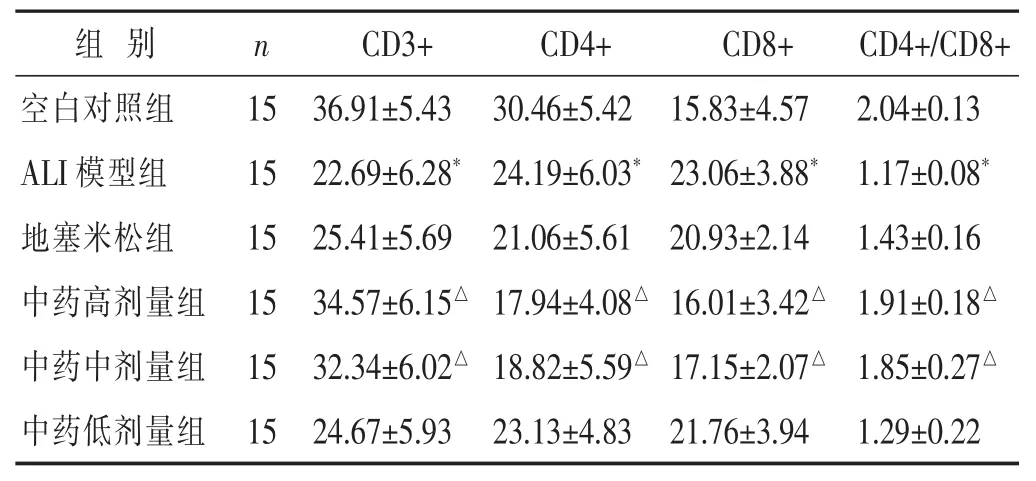
表2 各组大鼠CD3+、CD4+、CD8+和CD4+/CD8+水平比较(%,x±s)
2.4 各组大鼠 BALF中 IL-1β、IL-6、IL-8和 TNF-α水平比较 见表3。LPS造模后大鼠BALF中IL-1β、IL-6、IL-8和TNF-α水平均升高,与空白对照组比较差异显著(P<0.05);经高、中剂量的中药处理可显著降低各项指标的水平,与地塞米松组效果相当,与ALI模型组比较差异有统计学意义(P<0.05)。
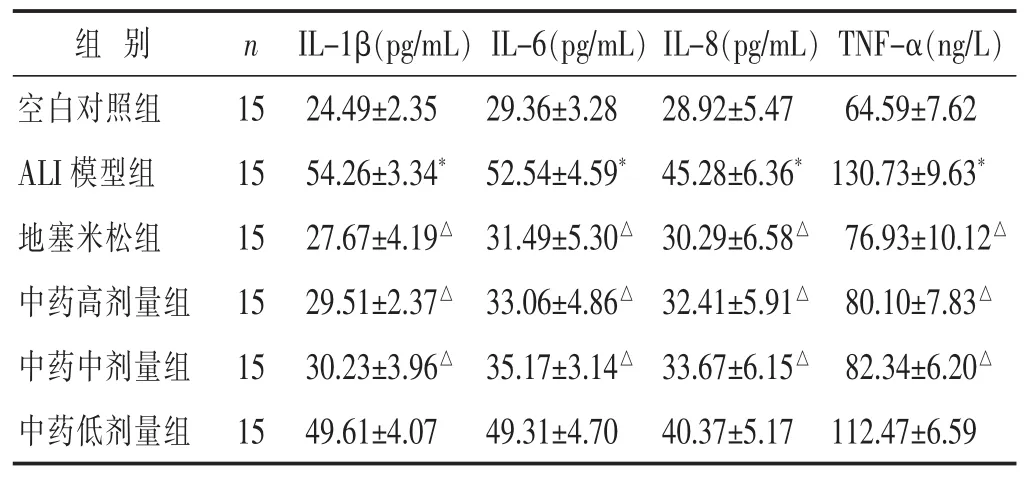
表3 各组大鼠 IL-1β、IL-6、IL-8 和 TNF-α 水平比较(x±s)
3 讨 论
近年来,采用气管内滴入LPS的方式制作ALI动物模型的方法已经广泛运用于ALI发病机理和药物防治的研究[14]。因为LPS不仅能损伤肺脏,还能激活多种炎症细胞,使其释放大量炎症介质或细胞因子,进而导致肺组织损伤[15]。本研究中大鼠气管内滴注LPS后,出现大鼠肺组织结构破坏、肺泡炎症细胞浸润等典型的ALI病理改变,提示本研究成功建立了ALI的动物模型。同时ALI模型大鼠肺组织病理学评分以及W/D比值升高,表明LPS气管内滴药能引起明显的大鼠肺组织损伤。而苓甘五味姜辛汤干预后能明显减轻损伤,降低肺组织病理学评分和W/D比值,提示苓甘五味姜辛汤对ALI大鼠的肺脏有明显的保护作用。
T淋巴细胞亚群是细胞免疫的主要组成部分,其中,CD3+是鉴定 T 细胞的重要标记[16];CD4+能诱导和辅助细胞毒T细胞前身成为细胞毒T细胞,辅助其他免疫细胞功能的发挥,其数量的减少代表机体免疫功能的降低[17];CD8+主要分布在抑制性和杀伤性T淋巴细胞表面,通过自身和抑制因子在免疫反应中起负向调节作用,若其细胞数量过多反而会对机体造成损伤;CD4+/CD8+则能反映机体免疫功能是否紊乱,并且其下降程度与疾病的严重程度、预后均密切相关[18]。本研究结果显示,ALI大鼠动脉血中CD3+、CD4+和CD4+/CD8+值降低,CD8+升高,提示LPS造模后能引起T淋巴细胞亚群的表达异常,从而导致ALI和免疫抑制。而经高、中剂量苓甘五味姜辛汤干预后,以上指标均有所恢复,表明苓甘五味姜辛汤能提高机体免疫力,纠正机体细胞免疫抑制状态。
ALI的主要特点是炎症介质大量合成和释放,IL-1β,IL-6、IL-8以及TNF-α等促炎介质的水平,可反映肺组织炎症反应的强度[19]。IL-1β是急性炎症反应的主要调节物质,并且能够诱导产生IL-6和IL-8等[20]。IL-6是强有力的促炎因子,主要参与肺损伤时肺内炎症的过度反应,其不仅能对组织直接造成伤害,还能增强组织细胞对TNF-α的敏感性[21]。IL-8是中性粒细胞最有效和最主要的趋化因子,能促使中性粒细胞活化和迁移,释放出大量的损伤介质引起肺损伤[22]。TNF-α是ALI最重要的启动因子,能趋化炎症细胞在肺内聚集、黏附,从而损伤肺血管内皮细胞[23]。TNF-α还能使炎症细胞释放IL-1β、IL-6和IL-8等二级炎症因子,加重肺组织炎症损伤[24]。本实验结果表明,LPS造模后大鼠 BALF 中 IL-1β、IL-6、IL-8、TNF-α 水平显著升高,其原因可能是因为ALI后导致肺泡毛细血管屏障下降,白细胞向肺泡内迁移,被激活的细胞进而产生 IL-1β、IL-6、IL-8等多种炎性递质以及 TNF-α等前炎性递质;而经苓甘五味姜辛汤干预后可显著降低其水平,表明苓甘五味姜辛汤可以抑制IL-1β、IL-6、IL-8以及TNF-α等炎性因子的合成和释放,从而减轻肺组织的炎性损伤程度。
综上所述,苓甘五味姜辛汤能减轻肺损伤,改善肺水肿,提高机体免疫力,纠正机体细胞免疫抑制状态,抑制 IL-1β、IL-6、IL-8、TNF-α 的合成和释放,为临床救治ALI提供了新思路。
