影响金黄色葡萄球菌杀白细胞素ED转录表达的培养条件
2019-02-25杨涵黄凯峰徐溯赵焕强徐晓刚胡付品何春燕龚芳刘庆中
杨涵,黄凯峰,徐溯,赵焕强,徐晓刚,胡付品,何春燕,龚芳,刘庆中
1. 上海交通大学附属第一人民医院检验医学中心,上海 200080; 2. 复旦大学附属华山医院抗生素研究所,上海 200040; 3. 南通大学附属南通第三医院检验科,江苏 南通 226000
金黄色葡萄球菌是医院和社区感染的重要病原体之一,可引起坏死性肺炎、中毒性休克综合征、化脓性感染等疾病,这与其分泌的多种毒素因子密切相关[1-3],其中双组分成孔杀白细胞素(leukocidin)发挥着重要作用。金黄色葡萄球菌能分泌6种双组分杀白细胞素:Panton-Valentine杀白细胞素(Panton-Valentine leukocidin,PVL;也称LukSF-PV)、杀白细胞素ED(leukocidin ED,LukED)、γ溶血素(包括HlgAB和HlgCB)、杀白细胞素AB(leukocidin AB,LukAB;也称 LukGH)及杀白细胞素MF′(leukocidin MF′,LukMF′)[2,4-5]。这些毒素均由两个独立的水溶性亚基S和F组成。细菌感染过程中,S亚基首先识别宿主细胞膜,随后募集F亚基形成横跨细胞膜的β桶状孔,从而引起宿主细胞膜破裂, 导致细胞死亡[6-8]。
一直以来,PVL是金黄色葡萄球菌毒力的研究热点[9]。近几年来,LukED在金黄色葡萄球菌致病机制中的重要作用得到越来越多实验的证实。研究表明,LukED可与巨噬细胞、T细胞和树突细胞表面的趋化因子受体CCR5,中性粒细胞、单核细胞和自然杀伤细胞表面的CXCR1/2受体及红细胞表面的DARC受体结合,引起相应靶细胞裂解,促进感染发生[10-13]。LukED皮内注射兔子可引起明显的局部炎症和皮肤坏死反应,毒性程度与PVL引起的皮肤坏死相当[14]。小鼠血流感染模型中,金黄色葡萄球菌lukED缺失突变株(ΔlukED)感染小鼠的生存率明显高于野生型菌株,其肝、肾等器官中细菌复制能力降低,白细胞介素6(interleukin 6,IL-6)和粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)减少[15]。流行病学资料显示,LukED与金黄色葡萄球菌所致脓疱病、抗生素相关性腹泻密切相关,且在临床金黄色葡萄球菌中呈现较高的流行率[4-5,16]。
LukED表达受培养基、生长阶段等多种因素的影响。Gravet等[14]研究显示,LukED在脑浸液培养基中检测不到,而在酵母提取物-酪蛋白氨基酸-丙酮酸钠(yeast extract-casamino acids-sodium pyruvate,YCP)培养基中可检测到。Bronner等[17]采用半定量反转录-聚合酶链反应(semi-quantitative reverse transcription-polymerase chain reaction,SqRT-PCR)检测YCP及其他培养基中各毒素表达情况,但准确率欠佳,且缺乏深入研究。因此,本实验拟研究5种常用培养基及细菌生长阶段对lukED转录的影响,探讨培养基组分对lukED转录的影响,为后续LukED研究获得足量毒素奠定基础。
1 材料与方法
1.1 材料
1.1.1实验菌株金黄色葡萄球菌Newman菌株由复旦大学附属华山医院抗生素研究所保存及惠赠。
1.1.2培养基脑心浸液肉汤(brain heart infusion broth,BHI)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、溶菌肉汤(lysogeny broth, LB)及Mueller-Hinton肉汤(Mueller-Hinton broth,MHB)购自英国Oxoid 公司。YCP [30 g/L酵母提取物、20 g/L酪蛋白氨基酸、20 g/L丙酮酸钠、2.5 g/L Na2HPO4、0.42 g/L KH2PO4,pH 7.0]为本实验室自行配制,其中酵母提取物购自Oxoid 公司,酪蛋白氨基酸购自美国Amreso公司,丙酮酸钠、Na2HPO4和KH2PO4购自生工生物工程(上海)股份有限公司。向LB培养基(10 g/L胰蛋白胨、5 g/L酵母提取物、10 g/L氯化钠)中分别加入YCP培养基各成分(终浓度与YCP一致),配制新的培养基并分别命名为LBY(LB+25 g/L酵母提取物)、LBC(LB+20 g/L酪蛋白氨基酸+2.5 g/L Na2HPO4+0.42 g/L KH2PO4;实验过程中发现,只向LB中添加酪蛋白氨基酸难以溶解,因此将无机盐一并加入助其溶解)、LBP(LB+20 g/L丙酮酸钠)。
1.1.3主要试剂及仪器荧光定量 PCR仪及 NanoDrop2000 超微量分光光度计为赛默飞世尔科技有限公司产品,PCR 8连管及 96 孔板为Axygen 公司产品,紫外分光光度计为尤尼柯公司产品,蛋白酶K、RNA 抽提试剂盒MiniBEST Universal RNA Extraction Kit、反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser及荧光定量试剂盒TB Green Premix Ex Taq(Tli RNaseH Plus)购自宝生物工程(大连)有限公司,引物合成及溶葡萄球菌酶由生工生物工程(上海)股份有限公司提供,金黄色葡萄球菌裂解液由本实验室自行配制(专利号ZL201310124795.2)。
1.2 方法
1.2.1生长曲线测定挑取新鲜Newman菌株的单个菌落至3 mL TSB中,37 ℃,150 r/min培养过夜。随后吸取300 μL菌液至30 mL新鲜培养基中(1∶100稀释),37 ℃,150 r/min培养,每隔1 h取样测定OD600值,监测细菌生长情况。
1.2.2qRT-PCR检测lukE基因表达收集TSB、BHI、YCP、MHB和LB五种培养基中对数生长早期(TSB、BHI、YCP和MHB为3 h,LB为5 h)、中期(TSB、BHI和YCP为4 h,MHB为5 h,LB为7 h)、晚期(TSB、BHI和YCP为5 h,MHB为7 h,LB为9 h)及平台期(TSB、BHI和YCP为7 h,MHB为9 h,LB为11 h)菌液,4 ℃,12 000 r/min离心10 min,弃上清液,用含100 μL裂解液、10 μL蛋白酶K和10 μL溶葡萄球菌酶的溶液重悬菌体,56 ℃裂解1 h。用MiniBEST Universal RNA Extraction Kit提取细菌RNA,去除基因组DNA后,反转录为cDNA。以16S rRNA为内参基因,qRT-PCR测定lukE基因mRNA表达(TB Green Premix Ex Taq)(LukED由共转录于一条mRNA的lukE和lukD两个基因编码,因此检测lukE基因可反映lukED的表达)。引物序列见表1[18-19]。
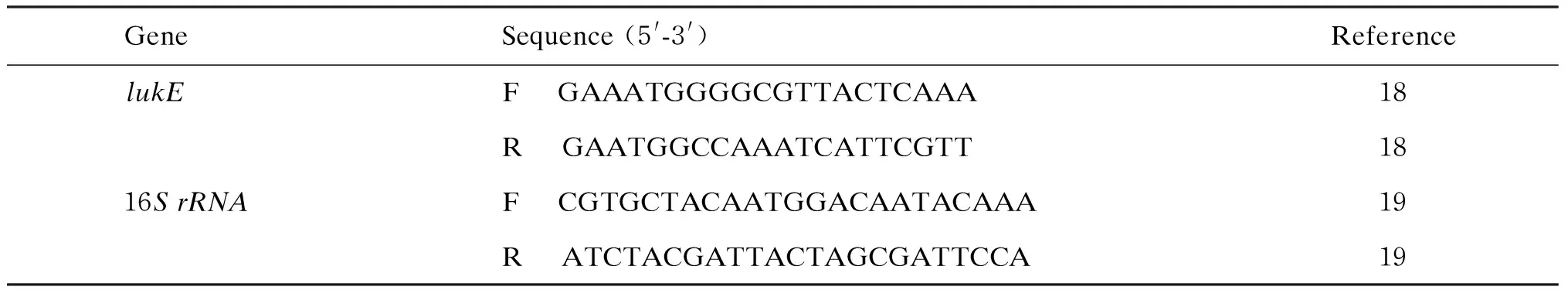
表1 qRT-PCR引物序列
为研究YCP培养基成分对lukE基因表达的影响,分别检测Newman菌株于LBY、LBC和LBP培养基5 h培养物中lukEmRNA,以LB和YCP培养基同一时间的培养物为对照。
1.3 统计学分析
用SAS软件进行统计学分析,两样本比较采用t检验,两个以上样本的比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 生长曲线
Newman菌株在TSB、BHI、YCP、MHB和LB培养基中的生长曲线(图1A)显示,其在BHI、TSB和YCP培养基中生长速度较快,2~3 h后进入对数生长期,7~9 h后进入平台期;在MHB和LB培养基中生长较慢,3~4 h后进入对数生长期,12 h后进入平台期。
Newman菌株在LB、LBY、LBC及LBP培养基中的生长曲线(图1B)显示,添加酪蛋白氨基酸的LBC培养基中细菌生长速度最快,6~8 h进入平台期;添加酵母浸出物(LBY)或丙酮酸钠(LBP)的培养基中细菌生长较LB稍好。
2.2 生长阶段对lukE表达的影响
根据图1A中的生长曲线,挑选TSB、BHI、YCP、MHB、LB培养基中对数生长早期、中期、晚期及平台期细菌进行研究。在TSB、BHI和YCP培养基中,从对数生长早期到晚期,lukE基因表达显著增加,并在对数生长晚期达到最高水平(图2A、2B、2C)。相对于对数生长早期,对数中、晚期变化倍数分别为TSB:4.48 和 7.82;BHI:4.90 和 6.90;YCP:3.97 和 7.71(P<0.05)。随后进入平台期,lukE基因转录水平显著下降,与对数生长早期水平相当(P>0.05)。在MHB培养基中,对数生长早、中、晚期lukE基因表达无显著差异,而平台期显著增加(为对数早期的 3.85 倍)(P<0.05)(图2D)。在LB培养基中,lukE基因表达在整个生长周期中虽有增加趋势,但差异没有统计学意义(P>0.05)(图2E)。
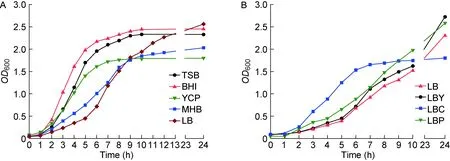
图1 金黄色葡萄球菌Newman菌株在不同培养基中的生长曲线
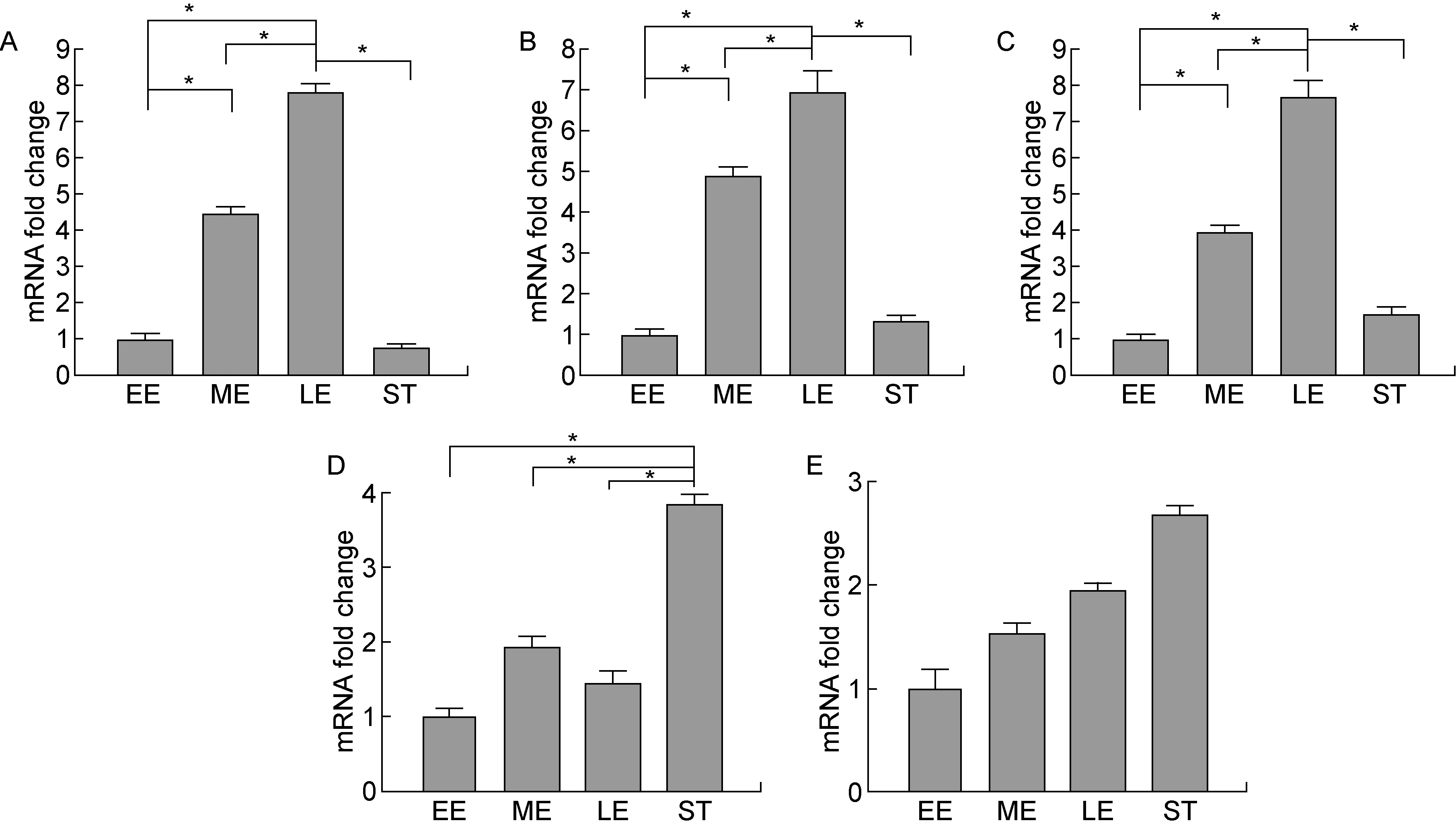
The data are presented as mean±SD (3 independent experiments). Statistical analyses were performed with t-test and one-way analysis of variance followed by Bonferroni posttest. *P<0.05. A: Tryptic soy broth (TSB). B: Brain heart infusion broth (BHI). C: Yeast extract-casamino acids-pyruvate (YCP). D: Mueller Hinton broth (MHB). E: Lysogeny broth (LB). EE, early-exponential phase; ME, middle-exponential phase; LE, late-exponential phase; ST, stationary phase.
2.3 培养基对lukE表达的影响
表2比较了各培养基中lukE表达的差异。可看出,YCP培养基中lukEmRNA水平在各生长时期均显著高于TSB和BHI培养基中对应时期:在对数生长早期,YCP培养基中lukE表达量是TSB的 4.73 倍,是BHI的 3.85 倍;在对数生长中期,YCP培养基中lukE表达量是TSB的 4.19 倍,是BHI的 3.11 倍;在对数生长晚期,YCP培养基中lukE表达量是TSB的 4.66 倍,是BHI的 4.28 倍;在平台期,YCP培养基中lukE表达量是TSB的 10.03 倍,是BHI的 4.80 倍(P<0.05)。比较TSB与BHI培养基,发现对数中期和平台期中lukE表达水平在BHI培养基高于TSB培养基(P<0.05),对数早期和对数晚期无显著差异(P>0.05)。LB培养基中lukE基因表达水平较低:lukE在LB培养基中的表达量在对数生长早期是TSB的 0.50 倍(P>0.05),在对数生长中期是TSB的 0.17 倍(P<0.05),在对数生长晚期是TSB的 0.13 倍(P<0.05),而在平台期是TSB的 1.68 倍(P<0.05)。MHB培养基中lukE表达最低:lukE在MHB培养基中的表达量在对数生长早期是TSB的 0.25 倍(P<0.05),在对数生长中期是TSB的 0.11 倍(P<0.05),在对数生长晚期是TSB的 0.05 倍(P<0.05),而在平台期与TSB无显著差异(P>0.05)。
上述结果表明,YCP培养基最适合lukE表达。本研究进一步探讨了YCP培养基中何种成分促进lukE基因表达水平。图3显示,LBY、LBC、LBP培养基中lukE表达水平分别是LB的 4.98、6.46 和 3.15 倍 (P<0.05),表明加入LB培养基中的酵母浸出物、酪蛋白氨基酸和丙酮酸钠均可促进lukE基因表达。统计学分析显示,LBY与LBC培养基之间lukE表达无显著差异(P>0.05),但均显著高于LBP培养基(P<0.05)。
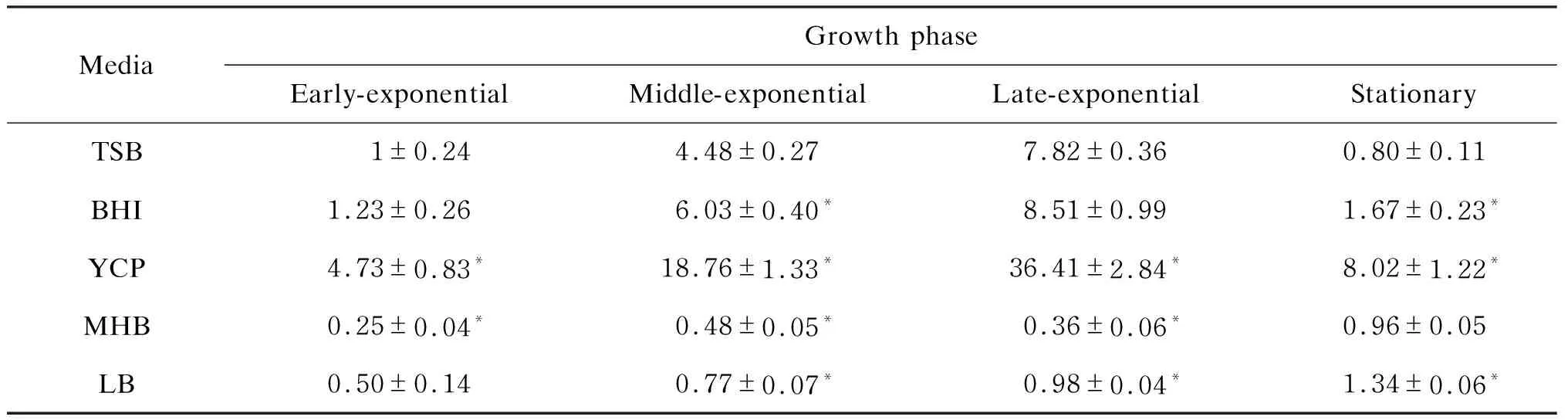
表2 Newman菌株lukE基因在各培养基不同生长阶段中的相对表达量
The data are presented as mean±SD (3 independent experiments). Statistical analyses were performed witht-test and one-way analysis of variance followed by Bonferroni posttest.*P<0.05 compared with TSB medium in the same growth phase.
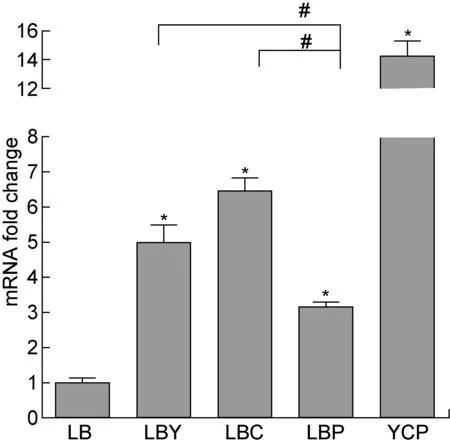
The data are presented as mean±SD (3 independent experiments). Statistical analyses were performed with t-test and one-way analysis of variance followed by Bonferroni posttest. *P<0.05 compared with LB group, #P<0.05 compared with LBP group.
3 讨论
金黄色葡萄球菌LukED毒素于1998年由Gravet等发现[14],随后发现其在金黄色葡萄球菌致病机制中发挥重要作用[4-5,20],并可能成为金黄色葡萄球菌感染抗毒素治疗的潜在新靶点。因此,如何在体外获得大量LukED,对其研究非常必要。
本研究显示,在细菌不同生长阶段lukE基因的表达有较大差异,推测可能与细菌群体感应系统有关。金黄色葡萄球菌具有多种调控系统,包括双组分信号调节系统(如Agr)和转录因子(如Rot)等。Agr系统通过群体感应机制进行调控[21],细胞生长起始时密度低,细菌产生的自诱导肽(autoinducing peptide,AIP)浓度也低,Agr系统低表达。细胞生长至一定密度时,AIP达到阈值浓度,Agr系统表达增加,效应分子RNAⅢ表达增加,促进毒素表达。研究表明,Agr通路能有效调节LukED毒素的产生[15]。Alonzo等[15]分别用金黄色葡萄球菌Newman野生株、agr敲除株(Δagr)感染小鼠,发现Δagr菌株LukED表达量大大降低,毒力明显减弱,小鼠耐受而不发生感染。因此推测,细菌生长阶段对lukE表达的影响可能部分是通过群体感应系统实现的。Newman菌株在对数生长早期时Agr系统低表达,lukE表达也保持在低水平;至对数中、晚期,细菌产生的AIP增多,Agr系统表达增加,lukE表达增加;而在平台期lukE表达骤减,可能与核糖核酸酶水平升高、细菌营养不足及mRNA不稳定等因素相关[22]。
本研究结果显示,培养基组成对Newman菌株lukE的表达有重要影响。在TSB、BHI、YCP、MHB和LB五种培养基中,YCP最有利于lukE表达,TSB和BHI中lukE表达尚可,而MHB和LB中lukE表达非常低。YCP培养基主要由酵母浸出物、酪蛋白氨基酸和丙酮酸钠构成。酵母浸出物是一种以面包酵母、啤酒酵母或葡萄酒酵母为原料,通过自溶、酶解等工艺制成的富含蛋白质、多肽、氨基酸、维生素及微量元素的产品,是微生物培养的优质氮源[23]。提高酵母浸出物的浓度能增加细菌营养,促进细菌生长,从而促进毒力基因表达。这可能是LB培养基中虽然含有酵母提取物,但浓度较低,致使lukE表达较低的原因。酪蛋白氨基酸富含氨基酸,常用于配制培养基,用于金黄色葡萄球菌培养。丙酮酸钠是重要的中间代谢物,具有抗氧化性,在异养细菌培养中可替代葡萄糖作为碳源[24]。研究表明,丙酮酸钠可有效消除过氧化氢对细菌的损伤作用[25],添加了 0.3% 丙酮酸钠的TSB培养基可使非可培养状态(viable but non-culturable,VBNC)的金黄色葡萄球菌恢复生长[26]。本研究显示,向LB中分别添加酵母浸出物、酪蛋白氨基酸和丙酮酸钠均能促进lukE基因表达,但前两者的促进效果明显强于后者。
类似地,CCY培养基一直被认为是产生PVL的最佳培养基[27],其组分包括30 g/L酵母浸出物、20 g/L酪蛋白氨基酸、23 g/L丙酮酸钠、6.3 g/L Na2HPO4、0.41 g/L KH2PO4,pH 6.7[27]。比较CCY与YCP配方,发现两者很相似,只有丙酮酸钠及Na2HPO4的含量有区别,KH2PO4的含量轻微不同。推测营养丰富的培养基更有利于杀白细胞毒素的表达。
总之,本研究表明对数生长后期是lukED表达的最佳时期,相较于TSB、BHI、LB和MHB培养基,YCP培养基最适合lukEDmRNA表达,其中酵母浸出物和酪蛋白氨基酸是促进lukEDmRNA表达的主要成分。
