小檗碱/IGF-I对猪体外受精胚胎发育作用初探
2019-02-22王俊丽戴佳格黄小萌高建明
刘 兵,王俊丽,张 超,戴佳格,黄小萌,高建明*
(1.北京农学院动物科学技术学院,北京 102206;2.中国农业大学动物科学院,北京 100193)
胚胎体外生产(Invitroproduction,IVP)不仅可以大幅提高良种资源利用效率,加快优良家畜品种的选育扩繁及优秀基因的保存,而且还是人类辅助生殖技术的重要手段。在体外培养条件下,哺乳动物早期胚胎往往不能完成从受精卵到囊胚的发育全过程,而停顿在某个特定发育时期,这一现象为胚胎体外发育阻断(Invitroblock of development)。体外培养(Invitroculture,IVC)是胚胎体外生产的关键技术环节,对动物良种繁育、生殖与发育机理研究具有重要意义。当前,猪的胚胎在IVC后发育效率和质量均不理想,主要与猪IVC培养基不理想有关[1]。Ye[2]等通过在猪卵母细胞体外成熟体系中添加成纤维细胞生长因子II (Fibroblast growth factorII,FGF-II)、白血病抑制因子(Leukemia inhibitory factor,LIF)和胰岛素样生长因子I (Insulin-like growth factor I,IGF-I),大幅提高猪卵母细胞体外成熟率、体外囊胚发育率和胚胎移植后的仔猪出生率。而Do L等研究发现在猪体外培养系统中添加1.0%丝胶、25 ng/mL褪黑素或0.5 ng/mL虾青素,有利于提高卵母细胞受精效果和囊胚发育[3]。IGF属于胰岛素家族的一类多肽,包括IGF-I和IGF-II。IGF-I是由胚胎自身分泌产生的,且IGF-I的分泌不仅从卵母细胞一直贯穿于附植前胚胎发育的全部时期[4],而其在附植后子宫内膜、滋养层细胞中的表达不断加强[5]。IGF-I从血清中发现,与胰岛素原具有高度的同源性,在多种细胞的增殖和分化过程中发挥重要的调控作用[6]。Yu[7]等人在鸡胚中添加一定浓度的IGF-I,发现鸡胚中IGF-1可通过PI3K/AKT通路促进成肌细胞增殖过程。而在哺乳动物中,有研究发现在牛体细胞克隆胚胎和山羊早期胚胎培养液中添加IGF-I可以提高胚胎的发育能力[8]。在猪上,发现其在体外受精和体细胞核的移植前胚胎中有着很好的抗凋亡作用[9]。Lucas[10]等在一种新的培养基中加入IGF-I,发现其能显著提高囊胚率。IGF-I对猪体外受精胚胎发育影响及机制尚不十分明确。小檗碱(Berberine,Ber)是从黄连属植物中提取的一种异喹啉生物碱化合物[11]。在医学上,Ber长期以来被用作治疗腹泻,但越来越多的证据表明,其有很广的生物学效应,包括抗菌[12]、降糖降脂[13]、促进细胞分化[14]、抗肿瘤[15]等作用。本实验室前期研究发现,中药单体成分Ber能够提高猪卵母细胞体外成熟效果[16,17],改善小鼠胚胎体外培养环境中的NO水平,减少自由基对胚胎的损伤[18,19]。本试验通过向培养液中添加一定浓度的IGF-I和Ber,观察体外受精胚胎发育率并检测IGF-I、IGF-IR(Insulin-like growth factor I recepter,胰岛素样生长因子I受体)的转录水平,初步探讨二者对猪体外受精胚胎发育的作用。
1 材料与方法
1.1 猪卵母细胞的获得和体外成熟
从屠宰场采集新鲜的猪卵巢,置入37℃含双抗的生理盐水中,1 h内运回实验室。采用吸取法获取卵巢上3~6 mm卵泡中卵丘-卵母细胞复合体(Cumulus-Oocyte complexes,COCs),TL-HEPES-PVA液洗涤3遍,体视显微镜下挑选卵丘细胞2层以上、致密、胞质均匀的COCs,进行卵母细胞体外成熟,按文献[16]方法进行。
1.2 猪卵母细胞的体外受精
从北京近郊种猪场获取新鲜长白猪精液,控温18℃左右1 h内运回实验室。将鲜精37℃水浴30 min后,1 000 r/min离心5 min,浓缩后的精液移入获能液中,置于39℃、5% CO2培养箱中获能30 min。将成熟的卵母细胞用0.1%的透明质酸酶液脱除包裹在其周围的卵丘细胞,选择卵周隙明显、卵细胞膜完整、且排出第一极体的卵母细胞置入50 μL的mTBM受精液滴中培养30 min。将获能后的精子加入到已放入成熟卵母细胞的mTBM受精液滴中,精子最终为1.5×106个/mL,受精6 h。
1.3 猪体外受精胚胎的体外培养
以添加0.4% BSA的NCSU-23胚胎培养液为基础液,在基础液中通过添加不同质量浓度(50、100、150 ng/mL)的IGF-I(Sigma),筛选出最佳质量浓度;以添加Ber(0.1 μg/mL,Ber组)、最佳质量浓度的IGF-I(IGF-I组,100 ng/mL)和同时添加二者(Ber+IGF-I组)为三个试验组。将各组体外受精卵分别用其培养液清洗3遍后移入在CO2培养箱中平衡4 h的培养液的50 μL液滴中,每滴15~20枚,进行体外培养。每间隔24 h或48 h观察其2-细胞、4-细胞、8-细胞、桑椹胚、囊胚发育率。间隔48 h换液。
1.4 RT-PCR检测胚胎IGF-I、IGF-IR基因表达量
分别收集各组4-细胞、8-细胞、桑椹胚三个时期的早期胚胎各100枚于1.5 mL离心管中,按照RNA提取试剂盒说明提取总RNA,按照PCR试剂盒操作说明进行反转录和Real-time PCR。取12 μL RNA样本,依次加入5×Buffer 4 μL,10×Reverse Transcriptase Mix 2 μL,制备20 μL反转录反应体系,混合均匀,37℃孵育60 min,95℃ 5 min,反转录产物于-20℃保存。反应在STRATA GENE荧光实时定量分析系统中按照miScript PCR Starter Kit试剂盒操作说明进行,GAPDH为内参基因。PCR反应条件为:95℃预变性15 min;94℃变性15 s,55℃退火30 s,70℃延伸30 s,共40个循环。采用2-△△CT法进行基因的相对定量。试验重复3次。
1.5 统计分析
应用SPSS 17.0统计软件的单向方差分析和SNK多重比较法对数据进行分析和差异显著性比较。结果以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示无显著差异。
2 结 果
2.1 不同质量浓度IGF-I对猪体外受精胚胎发育的影响
由表1可见,IGF-I 50、100、150 ng/mL组的囊胚率极显著高于对照组(P<0.01,IGF-I 0 ng/mL);100、150 ng/mL组的2-细胞率、4-细胞率、8-细胞率、桑椹胚率、囊胚率均极显著高于50 ng/mL组(P<0.01),但二者之间各时期发育率均无显著差异(P>0.05)。说明,IGF-I可显著提高猪体外受精胚胎体外发育率,且以100 ng/mL效果最佳。
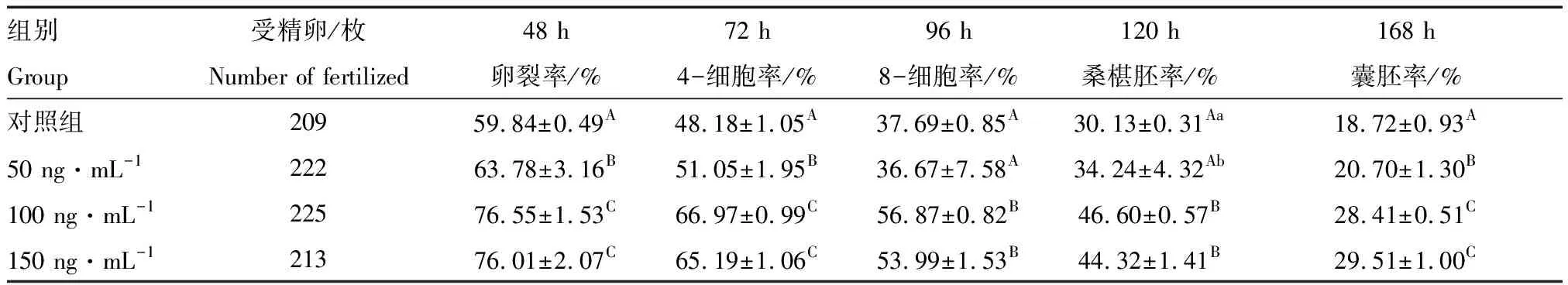
表1 不同质量浓度IGF-I对猪体外受精胚胎发育的影响Tab.1 Effects of different concentrations of IGF-I on in vitro development of porcine IVF embryos
注: 同列中不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
Note:In the same column, the difference is highly significant in different capital letters(P<0.01), and different lowercase letters indicate significant difference (P<0.05), The same letter indicates that the difference is not significant(P>0.05).
2.2 Ber/IGF-I对猪体外受精胚胎体外发育的影响
由表2可见,Ber组、IGF-I组、Ber+IGF-I组的2-细胞率、4-细胞率、8-细胞率、桑椹胚率、囊胚率均极显著高于对照组(P<0.01),而Ber、IGF-I、Ber+IGF-I三组之间各时期胚胎发育率均无显著差异(P>0.05)。说明,单独或同时添加Ber、IGF-I可显著提高猪体外受精胚胎体外发育率,三者之间无显著差异。
2.3 Ber/IGF-I对猪体外受精胚胎IGF-I、IGF-IR转录水平的影响
由图2可见,在IGF-I和IGF-IR基因转录水平上,4-细胞、8-细胞、桑椹胚三个时期的Ber组、IGF-I组、Ber+IGF-I组均极显著高于对照组(P<0.01);8-细胞、桑椹胚时期各组均极显著高于4-细胞时期对应各组(P<0.01);8-细胞与桑椹胚比,对应各组无显著差异(P>0.05)。在IGF-IR基因转录水平表达量上,8-细胞IGF-I组、桑椹胚Ber组显著高于4-细胞Ber+IGF-I组(P<0.05),8-细胞与桑椹胚对应各组无显著差异(P>0.05)。可见,单独或同时添加Ber、IGF-I可显著提高IGF-I、IGF-IR基因的转录水平,但三者之间无显著差异。

1.2-细胞;2.4-细胞;3.8-细胞 4.桑椹胚;5.囊胚1.2-cell; 2.4- cell; 3.8-cell; 4.Morula; 5.Blastocyst图1 猪体外受精胚胎各时期发育图片Fig.1 Development of porcine IVF embryos at different stages
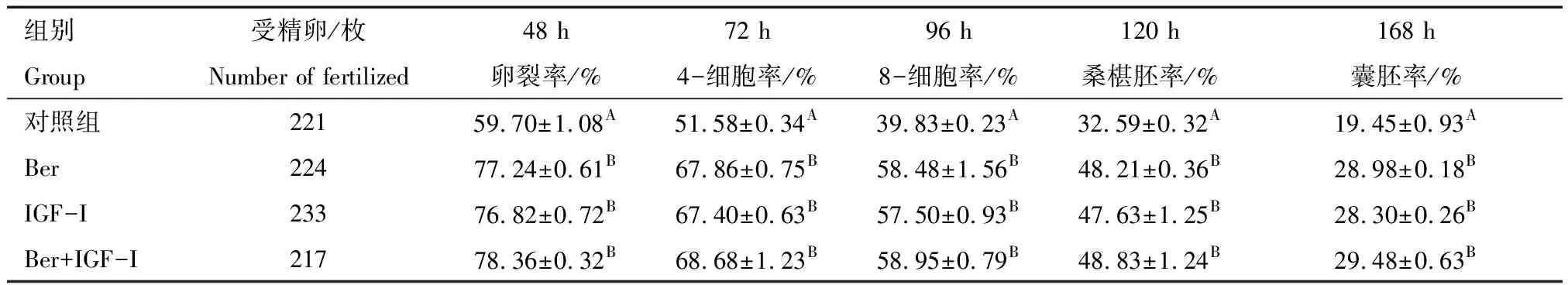
组别受精卵/枚48 h72 h96 h120 h168 hGroupNumber of fertilized卵裂率/%4-细胞率/%8-细胞率/%桑椹胚率/%囊胚率/%对照组22159.70±1.08A51.58±0.34A39.83±0.23A32.59±0.32A19.45±0.93ABer22477.24±0.61B67.86±0.75B58.48±1.56B48.21±0.36B28.98±0.18BIGF-I23376.82±0.72B67.40±0.63B57.50±0.93B47.63±1.25B28.30±0.26BBer+IGF-I21778.36±0.32B68.68±1.23B58.95±0.79B48.83±1.24B29.48±0.63B
注: 同列中不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
Note:In the same column, the difference is highly significant in different capital letters(P<0.01), and different lowercase letters indicate significant difference (P<0.05), The same letter indicates that the difference is not significant(P>0.05).
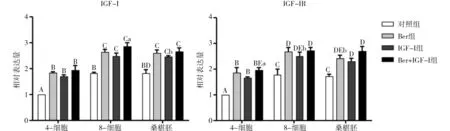
图2 各组别猪体外受精胚胎IGF-I、IGF-IR的转录水平Fig.2 Transcriptional levels of IGF-I and IGF-IR in vitro fertilization embryos of pigs
3 讨 论
本试验结果显示,IGF-I极显著提高猪体外受精胚胎发育率,以及4-细胞、8-细胞、桑椹胚三个时期IGF-I、IGF-IR的转录水平。有研究表明,IGF-I可提高牛克隆早期胚胎体外发育能力,且在各时期均可检测到IGF-IR表达[8]。IGF-I可协同子宫内生长因子FGF-II等通过影响基因igf-1下游通路的表达调解牛胚胎滋养层细胞的增殖[20],在牛胚胎中,IGF-I可通过PI3K/AKT信号通路介导抵抗由热应激所致的细胞凋亡效应[21]。在鸡胚中,IGF-I是通过介导PI3K/AKT通路参与细胞周期和细胞增殖过程[7]。此外,IGF-I可通过AKT通路诱导胃癌细胞上皮间质转化过程[22]。有研究表明,在猪胚胎发育的初期,IGF-I的主要作用与抗细胞凋亡有关[23],IGF-I在猪妊娠初期可调控包括PI3K/AKT等多种信号通路影响滋养层细胞增殖、迁移等过程[24]。由此推测,IGF-I可能也是通过调控基因IGF-I以及IGF-IR介导猪早期胚胎内的AKT通路,进而影响猪囊胚发育过程。
Ber可促进糖酵解途径,促进葡萄糖分解为乳酸[25]并调节凋亡相关的Bax、Bcl-2基因表达[26]。Ber在多种肿瘤中都发挥着有效的抗肿瘤作用[27,28],李孝峰[29]通过向培养基中添加不同质量浓度的Ber,并应用蛋白免疫印迹法检测细胞凋亡通路中凋亡执行因子cleaved caspase3的表达,发现其可通过影响增殖及凋亡过程调控人肾细胞癌细胞。Shuklas等[30]发现Ber在肝癌中促进Foxo1和Foxo3的表达。Ber可能通过调节细胞营养代谢以及凋亡相关基因表达进而促进细胞增殖、减少凋亡。IGF-I、IGF-IR及其下游通路AKT通路与细胞周期调控密切相关。而在本试验中,向胚胎培养液中添加Ber后,可极显著提高猪体外受精胚胎各时期发育率。这些作用可能是Ber通过调控IGF-I、IGF-IR的基因表达来实现的。此外,有研究发现Ber可能通过上调或下调几个与猪卵母细胞成熟相关的miRNA提高卵母细胞的体外成熟效果,具有降低脂滴含量的作用[16,17]。而在本试验中,Ber显著提高了IGF-I、IGF-IR基因水平的表达,其可能也是通过调控miRNA实现对胚胎细胞基因表达的调控。通过Ber对猪体外受精胚胎不同发育时期miRNA的差异表达分析,发现其中miR-18b显著下调。miR-18b是miR-17-92家族成员,通过影响mRNAs的稳定性和翻译来参与基因调控,miR-18b参与哺乳动物生长、分化及凋亡、免疫调节等多种生物过程。有研究发现,miR-18b通过调节其靶基因igf-1和IGF-I信号通路抑制高糖诱导的人视网膜内皮细胞增殖[31]。在鹿茸软骨细胞和间充质尖端新生组织中观察到一个显著下调基因miR-18b,过表达miR-18b会使IGF-I蛋白水平下调,软骨细胞增殖速度减慢,而miR-18b抑制剂转染后IGF-I的表达增加,促进细胞增殖,确认在梅花鹿角细胞中,igf-1是miRNA-18b的靶基因之一[32]。此外,Ber可调控AKT信号通路发挥作用,例如抑制乳腺癌细胞[33]、调控黑色素瘤细胞间充质转化[34]。在猪胚胎中,igf-1的表达与miRNA-18b可能相关。
本试验表明,同时添加Ber和IGF-I,与单独分别添加二者无显著差异,说明Ber可能通过下调miR-18b的表达,进而调控基因igf-1的mRNA的转录翻译,改变内源性IGF-I的表达量,这可能与外源性IGF-I介导内源性IGF-I、IGF-IR走向同一作用通路PI3K/AKT,进而参与细胞周期和细胞增殖的调控过程有关。Ber、IGF-I对AKT通路下游蛋白的影响有待进一步深入研究。
综上所述,猪体外受精胚胎培养液中添加一定质量浓度的Ber和IGF-I可显著提高猪体外受精胚胎发育率,提高其内源性IGF-I、IGF-IR基因转录水平,推测二者可能参与介导同一信号通路。
