朱砂叶螨几丁质酶TecCht1基因的原核表达与纯化
2019-02-22沈宏亮卜春亚
李 博,洪 鹏,沈宏亮,杨 金,卜春亚
(北京农学院生物科学与工程学院/农业部华北都市农业重点实验室,北京 102206)
朱砂叶螨(Tetranychuscinnabarinus)是一种世界广泛分布的害螨,具有繁殖速度快、种群密度大、个体小、极易产生抗药性等特点,所以防治十分困难[1-3]。此外,朱砂叶螨取食范围广,对果树以及玉米和棉花等农作物均造成不同程度上的危害[4-6]。有研究表明,朱砂叶螨已经对多种杀螨剂产生抗性[7,8]。每年中国需要很大部分的费用支出用于害螨的防治,并且至今仍处于不断上涨的趋势中[5,9,10]。且传统的杀螨剂,如有机磷类或氨基甲酸酯类杀螨剂,具有物种选择性差、易对螨产生抗性等特点[11]。开发和研制新型对朱砂叶螨有毒杀作用,但对其他非靶标有益生物无害的杀螨剂,具有十分重要的意义和应用价值。
几丁质(chitin),是通过β-1,4-糖苷键连接聚合N-乙酰葡糖胺形成的线性多聚物[12],又名壳多糖。几丁质酶(chitinase)是一种几丁质水解酶,最先在1921年由Folpmers从细菌中发现并提出[13]。几丁质酶可以将几丁质降解为分子量较低的二糖或三糖[14],在昆虫体内几丁质酶的功能为降解围食膜与更替新旧表皮[15-17]。
在几丁质酶的8种类型[17-20]中,Ⅰ型几丁质酶是最具有特征的,其包括一个信号肽(signal peptide)、一个几丁质结合区(chitin-binding domain)、一个连接糖基化位点与磷酸化位点的连接区(linker)与一个活性位点区(catalytic domain)。Ⅰ型几丁质酶Cht1,其主要参与更替新旧表皮过程中对旧表皮的消化过程。
目前,哈茨木霉(Trichodermaharzianum)、中国被毛孢(Hirsutellasinensis)、甜菜夜蛾(Spodopteraexigua)、玉米螟(Pyraustanubilalis)、二化螟(Chilosuppressalis)、二斑叶螨(Tetranychusurticae)等几丁质酶基因已被成功表达[21-24],关于蜱螨目几丁质酶表达的研究较少。几丁质在高等动植物中并不存在,参与昆虫几丁质代谢的酶类被认为是很好的杀虫剂靶标,几丁质酶作为新型杀螨剂的潜在靶标,有着十分广阔的应用前景和实践意义。
本研究以本实验室克隆的朱砂叶螨TecCht1基因为基础,对其催化结构域进行扩增,于pCold Ⅱ载体上进行原核体外表达,对重组蛋白进行纯化,对纯化后的目的蛋白进行Western Blot鉴定。为朱砂叶螨TecCht1的抗体制备、功能研究以及杀螨剂的研制奠定基础。
1 材料与方法
1.1 材 料
菌株和载体:Trans-T1感受态细胞购自北京全式金生物技术有限公司;pCold Ⅱ原核表达载体购自Takara公司;菌株DH5α、BL21购自北京鼎国昌盛生物科技有限公司。
主要试剂:T4连接酶购自北京全式金生物技术有限公司;TIANgel Midi Purification Kit、TIANpure Mini Plasmid Kit、2X Taq Mix购自天根生化科技(北京)有限公司;EX Taq酶、dNTP Mix、限制性内切酶(Sac Ⅰ和 EcoR Ⅰ)DNA Marker Ⅲ购自Takara公司;Cocktail蛋白酶抑制、一步法Western Blot试剂盒购自江苏康为生化试剂有限公司。
1.2 方 法
1.2.1 引物设计 在本实验室已克隆的TecCht1基因以及结构域分析的基础上,利用Primer Premier 6.0,设计带有 Sac Ⅰ和 EcoR Ⅰ酶切位点,以及上游加His-tag标签的上、下游引物,用于扩增TecCht1基因的催化结构域区域的引物:TecCht1-F1为5′-CATCATCATCATCATCATGAGCTCGATAAAGTGTTGATATGT-3′,TecCht1-R1为5′-GAATTCTCAAGTACCAAGGAAATCATC-3′。
1.2.2 目的基因的扩增 以实验室保存的T/TecCht1为模板,TecCht1-F1、TecCht1-R1作为扩增引物,进行PCR反应。将PCR产物用1%琼脂糖凝胶电泳分离检测。将目的条带胶块,用TIANgel Mini Purification Kit回收。PCR扩增程序为95℃预变性 5 min;95℃ 30 s,58℃ 30 s,72℃ 55 s,共35个循环;72℃延伸 10 min。
1.2.3 原核表达载体pCold Ⅱ/TecCht1的构建 将1.2.2步骤回收获得的PCR产物与载体pCold Ⅱ质粒分别用限制性内切酶 Sac Ⅰ和 EcoR Ⅰ进行双酶切反应。 37℃酶切2 h后,用1%琼脂糖凝胶电泳分离酶切产物并回收目的基因及载体的DNA片段,随后用T4 DNA Ligase连接,转化E.coliDH5α感受态细胞,获得阳性克隆菌落。使用TIANpure Mini Plasmid Kit进行质粒的提取,随后进行双酶切鉴定,将验证正确的质粒交由生工生物工程(股份)有限公司测序,测序正确的重组载体用于TecCht1的诱导表达。
1.2.4 TecCht1的诱导表达 将测序正确的 pCold Ⅱ/TecCht1 质粒转化E.coliBL21(DE3)感受态细胞,挑取单菌落,接种于3 mL含有氨苄抗生素的LB培养基,培养至OD600nm=0.6后,进行扩大培养。将此菌液全部加入到100 mL含有氨苄抗生素的LB培养基中, 37℃恒温180 r/min震荡培养,培养至 OD600nm值达到0.4~0.6;向全部菌液中加入终浓度为1 mmol/L IPTG进行诱导表达,15℃,110 r/min振荡培养,18、20、22、24、26、28、32 h分别取1 mL 菌液留样,利用SDS-PAGE电泳检测TecCht1表达量的情况,以及表达量与诱导时间的关系,确定最佳诱导时间为24 h。
1.2.5 TecCht1重组蛋白的可溶性分析 将含有pCold Ⅱ/TecCht1质粒的E.coliBL21(DE3)菌株划线培养,挑取单菌落,经3、100、1 000 mL的逐级放大培养后,加入终浓度为1 mmol/L的 IPTG,温度为15℃,110 r/min振荡培养24 h后,离心收集菌体沉淀。用PBS(pH 8.0)缓冲液洗涤后,沉淀用20 mL PBS缓冲液重悬,加入200 μL Cocktail蛋白酶抑制剂于垂直混合器中4℃反应1 h。功率380 w超声3 s,冷却10 s为一个循环,共进行170个循环破碎菌体;裂解完成后将裂解液于4℃ 7 800 r/min离心15 min,收集破碎后的上清和菌体沉淀。电泳分析重组蛋白的可溶性,电泳检测目的蛋白主要在沉淀中。
1.2.6 TecCht1重组蛋白的纯化 将收集的菌体沉淀用缓冲液A(140 mmol/L NaCl、2.7 mmol/L KCl、1.8 mmol/L KH2PO4、8 mol/L尿素、10 mmol/L Na2HPO4)超声溶解。4℃条件下离心15 min。将上清液加至已平衡的5 mL Ni-NTA中,颠倒混匀结合过夜后,用50 mL结合缓冲液A洗去未结合蛋白。用50 mmol/L咪唑洗脱缓冲液洗去与Ni-NTA非特异结合蛋白,200 mmol/L咪唑洗脱缓冲液洗脱,收集TecCht1重组蛋白组分,测定组分OD280nm值,SDS-PAGE电泳检测纯化情况。采用Amicon©Ultra-15将纯化的重组蛋白溶液进行尿素的梯度去除以及超滤浓缩,先置换成含8 mol/L尿素的50 mmol/L Tris-HCl(pH 8.0)缓冲液;随后分别用6 mol/L尿素的50 mmol/L Tris-HCl(pH 8.0)缓冲液、4 mol/L尿素的50 mmol/L Tris-HCl(pH 8.0)缓冲液、2 mol/L尿素的50 mmol/L Tris-HCl(pH 8.0)缓冲液与不含尿素的50 mmol/L Tris-HCl(pH 8.0)缓冲液进行梯度置换,浓缩后的目的蛋白保存于-80℃。
1.2.7 TecCht1重组蛋白的Western Blot鉴定 为进一步验证目的蛋白的特异性,将目的蛋白进行SDS-PAGE电泳后,将蛋白转移到PVDF膜上。按照康为世纪一步法Western Blot试剂盒的操作,以兔源抗His-tag抗体为一抗,加入抗体孵育45 min,经洗膜后用ECL显色液显色。
2 结果与分析
2.1 目的片段的扩增
对目的基因进行扩增,用1%的琼脂糖凝胶电泳检测PCR产物,目的条带大小正确,将目的条带进行胶回收(图1)。
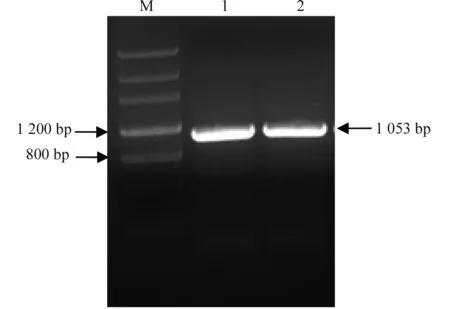
注:M: DNA MarkerⅢ,1-2:TecCht1。Note: M indicates DNA MarkerⅢ, and 1-2 indicate TecCht1.图1 目的片段的扩增Fig.1 PCR amplification of the target fragment
2.2 重组载体的双酶切验证
将PCR回收产物与pCold Ⅱ空载体分别双酶切,连接转化后,进行重组载体的双酶切验证。阳性克隆双酶切后出现2条条带,大小与空载体和目的片段的大小相符,阳性克隆测序验证正确,说明pCold Ⅱ/TecCht1原核表达载体构建成功(图2)。

注:M:DNA MarkerⅢ,1-2:重组载体。Note:M indicates DNA MarkerⅢ, and 1-2 indicate recombinant vectors.图2 重组载体双酶切验证Fig.2 Restriction enzyme analysis of recombinant vectors
2.3 目的蛋白的诱导表达
将pCold Ⅱ/TecCht1质粒转化E.coliBL21(DE3)感受态细胞,对转化后的阳性菌株进行诱导表达条件摸索。当诱导表达温度为15℃,IPTG终浓度为1 mmol/L,110 r/min振荡培养,诱导18、20、22、24、26、28、32 h后分别取样1 mL,进行SDS-PAGE检测,出现大小约42.3 kDa的目的条带,条带大小与目的蛋白的分子量一致。且在诱导表达24 h目的蛋白的条带最粗,且当诱导时间大于24 h,菌体对目的蛋白的表达量趋于稳定,所以确定诱导24 h为最佳诱导时间,可用于后续蛋白的大量表达纯化(图3)。

注:M:蛋白Marker 1:未诱导表达的全菌;2-8:诱导表达18、20、22、24、26、28、32 h后的全菌。Note: M indicates protein Marker, and 1 indicates no IPTG induction control, and 2-8 indicate bacteria proteins induced for 18、20、22、24、26、28、32.图3 IPTG诱导不同时间表达的TecCht1 SDS-PAGE分析Fig.3 SDS-PAGE analysis of TecCht1 expression induced by IPTG
2.4 目的蛋白的可溶性分析
将离心收集的诱导表达后的菌体沉淀,加入PBS缓冲液重悬,经超声破碎后,分别对上清液和沉淀进行SDS-PAGE检测。目的蛋白几乎都在破碎后的沉淀中,表明目的蛋白为包涵体表达(图4)。
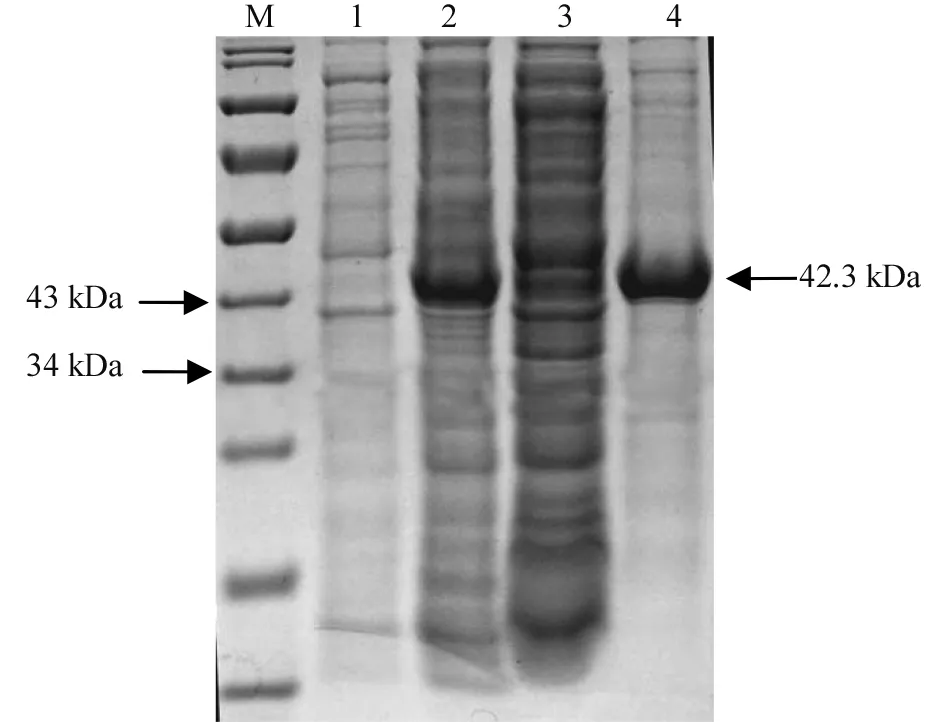
注:M:蛋白Marker 1:未诱导表达的全菌;2:诱导表达24 h后的全菌3:破碎后的上清液4:破碎后的沉淀。Note: M indicates protein Marker, and 1 indicates no IPTG induction control, and 2 indicates bacteria proteins induced for 24 h, and 3 indicates supernatant after ultrasonic disruption, and 4 indicates pellet after ultrasonic disruption.图4 SDS-PAGE分析表达的TecCht1的可溶性Fig.4 SDS-PAGE analysis of solubility of expressed TecCht1
2.5 目的蛋白纯化
将包涵体溶解离心后的上清液与Ni-NTA柱料结合,在4℃条件下纯化目的蛋白,随后进行复性,置换缓冲液,超滤浓缩后,进行SDS-PAGE分析。在43 kDa左右出现单一条带,说明获得纯度较高的目的蛋白(图5)。

注:M:蛋白Marker 1:纯化后的目的蛋白。Note: M indicates protein Marker, and 1 indicates purified TecCht1.图5 纯化后的TecCht1蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of purified TecCht1
2.6 目的蛋白的Western Blot分析
为进一步验证目的蛋白的特异性,将纯化后的蛋白进行Western Blot检测。在43 kDa左右出现特异性的目的条带,说明目的蛋白在pCold Ⅱ中成功表达,获得较纯的目的蛋白(图6)。

注:M:蛋白Marker 1:纯化后的目的蛋白。Note: M indicates protein Marker, and 1 indicates purified TecCht1.图6 纯化后的TecCht1蛋白的Western blot分析Fig.6 Western blot analysis of purified TecCht1
3 讨 论
几丁质是昆虫表皮和围食膜的重要组成之一,研究表明昆虫几丁质酶的功能为降解围食膜与更替新旧表皮[15-17],它具有发育时期阶段性表达的特点。几丁质酶表达水平的变化可能是致命的。在防治中,几丁质酶本身可作为生物农药[25],在饲料中添加,会加强其他农药对害螨的毒杀作用[26],但因其纯化工艺具有较高的成本,几丁质酶的实际生物防治效果还有待于进一步深入研究。
大肠杆菌作为表达系统的一种重要工程菌,其最大的特点是有着清晰的遗传背景,且其结构简单,能够在短时间内大量表达外源蛋白,且其成本低和使用方便。存在容易形成包涵体的特点,经过变性复性过程,可能使蛋白丧失活性。在表达真核蛋白时,不具备转录后加工过程,容易导致蛋白的不正确折叠。
李宏伟等[27]用pET 32a 载体在大肠杆菌中表达美洲大蠊几丁质酶基因; Tetsuro Shinoda等[28]在原核表达系统中成功表达斜纹夜蛾几丁质酶基因;但棉铃虫几丁质酶在pET 21b载体未成功表达[29]。本研究采用pCold Ⅱ冷休克表达载体,有助于解决TecCht1基因表达难的问题。
本研究成功构建pCold Ⅱ/TecCht1表达载体,通过15℃低温诱导,成功表达朱砂叶螨TecCht1蛋白,并摸索出其最适诱导表达时间为24 h。以最佳诱导表达时间为基础,通过对目的蛋白的变性和复性,成功获得纯度较高的TecCht1蛋白。为朱砂叶螨TecCht1蛋白抗体的制备和功能研究奠定基础,为研制新型选择性杀螨剂提供新思路。
