2种猪冠状病毒双重RT-PCR检测方法的建立与应用
2019-02-22温海京贾超伟刘芊麟张喜喜刘鑫宇周双海
温海京,贾超伟, 2,刘芊麟,张喜喜,刘鑫宇,周双海*
(1. 北京农学院动物科学技术学院,北京 102206;2. 门头沟区动物疫病预防控制中心,北京 102300)
近年来,以猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)为主要病原引起的传染性腹泻给国内养猪业造成严重经济损失[1-3]。PEDV和猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)都是专嗜胃肠道而致传染性腹泻的2种冠状病毒[4],二者感染致病后的临床症状、病理变化和流行病学都非常相似,导致难以进行临床鉴别诊断,必须进行实验室检测与鉴别诊断。
目前,PCR技术因特异性强、敏感性高、能够进行早期快速检测而被普遍用于传染病与其病原的检测与诊断。当前检测病原的PCR技术主要有常规PCR和荧光定量PCR,虽然后者在特异性与敏感性方面更高一筹[3, 5, 6],但其需要昂贵设备、且检测成本较高,故其实用性并不一定强于前者。单项PCR检测方法在一次PCR反应中只能检测一种病原,多重PCR检测方法在一次PCR反应中可同时检测多种病原而明显提高检测效率。本研究旨在建立一种能同时检测PEDV与TGEV的双重RT-PCR检测方法,并进行初步临床检测应用。
1 材料与方法
1.1 病毒模板与质粒
TGEV、PEDV、猪轮状病毒(PRoV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)等病毒模板和TGEV-M基因质粒与PEDV-M基因质粒为实验室构建保存。
1.2 引物设计
针对PEDV(JQ023161)的M基因和TGEV(GQ374564)的M基因保守序列,用Premier 5.0软件分别设计1对特异性引物,引物序列分别为PU:5′-CCCGTTGATGAGGTGATTGA-3′、PD:5′-GGATGCTGAAAGCGAAAAAG-3′(目的片段大小为229 bp)和TU:5′-GTGAGTCATGCTTCA ACGGAG-3′、TD:5′-GACACCAGTTGGCACACCTT-3′(目的片段大小为419 bp)。
1.3 单项PCR方法条件的筛选
用2×Taq MasterMix建立25 μL PCR反应体系,上、下游引物各10 pmol,DNA模板1.5 μL。PCR反应程序为:94℃ 5 min;94℃ 30 s,52℃ 30 s,72℃ 30 s,35 cycles;72℃ 10 min。取8L PCR扩增产物通过20 g/L的琼脂糖凝胶电泳进行鉴定。在此基础上,分别对单项PCR反应的退火温度和引物浓度进行筛选,以确定最佳单项PCR反应条件。
1.4 双重PCR方法条件的筛选
以单项PCR反应体系和步骤为基础,在单项PCR方法条件优化结果的基础上对双重PCR反应的2种引物浓度比例进行筛选,以确定最佳双重PCR反应条件。
1.5 双重PCR方法的特异性与敏感性试验
以TGEV、PEDV、PRoV、CSFV与PRRSV等常见RNA病毒为模板来检测该双重RT-PCR检测方法的特异性。选取6个稀释度的TGEV-M基因质粒浓度(4.9×105~4.9×100copies/L)与PEDV-M基因质粒浓度(5.9×105~5.9×100copies/L)为模板来检测该双重RT-PCR方法的敏感性。
1.6 临床样品检测与统计分析
采集2013—2016年京津冀地区18个猪场的235份仔猪腹泻粪样,用1 mL灭菌生理盐水对样品进行稀释,10 000 r/min离心3 min,取250 μL上清液,参照TRIzol Reagent试剂使用说明书提取总RNA,并溶于15 μL DEPC处理过的ddH2O中,取5 μL RNA按照康为世纪生物科技有限公司M-MLV反转录说明书进行反转录以合成cDNA。用建立的PEDV和TGEV的双重PCR检测方法和单项PCR方法分别进行检测,并随机选取3个检测为阳性样品的PCR产物进行测序鉴定。用卡方检验比较两种方法检测出的PEDV与TGEV的个体阳性率、猪场阳性率之间的差异和PEDV与TGEV的检出率之间的差异。
2 结果与分析
2.1 单项PCR反应条件的优化
不同退火温度的PCR扩增结果(见图1)显示,TGEV与PEDV都是在退火温度为51.4℃时目的条带最亮,故选择51.4℃左右作为最佳退火温度。

注:A是TGEV;B是PEDV;M是DNA Marker;1-4是退火温度分别为49.6、51.4、53.9、55.8℃;5是阴性对照。Note: M was DNA Marker; 1-4 was different annealing temperature (49.6, 51.4, 53.9, 55.8℃); 5 was negative control.图1 单项PCR退火温度的筛选Fig.1 Screening of annealing temperature for the single PCR
不同引物浓度的PCR扩增结果(见图2)显示,TGEV和PEDV都是在引物浓度为2.0mol/L或4.0mol/L时目的条带更亮,因此选择2.0mol/L至4.0mol/L作为2种引物的最佳浓度范围。

注:A是TGEV;B:PEDV;M是DNA Marker;1-5是引物浓度分别为1.0、2.0、4.0、6.0、8.0 mol/L。Note: M was DNA Marker; 1-5 was different primer concentration (1.0, 2.0, 4.0, 6.0, 8.0 mol/L).图2 单项PCR引物浓度的筛选Fig.2 Screening of primer concentration for the single PCR
2.2 双重PCR反应条件的优化
不同引物浓度比例的PCR扩增结果(见图3)显示,PEDV与TGEV引物浓度比例为2.0mol/L比4.0mol/L时2条目的条带都较亮,故确定为最佳引物浓度比例。

注:M是DNA Marker;1-4是PEDV与TGEV引物浓度比例分别为2.0 mol/L比2.0 mol/L、2.0 mol/L比4.0 mol/L、4.0 mol/L比2.0 mol/L、4.0 mol/L 比4.0 mol/L;5是阴性对照。Note: M was DNA Marker; 1-4 was different ratio of primer concentration for PEDV to TGEV (2.0 mol/L to 2.0 mol/L, 2.0 mol/L to 4.0 mol/L, 4.0 mol/L to 2.0 mol/L, 4.0 mol/L to 4.0 mol/L); 5 was negative control.图3 双重PCR引物浓度的筛选Fig.3 Screening of primer concentration for the duplex PCR
2.3 双重PCR方法的特异性与敏感性
特异性试验结果显示,仅含有PEDV、TGEV的模板扩增出特异性目的产物条带,表明建立的双重RT-PCR检测方法有良好特异性(图4)。
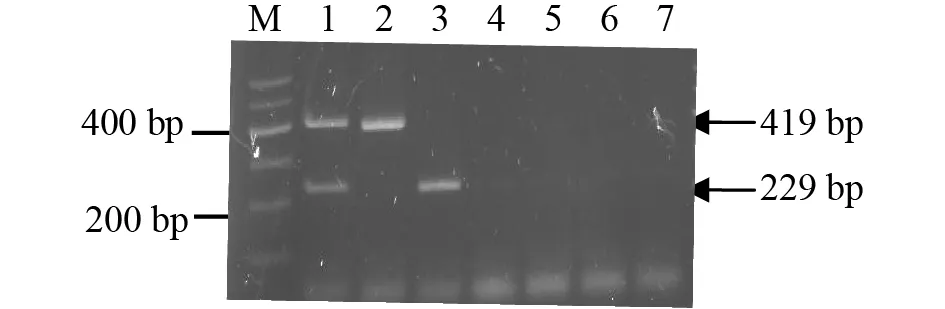
注:M是DNA Marker;1-6分别为病毒模板PEDV+TGEV、TGEV、PEDV、PRoV、PRRSV、CSFV;7是阴性对照。Note: M was DNA Marker; 1-6 was virus template (PEDV+TGEV, TGEV, PEDV, PRoV, PRRSV, CSFV); 7 was negative control.图4 双重PCR的特异性试验Fig.4 The specificity of the duplex PCR
敏感性试验结果显示,能够扩增出PEDV与TGEV的特异目的条带的最低模板浓度分别为5.9×101、4.9×101copies/L,故确定这2个浓度为建立的双重RT-PCR检测方法的相应灵敏度(图5)。
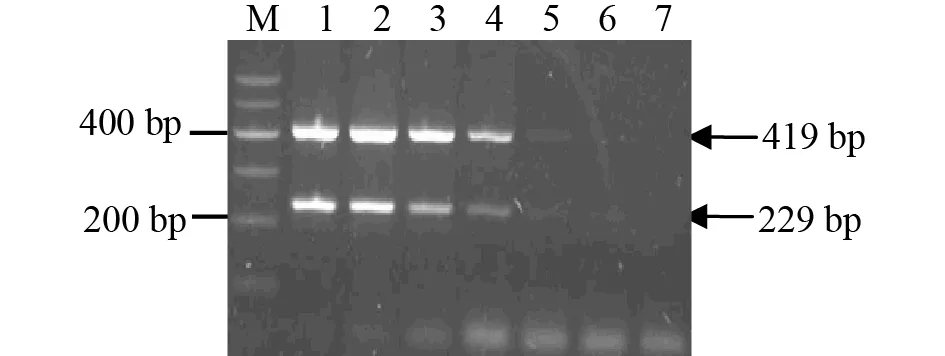
注:M是DNA Marker;1-6是PEDV和TGEV的质粒浓度分别为5.9×105~5.9×100、4.9×105~4.9×100 copies/L;7是阴性对照。Note: M was DNA Marker; 1-6 was plasmid concentration of PEDV (5.9×105~5.9×100 copies/L) and TGEV (4.9×105~4.9×100 copies/L); 7 was negative control.图5 双重PCR的敏感性试验Fig.5 The sensitivity of the duplex PCR
2.4 临床样品的检测与分析
用PEDV与TGEV的单项RT-PCR和双重RT-PCR方法对2013—2016年京津冀地区18个猪场的传染性腹泻仔猪粪样进行检测,结果显示,PEDV的单项RT-PCR与双重RT-PCR检测的阳性率分别在60.0%~93.3%、58.3.0%~86.7%之间,其总个体阳性率分别为79.1%、73.6%,二者之间无显著性差异(P>0.05),其符合率为94.5%;TGEV的单项RT-PCR与双重RT-PCR检测的阳性率分别在0%~15.4%、0%~8.3%之间,其总个体阳性分别为3.4%、2.1%,二者之间也无显著性差异(P>0.05),其符合率为98.7%(表1)。随机选取3个检测为阳性样品的PCR产物进行克隆与测序鉴定,结果显示所克隆序列与相应参考序列的核苷酸同源率均达99%以上,再次证实PCR检测结果为PEDV或TGEV,说明临床检测结果有很好的特异性。双重RT-PCR检测方法对临床疑似PEDV和/或TGEV感染样品的检出率非常接近其单项RT-PCR检测方法,表明该双重RT-PCR检测方法可用于临床检测。
进一步分析发现,PEDV的个体阳性率超过70%而极显著(P<0.01)高于TGEV的不足5.0%(表1)。同时,PEDV的猪场阳性率为100%,也极显著(P<0.01)高于TGEV的27.8%。

表1 临床样品中PEDV与TGEV的检出率比较Tab.1 Comparison of detection rate of PEDV and TGEV
注:同列数据尾部有不同大写字母者表示差异极显著(P<0.01)。
Note:Those data with different capitals at the end of the same column indicated very significant differences (P<0.01).
3 讨 论
引物设计是多重PCR技术中至关重要的一环,必须考虑所扩增检测的病原基因序列与实际扩增效果。PEDV与TGEV同属于冠状病毒,二者基因组大小与组成相似,其M基因与N基因适合作为检测目的基因[7]。在前期建立检测PEDV与TGEV的荧光定量PCR方法过程中,发现M基因的扩增效果均明显优于N基因[3, 6],故均选用M基因作为检测PEDV与TGEV的目的基因来设计引物。在比较试验3对TGEV引物和2对PEDV引物后,筛选出试验中的2对特异性引物。
多重PCR检测方法的困难主要在于同一个反应体系中加入多对特异性引物时,多对引物之间容易产生互相干扰而降低PCR反应的敏感性。多重PCR检测方法的敏感性往往低于单项PCR方法,容易出现假阴性结果。一些研究者建立PEDV和TGEV的双重RT-PCR方法,但其检测敏感性各不相同。陈芳[8]等与贾锐[9]等建立的方法的灵敏度介于10~100 pg/L病毒核酸,推算出大致相当于104~106copies/L;郑世民[10]等建立的方法的灵敏度分别为9.6、7.3 TCID50/0.1 mL病毒核酸,推算出大致相当于100~200 copies/L;刘邓等[11]建立的方法的灵敏度均为100 copies/L。本试验建立的方法对PEDV和TGEV的检测灵敏度分别为59、49 copies/L,较这些研究者建立的方法有所提高甚至明显提高;对235份仔猪腹泻病料的比较检测显示,2种冠状病毒的双重RT-PCR检测结果接近于单项RT-PCR检测结果,二者之间的符合率分别为94.5%和98.7%;同时,所建立的方法对当前比较流行的猪源RNA病毒的检测结果均为阴性,对临床检测阳性的样品的随机测序鉴定结果也全部证实为特异目的产物;说明所建立的双重RT-PCR检测方法具有很高的灵敏性与很好的特异性,可应用于临床检测。
对2013—2016年18个猪场的235份仔猪腹泻病料进行检测,结果显示,PEDV和TGEV的猪场阳性率与总个体阳性率分别为100.0%、73.6%和27.8%、2.1%,PEDV极显著高于TGEV。任玉鹏等[14]对四川省6个猪场46份腹泻病料的检测显示PEDV和TGEV的感染率分别为76.1%和19.6%,未检出轮状病毒;王元等[15]对新疆10个规模化猪场159份腹泻病料的检测发现PEDV和TGEV的感染率分别为62.9%和0%;孟凡伟等[3]、张雪等[6]对2011—2013年北京、天津地区10个猪场139份腹泻样品的检测结果显示,TGEV和PEDV的猪场阳性率与总个体阳性率分别为40%、9.4%和100.0%、76.2%,在猪场阳性率和个体阳性率两个方面,PEDV的检出率均显著高于TGEV的检出率。仔猪传染性腹泻在中国自2010年冬季暴发以来,至今在不少地方仍然流行,这些资料均来自于2010年以来中国部分地区数据。综合分析发现,近年来发生传染性腹泻的猪场中,PEDV检出率非常明显地高于TGEV检出率,提示在当前猪传染性腹泻流行情况下,PEDV较TGEV更需值得关注与防控。
