三种方法浓缩慢病毒后绿色荧光蛋白转染效率的比较
2019-02-21毕冉冉刘志强刘惠亮
毕冉冉,白 睿,刘志强,刘惠亮
利用病毒我们可以高效地将要研究的基因在目标细胞中过表达或不表达。目前,病毒转染已广泛应用于基因治疗、疫苗生产以及科学研究[1,2]。常用的病毒载体有腺病毒[3]、反转录病毒和慢病毒。慢病毒载体具有可同时感染分裂和非分裂细胞[4,5]、外源基因容量大、目的基因表达稳定[6-8]、低免疫原性等优点,成为目前转染效率较高、应用较广的病毒载体。
慢病毒转染细胞前要先进行慢病毒构建和包装、浓缩和纯化、滴度测定等步骤,而在实验操作中这些步骤都会影响病毒的转染效率。目前还未有关于探讨慢病毒浓缩和纯化影响病毒转染效率的相关文献,因此笔者主要从病毒浓缩和纯化这个方面比较超滤管法、超速离心法及病毒浓缩液法这三种方法浓缩慢病毒后的GFP转染效率。
1 材料与方法
1.1 材料 293T细胞;DMEM基础培养液;0.25%胰酶(0.25%胰蛋白酶/1 mmol/L EDTA);胎牛血清(FBS)(康源生物科技有限公司);psPAX2菌种;pMD2.G菌种;GFP慢病毒载体菌种;LB液体培养液,质粒提取专用试剂盒;EntransterTM-H4000试剂盒。
1.2 方法
1.2.1 pMD2.G、psPAX2及GFP慢病毒载体质粒的提取 准备3个玻璃管并向其内加入3 ml加有氨苄的LB培养液,然后从-80 ℃拿出pMD2.G、psPAX2及GFP慢病毒载体菌种,用黄色枪头分别吸取15~20 μl的pMD2.G、psPAX2及GFP慢病毒载体菌种加入到先前加了氨苄的LB培养液中,做好标记之后将其放入37 ℃全温振荡器中振荡12~15 h。再准备3个200 ml的加有氨苄的LB培养液,分别向其内加入1 ml先前振荡好的pMD2.G、psPAX2及GFP慢病毒载体菌种,之后标记好将其放入37 ℃全温振荡器中振荡12~15 h。分别收集pMD2.G、psPAX2及GFP慢病毒载体菌种用质粒提取专用试剂盒分别提取这三种质粒。
1.2.2 GFP慢病毒的包装和浓缩纯化 要进行GFP慢病毒的包装[9-11]和浓缩纯化,需要提前1 d接种293T细胞于10 cm培养皿中,将pMD2.G、psPAX2及GFP慢病毒载体质粒以及EntransterTM-H4000试剂混匀后加入培养皿中并将其置于37 ℃、5% CO2的饱和湿度培养箱中培养,6 h后更换新鲜的DMEM完全培养液。48 h后收集病毒上清液,之后向培养皿中加入新鲜的DMEM完全培养液,24 h后再次收集病毒上清液。之后将收集的病毒上清液分别用超滤管法、超速离心法及病毒浓缩液法进行浓缩纯化,并使最后浓缩的体积都是400 μl,然后保存于-80 ℃。
1.2.3 三种浓缩病毒转染293T细胞后GFP的荧光显微镜检测 24孔板接种293T细胞,接种密度为1×104个/ml,接种13个孔,其中一个孔作为空白对照组用不加病毒的新鲜培养液正常培养,其余每4个孔分为一组,分别命名为超滤管法、超速离心法以及病毒浓缩液法三组,之后分别向每一组的4个孔中分别加入2、4、8、16 μl的同种浓缩病毒液及Polybrene,并将其置于37 ℃、5%CO2的饱和湿度培养箱中培养。48 h后,更换新鲜培养液并在荧光显微镜下观察转染后293T细胞GFP表达情况。
1.2.4 三种浓缩病毒转染293T细胞后GFP的流式检测 24孔板接种293T细胞,接种密度为1×104个/ml,接种13个孔。其中一个孔作为空白对照组用不加病毒的新鲜培养液正常培养,其余每4个孔分为一组,分别命名为超滤管法、超速离心法以及病毒浓缩液法三组,之后分别向每一组的4个孔中各加入2 、4、8、16 μl的同种浓缩病毒液以及Polybrene,并将其置于37 ℃、5%CO2的饱和湿度培养箱中培养。48 h后,用0.25%胰酶(0.25%胰蛋白酶/1 mmol/L EDTA)消化细胞后用离心管收集各孔的细胞,离心去上清,PBS重悬细胞,最后用流式细胞仪检测各管的GFP表达率。实验重复3次。
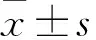
2 结 果
2.1 GFP的荧光显微镜检测 若293T细胞表达GFP,会在荧光显微镜下看到绿色荧光。空白对照组荧光显微镜下未看到绿色荧光(图1),随着转染量的增加,GFP表达率增加,超滤管法浓缩病毒转染293T细胞后GFP的表达效率最高(图2)。

图1 荧光显微镜观察空白对照组293T细胞GFP表达情况(100×)
2.2 GFP的流式检测 三种浓缩病毒转染293T细胞48 h后,收集各孔细胞后用PBS重悬,用流式细胞仪检测GFP的表达率(图3、图4),图3示空白对照组293T细胞GFP表达率为0%,每一组中随着转染量的增加,GFP表达率增加;相同体积的病毒转染293T细胞48h显示超滤管法浓缩病毒转染293T细胞后GFP的表达效率最高(表1)。

图2 荧光显微镜观察三种浓缩病毒组转染293T细胞48 h后GFP表达情况(100×)

表1 病毒浓缩液法组、超滤管法组、超速离心管法组不同病毒量GFP表达率的比较

图3 流式细胞仪检测空白对照组293T细胞GFP表达率

图4 流式细胞仪检测三种浓缩病毒组转染293T细胞48 h后GFP表达率
3 讨 论
GFP基因是一种新型的报告基因[12-15],通过病毒载体将GFP基因与目的基因结合然后转染细胞使其表达,然后通过荧光显微镜观察细胞GFP表达情况。近年来,GFP报告基因已广泛应用于细胞水平研究或活体内追踪[16-20]。病毒载体有腺病毒、反转录病毒和慢病毒载体。其中慢病毒载体与其他两种病毒载体相比具有转染效率高(可同时感染分裂和非分裂细胞、外源基因容量大、目的基因表达稳定、低免疫原性等优点。慢病毒转染包括慢病毒载体构建和包装、浓缩和纯化、感染靶细胞。其中慢病毒载体构建和包装、浓缩和纯化会影响病毒转染靶细胞的效率。
至今还未有关于探讨慢病毒浓缩和纯化影响病毒转染效率的相关文献,因此本文主要从病毒浓缩和纯化这个方面探讨比较超滤管法、超速离心法以及病毒浓缩液法这三种方法浓缩慢病毒后的GFP转染效率。通过荧光显微镜观察和流式细胞仪检测比较三种浓缩病毒转染293T细胞48h后GFP表达情况,不管是荧光显微镜观察还是流式细胞仪检测,结果都显示:随着转染量的增加,GFP表达率增高;相同体积的病毒转染293T细胞48 h显示超滤管法浓缩病毒转染293T细胞后GFP的表达效率最高。
通过本实验研究可以看出,不同的病毒浓缩方法对病毒浓缩和纯化的效率不同,进而影响着病毒转染的效率。超滤管法、超速离心法以及病毒浓缩液法三种病毒浓缩和纯化方法中超滤管法浓缩和纯化病毒的效果最好,为以后慢病毒的浓缩和纯化提供理论依据。但是本实验只是初步得出超滤管法浓缩和纯化病毒的效果最好,若要进一步明确这一结论还需后续实验验证。另外,本实验研究的是慢病毒的浓缩和纯化,针对其他载体病毒的浓缩和纯化,超滤管法是否仍是三种病毒浓缩方法中浓缩效果最好的,需要下一步实验验证。
