白三叶TrMYB1R1全长克隆及转录表达分析
2019-02-19马赛男
贾 彤,马赛男,雍 斌,张 艳,吴 星,李 州,彭 燕
(四川农业大学草学系,四川 成都 611130)
白三叶(Trifolium repens)是世界范围内广泛栽培的多年生豆科牧草,具有营养价值高、茎叶丰富、适口性好等特性,为各种畜禽所喜食。此外,由于其具有根系固氮能力强、再生恢复速度快、颜色碧绿均匀、绿期长等特点,也是庭院、城市绿化建植和水土保持的重要草种[1]。然而,由于受全球气候变化的影响,极端气候事件出现的频率和强度明显增加,诸如白三叶等作物以及生长在自然环境中的各种植物常常容易受到多种环境胁迫的危害[2];同时国内土地盐碱化、重金属污染也日益严峻,严重影响植物的生长发育,也限制了作物的产量和品质[3]。当前虽然通过杂交育种、栽培管理、外源植物生长调节剂等方法改善白三叶抗逆能力,但仍需不断探寻更有效的方法以应对日益严峻的环境形势,其中,与抗逆相关基因的挖掘与应用受到高度关注,并成为研究热点[4]。
转录因子是植物中最重要的调控蛋白,几乎参与了生物体内所有的生命过程,研究表明多种类型的转录因子参与植物的抗逆应答反应,例如AP2、bZIP、MYB、NAC 和 Zinc finger类 转录 因子[5-7]。MYB家族转录因子是植物中最大的一类转录因子家族,其蛋白在结构上具有由1~4个MYB重复单元组成的MYB结构域,根据MYB结构域所含MYB重复个数,MYB家族转录因子被分为4种类型,即包含4个MYB重复的4R-MYB、3个MYB重复的3R-MYB、2个MYB重复的R2R3-MYB及1RMYB类型的MYB转录因子家族[8]。在每个MYB重复内部会形成3个α-螺旋结构,其中靠近C末端的两个α-螺旋(第2个和第3个)会形成螺旋-转角-螺旋结构域(HTH),参与对靶序列的识别和作用[9]。每个MYB重复通常包含50~53个氨基酸,在每个MYB重复多肽链上一般都含有3个保守色氨酸残基,它们相互之间间隔18或19个氨基酸,这3个色氨酸残基形成一个疏水核心,这对于维持HTH的构型以及MYB蛋白同靶DNA之间相互作用具有重要意义[10]。
随着植物中第一个MYB转录因子在玉米(Zea May)中被发现[11],大量编码MYB转录因子的基因被分离鉴定。近年来,人们对植物MYB转录因子的功能也进行了广泛的研究,越来越多的MYB转录因子功能被揭示,研究发现MYB转录因子是一类多功能蛋白家族,它参与了生物体中多个生命过程的调节,如参与植物初级和次级代谢的调节,细胞发育、形态建成及细胞周期的调控,植物激素合成及信号传导的调控,植物生物和非生物胁迫的应答调控等[9,12-13]。尽管对MYB家族转录因子的抗逆功能报道较多,但有关白三叶MYB转录因子的抗逆相关研究较少。本研究通过RT-PCR以及RACE技术克隆白三叶目标基因(MYB1R1)全长,对其进行生物信息学分析,并采用荧光定量PCR对该基因在不同非生物胁迫和激素诱导下进行转录表达分析,研究结果为进一步研究MYB1R1在白三叶中的生物学功能奠定基础。
1 材料与方法
1.1 试验材料与主要试剂
本研究采用广泛栽培的品种‘拉丁诺'(Landino)白三叶为试验材料。
RNA 提取试剂盒 (RNAprep Pure Plant Kit)、普通琼脂糖凝胶DNA回收试剂盒 (TIANgel Midi Purification Kit)及 DH5α 感受态细胞购于 TIANGEN Biotech公司;反转录试剂盒(iScriptTM Ⅱ Strand cDNA Synthesis Kit)购于 Bio-Rad Laboratories公司;RACE试剂盒 (SMARTer® RACE 5′/3′Kit User Manual)、PCR反 应 用DNA 聚 合 酶 (PrimeSTAR Max DNA Polymerase)、DNA A-Tailing Kit试剂、pMDTM19-T Vector Cloning Kit试 剂 及 荧 光 定 量 试 剂 (SYBR Premix Ex Taq II)购于 TaKaRa 公司;其他化学试剂均为国产分析纯。
1.2 RT-PCR扩增和序列测定
利用RNA提取试剂盒提取白三叶叶片总RNA,采用反转录试剂盒进行反转录反应,获得cDNA。根据NCBI上公布的蒺藜苜蓿(Medicago truncatula,EF468475.1)和鹰嘴豆(Cicer arietinum,XM_0127 18141.1)MYB 基 因 序 列 , 采 用 Primer Premier 5.0设 计 简 并 引 物 MYB1R1 1F 和 MYB1R1 1R(表 1),进行PCR扩增,扩增体系为50 μL。PCR扩增程序为:94 ℃ 预变性 5 min,98 ℃ 变性 10 s,55 ℃ 退火 5 s,72 ℃ 延伸 5 s,35 个循环。PCR 反应完成后,PCR产物用1%琼脂糖凝胶电泳检测。将产物切胶纯化后,连接到pMD19-T载体上,转化大肠杆菌DH5α,筛选阳性克隆,将正确菌液送至华大基因公司测序。
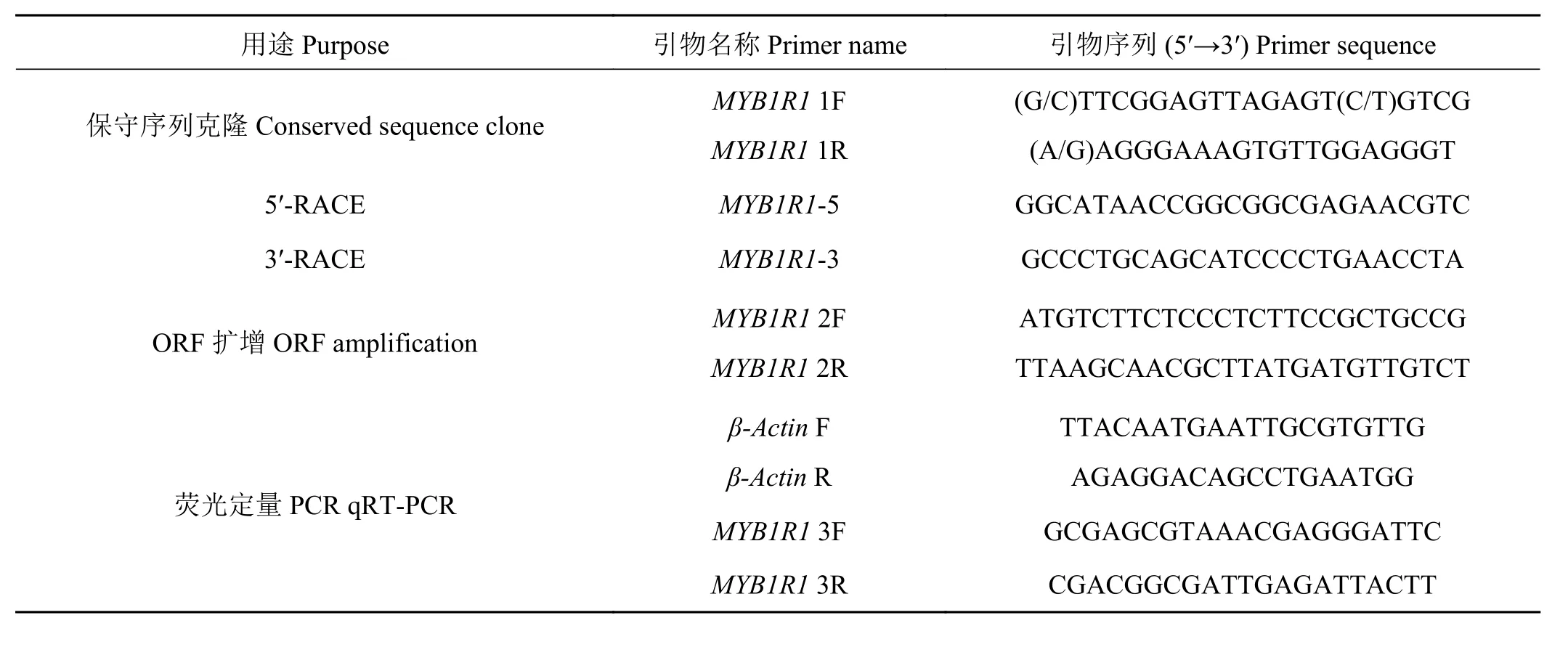
表1 基因克隆及荧光定量引物信息Table 1 Primers used in this study
1.3 RACE反应克隆MYB1R1转录因子全长
参照RACE试剂盒,以1.2提取的总RNA为模板,分别合成5′RACE和3′RACE所需cDNA,利用测序所得部分序列设计RACE特异性引物MYB1R1-5和MYB1R1-3(表1)。PCR反应参照RACE试剂盒进行,反应体系为50 μL。扩增产物经电泳检测后,回收纯化,连接转化,筛选阳性克隆进行测序。运用DNAMAN软件将测序所得RT-PCR与RACE反应所得片段进行基因全长序列拼接,利用ORF Finder预测开放阅读框(ORF),设计特异性引物 MYB1R1 2F 和 MYB1R1 2R(表 1)进行 ORF 验证。
1.4 生物信息学分析
采用在线分析软件Protparam、NetPhos、SOPMA、SMART、Psort及SWISS-MODEL对该基因编码蛋白质的理化性质、磷酸化位点、二级结构、功能结构域、三维空间结构和亚细胞定位分析。在NCBI上检索同源序列,使用MEGA 5.1进行进化树分析。
1.5 基因表达模式分析
将白三叶种子经5% NaClO消毒后,均匀播种于石英沙盘中,置于培养箱中培养[23 ℃/19 ℃(光照/黑暗),光周期为12 h,相对湿度75%,光强700 μmol·(m2·s)-1]。蒸馏水培养 7 d,进行发芽;之后换用Hoagland全营养液培养,每隔1 d替换一次营养液,待幼苗培养30 d后,取长势一致的幼苗处理。将幼苗先置于蒸馏水中漂洗,随后置于含处理液的离心管中,处理液均用蒸馏水配制。胁迫处理为 15% PEG (模拟干旱胁迫)、200 mmol·L-1NaCl(盐 胁 迫)、 600 μmol·L-1CdSO4(重 金 属 镉 胁迫)、4 ℃(冷处理)及 35 ℃(高温处理),取样时分别剪取幼苗叶片和根部。激素处理为100 μmol·L-1的 脱 落 酸 (ABA) 和 100 μmol·L-1的 细 胞 分 裂素(CTK,6-BA),取样时仅剪取幼苗叶片。分别在处理0、1.5、3、6、12和24 h进行取样。取样后立即将样品放入液氮中冷冻,提取样品总RNA,反转录合成cDNA,作为荧光定量表达模板。
以实验室筛选的肌动蛋白基因(β-Actin)为内参,引物为 β-Actin F 和 β-Actin R(表 1),根据已克隆获得基因全长序列设计特异性引物MYB1R1 3F和MYB1R1 3R(表1),参照荧光定量试剂盒进行试验。反应体系为10 μL,每个处理设置4次独立生物学重复,PCR扩增程序为:95 ℃预变性5 min,95 ℃变性30 s,63 ℃ 退火 30 s,72 ℃ 延伸 30 s,共 40 个循环。
2 结果与分析
2.1 白三叶TrMYB1R1基因序列全长分析
以白三叶叶片cDNA为模板,利用简并引物,通过RT-PCR反应得到一条长约700 bp的条带,经测序得到预期保守序列。通过5′RACE和3′RACE技术获得基因两端序列。运用DNAMAN 软件拼接RT-PCR与RACE反应所得片段,并利用ORF Finder预测开放阅读框,设计ORF引物对拼接序列进行验证。结果显示TrMYB1R1基因(已上传GenBank但未公开,登录号为KX940980)cDNA序列全长1 403 bp(红色方框标注分别为起始密码子和终止密码子),其中 5′端非编码区序列长 140 bp,3′端非编码区序列长 369 bp,开放阅读框共 894 bp,编码297个氨基酸残基(图1)。
2.2 白三叶TrMYB1R1基因编码的蛋白特性
利用Protparam分析TrMYB1R1编码蛋白质的分子式为C1407H2233N423O464S11,相对分子质量为32.8514 kDa,等电点为 8.5;正电荷残基 (Arg + Lys)为31个,负电荷残基(Asp + Glu)为33;不稳定系数为60.03,属不稳定蛋白;平均亲水性系数为-0.716,为亲水性蛋白。NetPhos预测蛋白可能的磷酸化位点,发现其含有44个磷酸化位点(33个丝氨酸、10个苏氨酸及1个酪氨酸),这些位点的存在说明TrMYB1R1蛋白翻译后还需多种修饰作用,以调节蛋白表达水平。
SOPMA预测TrMYB1R1蛋白的二级结构如图2所示,该蛋白含有较多的延伸链和无规则卷曲,其中α-螺旋(Hh)由47个氨基酸残基组成,占15.82%;延伸链(Ee)由67个氨基酸残基组成,占22.56%;β-转角(Tt)由13个氨基酸残基组成,占4.38%;无规则卷曲(Cc)由170个氨基酸残基组成,占57.24%。SMART分析该基因的保守结构域(图3),发现TrMYB1R1编码的蛋白在靠近N端位置含有一个MYB保守结构域R88-R138,为MYB-related 类型转录因子,同时含有3个低复杂度区域,分别位于D42-D61、N223-F235和 T242-L263。用 SWISS-MODEL 模拟MYB1R1的三维结构(图4),其保守序列含有3个α-螺旋有助于其折叠成正确的蛋白结构。利用Psort对TrMYB1R1蛋白进行亚细胞定位预测,结果显示在细胞核的可信度较高,为0.600,因此该蛋白可能定位于细胞核中,这与转录因子调节基因转录作用的功能相符合。
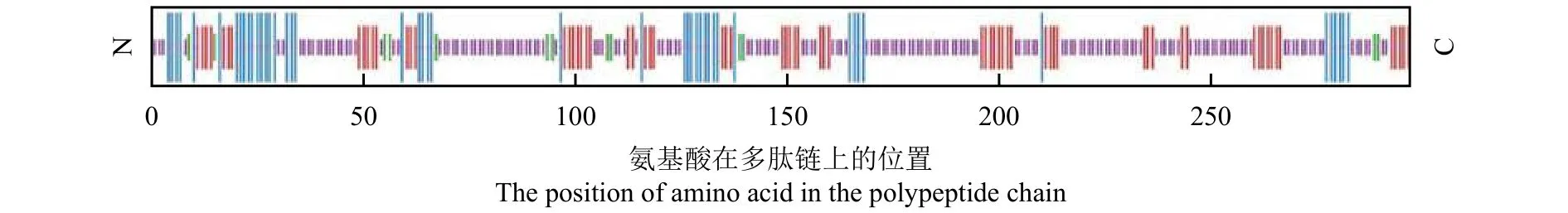
图2 TrMYB1R1转录因子的二级结构Figure 2 The predicted secondary structure of TrMYB1R1

图3 TrMYB1R1转录因子蛋白保守结构域分析Figure 3 The conserved domain of TrMYB1R1

图4 TrMYB1R1转录因子蛋白三维结构Figure 4 The three-dimensional structure of TrMYB1R1
利用BLAST软件搜索与白三叶TrMYB1R1转录因子蛋白同源性较高的序列,再通过MEGA5.0软件运用Neighbour-Joining方法构建同源进化树(图5)。根据系统进化树可知,TrMYB1R1转录因子的进化基本符合植物进化分类,相同科的植物聚为同一小类。白三叶、鹰嘴豆(Cicer arietinum)和蒺藜苜蓿(Medicago truncatula)聚于一个小的进化分支,表明它们具有较近的亲缘关系;且白三叶与同一科的植物大豆(Glycine max)、木豆(Cajanus cajan)、菜豆(Phaseolus vulgaris)等植物进化关系也较近,与蔓花生(Arachis duranensis)、落花生(Arachis hypogaea)等植物的进化关系相对较远。而白三叶与其他科属植物如芸香科的甜橙(Citrus sinensis)、蔷薇科的苹果(Malus domestica)和白梨(Pyrus x bretschneideri)、葫芦科的甜瓜(Cucumis melo)和黄瓜(Cucumis sativus)、茄科的美花烟草(Nicotiana sylvestris)的亲缘关系相较与同一科植物而言相距更远。
2.3 非生物胁迫处理下白三叶TrMYB1R1基因的表达谱
为了研究非生物胁迫对白三叶TrMYB1R1的影响,采用实时荧光定量PCR方法,分析了干旱(15% PEG-6000)、冷 (4 ℃)、热 (35 ℃)、重金属镉(600 μmol·L-1CdSO4) 和 盐 (200 mmol·L-1NaCl)5 种胁迫条件下TrMYB1R1在叶片和根系中的动态表达(图6)。在干旱、热、镉3种胁迫处理下,TrMYB1R1表达量均呈现不同程度的下调,且根与叶都呈现“降-升-降”的表达趋势(图6A-D)。PEG和冷处理后,TrMYB1R1转录因子在叶片表达的变幅均较根部明显,但在相同处理条件下不同处理时间长度,基因在叶片与根部的表达趋势均同步。PEG胁迫下,TrMYB1R1在处理1.5 h表达量显著降低,3 h表达量缓慢升高,6 h升至最高达到正常水平,而后基因表达量又开始降低(图6A)。冷处理后,TrMYB1R1在处理 1.5 h表达量下降,3 h表达量上升,而后又下降(图6B)。热处理后,基因在叶片和根中的表达皆明显下调,其中,0~3 h期间,叶片中下降程度较根中更为明显,3 h以后则是根中的下降程度较叶更为明显(图6C)。镉处理后,在1.5 h时TrMYB1R1在根与叶的表达量均下降,但3 h时基因在叶片的表达量已上升,而根部还处于下降趋势,处理6 h才开始上升(图6D)。
与干旱、冷、热和镉处理总体抑制TrMYB1R1表达不同,NaCl处理后,叶片中的TrMYB1R1整体呈上调趋势,在处理1.5 h时,表达量虽有较小程度 地降低,但处理 3 、6 和 12 h 时表达量则持续上升,处理12 h时的表达量约为0 h的4倍;而根部的TrMYB1R1表达在早期则受到一定程度的抑制,后期与胁迫前的水平相近(图6E)。以上结果表明,白三叶TrMYB1R1基因对不同胁迫处理均有响应,但表达模式存在差异,且在根系和叶片中的表达水平差异明显。在干旱、镉、冷和热处理下,白三叶TrMYB1R1基因叶片和根系的表达整体受到抑制;而在NaCl处理下,该基因在叶片中被上调表达,在根中被下调表达。

图5 TrMYB1R1转录因子与其他植物同源氨基酸的系统进化树Figure 5 The phylogentic tree of TrMYB1R1 and other plant species
2.4 植物激素处理下白三叶TrMYB1R1基因的表达变化
TrMYB1R1对两种激素处理均有响应(图7),但响应模式有差异。ABA处理下,TrMYB1R1表达呈现先下降再上升的趋势,ABA处理前期抑制了该基因的表达,12 h后回升至正常水平(图7A);而不同的是,CTK处理后TrMYB1R1的表达量呈现先上升后下降的趋势,且表达水平差异显著,CTK诱导处理6 h时TrMYB1R1表达量达到最高,与0 h相比高出近10倍,表明CTK能诱导TrMYB1R1转录因子的表达(图7B)。
3 讨论
转录因子通过与DNA上的顺式作用元件结合,并通过与其他相关蛋白作用,在转录水平上调控目标基因在特定时空下、特定强度的表达,进而实现细胞内特定生理生化的调控。典型的转录因子在结构上通常包括3个功能区:DNA结合结构域、转录调控结构域以及核定位信号。其中,DNA结合结构域决定了转录因子与顺式作用元件之间结合的特异性,转录调控结构域实现转录因子的调控功能[14]。在长期的进化过程中,一些转录因子尽管功能可能完全不同,但它们的DNA结合结构域却高度保守。本研究从白三叶中克隆出1条MYB基因TrMYB1R1,并用生物信息学方法对TrMYB1R1进行分析与预测。结果表明TrMYB1R1 基因全长 1 403 bp,编码 297个氨基酸残基,含有一个MYB结构域,保守域形成3个α-螺旋,属于MYB-related蛋白;为亲水性蛋白,可能定位于细胞核中;进化分析表明该蛋白符合植物进化分类。研究也表明,磷酸化反应可在多种生物学途径中有着重要意义[15]。本研究发现,TrMYB1R1蛋白有多个磷酸化位点,这些位点的存在说明TrMYB1R1蛋白翻译后还需多种修饰调控,以调节蛋白表达水平。

据报道,MYB-related转录因子参与合成代谢物质[16-17]、光周期反应[17]等。GmMYB176参与大豆异黄酮的合成过程,沉默GmMYB176可降低异黄酮在根部的积累[16]。蒺藜苜蓿MYB2是一个调节花青素与原花青素(PA)合成的转录阻遏因子,过表达MYB2可以消除蒺藜苜蓿根毛和拟南芥种子中的花青素和原花色素的积累[17]。GmMYB173是在大豆中运用酵母单杂交筛选出的与GmFT2a(与光周期相关基因)顺式作用元件相结合的转录因子,实时荧光定量分析发现GmMYB173在长日照条件下表达量升高,推测其可减轻长日照对大豆生殖发育的影响[18]。本研究克隆得到的转录因子TrMYB1R1是否也参与了调节白三叶体内次生代谢的积累有待于后续进一步研究。
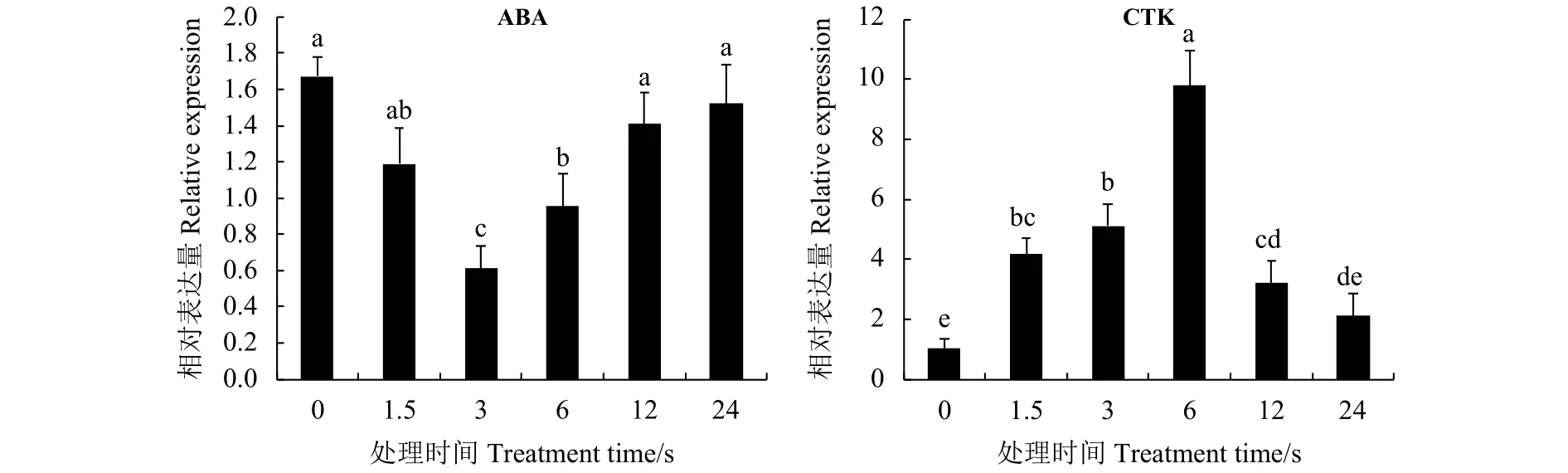
图7 激素处理条件下白三叶叶片TrMYB1R1的表达量Figure 7 The transcript level of TrMYB1R1 in response to ABA and CTK
MYB-related转录因子也参与植物非生物胁迫应答反应[18-20]。鹰嘴豆1R-MYB是从鹰嘴豆不同耐旱基因型中筛选出来的转录因子,该基因在干旱耐受型和敏感型之间表达差异较大,通过酵母双杂交分析发现其可调节鹰嘴豆抗旱应答机制[19]。水稻OsMYB48可被干旱、ABA强烈诱导表达;在过表达OsMYB48情况下,干旱胁迫可诱导內源ABA的积累,并调节一些ABA合成基因(OsNCED4、OsNCED5)、早期信号基因(OsPP2C68、OSRK1)和晚期响应基因(RAB21、OsLEA3、RAB16C和RAB16D)的表达[20]。GmMYB174基因在ABA和干旱处理下的表达量下调,在NaCl处理下表达量上调,表明其在不同胁迫下表达模式不同[21]。本研究对白三叶进行非生物胁迫处理,定量分析表明在PEG、镉、冷及热处理下,白三叶TrMYB1R1转录因子在根和叶中的表达受到抑制,且在镉、冷及热处理下所受到的抑制较PEG胁迫下强;而在NaCl处理下该基因受到诱导表达,表明该基因在不同胁迫处理下其表达模式有所不同。同时,胁迫处理下TrMYB1R1在根部与叶片的表达量相比较,可看出该基因在叶片中表达差异更明显,对胁迫处理更加敏感。在拟南芥(Arabidopsis thaliana)中研究表明MYB-related转录因子参与叶片毛状体形成[22],在叶片中表达更为活跃,这与本研究中TrMYB1R1在白三叶叶片中表达差异更明显的结果相一致。同时,本研究采用ABA和CTK处理白三叶,发现叶片中TrMYB1R1对这两种外源激素均有响应。在ABA处理下,TrMYB1R1表达下调,且在PEG处理下基因表达也下调(脱水或干旱常常诱导ABA浓度升高),表明TrMYB1R1在干旱胁迫下的调控可能属于负调控。在CTK处理下,TrMYB1R1在叶片中的表达被强烈诱导。据报道,CTK会诱导花青素合成途径中MYB基因的表达[23]。推测白三叶TrMYB1R1不仅参与非生物胁迫途径,还有可能参与花青素合成反应,但仍有待于进一步研究其作用机制。
本研究克隆了白三叶TrMYB1R1基因的编码序列,对基因序列的生物信息学分析以及实时荧光定量分析,表明该基因可能参与多种非生物胁迫应答机制及其他生物学反应途径,但要明确TrMYB1R1在白三叶中的功能及调控作用,仍需进一步研究。
