球形与粉状4A沸石的锌交换及气体吸附性能研究
2019-02-18贾艳艳崔杏雨程文萍李瑞丰
贾艳艳,崔杏雨,程文萍,李瑞丰
(太原理工大学 化学化工学院,山西 太原 030024)
沸石是一种由硅氧四面体和铝氧四面体通过共享氧原子连接而成的晶体微孔材料。沸石中阳离子的存在使沸石骨架结构呈现电中性(阳离子通常为Na+)[1]。Na+可以被其他阳离子所取代,进而改变沸石的孔道结构和性能[2]。由于微孔沸石大的比表面积、均匀的孔道、良好的阳离子交换性能以及优良的选择性,使得沸石常被用作吸附剂、阳离子交换剂以及催化剂[3]。通过离子交换可对沸石的酸性、孔道尺寸及表面性能进行改性修饰[4]。其中A沸石是微孔结构沸石中在吸附剂领域应用最广泛的一种沸石。
近年来,对A沸石的离子交换性能研究颇多,但大部分都局限于对粉体A沸石的研究。关莉莉等[5]用Li+及Ca2+交换A沸石制得不同交换度的样品来研究氮气和氩气的吸附分离,结果表明,交换之后的样品对氮氩分离能力明显优于NaA沸石。Nibou等[6]用不同的原料比合成了NaA、NaX沸石,并将合成的沸石进行锌离子交换,探索了在不同条件(如原始浓度、时间、固液比、pH以及温度条件)下得到的最佳实验条件,将此条件应用于处理含锌废水中得出NaA对锌的去除率为79.6%大于NaX对锌的去除率(68.3%)。离子交换的过程主要是受到溶液原始浓度、阴阳离子的性质、pH值以及沸石晶体结构因素的影响[7]。
工业应用中所用沸石大多数是粉末状的,难以与所作用的对象快速分离进而不容易达到循环利用的目的[8],所以对型体沸石的研究就十分必要。而球形A沸石相比于粉末A沸石,更适合应用于工业各个领域。本论文中研究了型体4A沸石的锌离子交换性能变化及其对气体的吸附分离性能,并与粉体4A沸石与锌离子交换性能研究及其对气体的吸附分离性能研究做了对比。
1 实验部分
1.1 4A沸石与锌的交换
原料型体4A沸石与粉体4A沸石均选自山西泰亨科技有限公司,其中型体4A沸石为球形颗粒,直径约3mm的无粘结剂4A分子筛产品。
将一定量的4A球形(或粉状)沸石加入到一定浓度的Zn(NO3)2·6H2O溶液中搅拌交换,测定上清液中钠离子浓度c(Na+),通过计算获得沸石的锌离子交换度。将交换后的不同交换度的固体样品洗涤、干燥、焙烧,最后得到球形(粉状)ZnNaA沸石。
将锌离子交换度为25.4%、41.2%的粉状4A沸石依次记为ZnNaA(25)-p、ZnNaA(41)-p。
将锌离子交换度为12.5%、20.3%、32.1%、45.6%的球形4A沸石依次记为ZnNaA(12)-g、ZnNaA(20)-g、ZnNaA(32)-g、ZnNaA(45)-g。
1.2 样品表征
X-射线衍射粉末仪(XRD)测定晶体的晶相结构,采用Cu靶射线,管电压40kV,管电流100mA,扫描速度为8°/min,扫描范围5~50°;扫描电子显微镜(SEM)用来观察样品的形貌以及粒径大小;NOVE 2100e物理吸附仪(美国康塔公司),探针分子为CO2,测定273K下的微孔体积及298K、100kPa下CO2、CO、CH4、N2的吸附等温线;PXSJ-216F型离子计测定溶液中钠离子的浓度。
1.3 交换度的计算
离子交换度的计算公式:
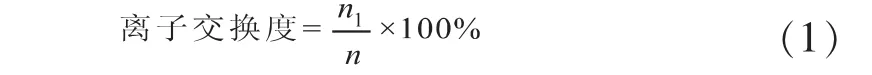
式中n1、n分别为交换下来的钠离子与沸石中原有的钠离子的物质的量。
2 结果及讨论
2.1 交换过程中实验条件的影响
2.1.1 交换时间的影响
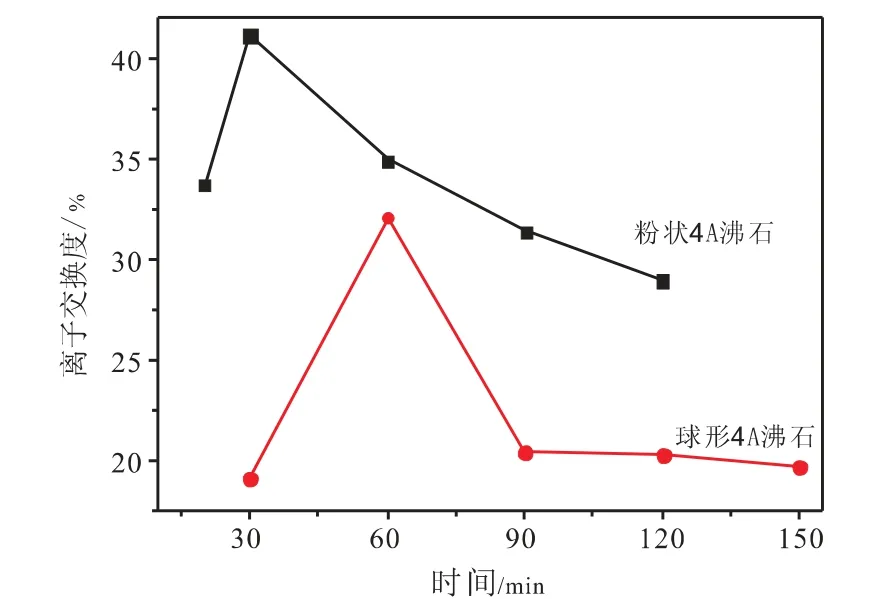
图1交换时间的影响
图1为球形4A沸石、粉状4A沸石与锌交换过程中交换时间对锌离子交换度的影响。其中,粉状4A沸石与球形4A沸石与锌离子交换条件为:初始浓度均为0.1mol/L,固液比均为0.1g/mL,温度均为298K,pH值均为6。从图中可以看出,随着交换时间的延长,粉状和球形4A沸石的锌离子交换度均呈现先上升后下降的趋势,在时间为30min时粉状4A沸石的锌离子交换度最大为41.15%,对于球形4A沸石而言,在时间为60min时钠离子交换度最大达到32.12%。
2.1.2固液比的影响
图2为球形4A沸石、粉状4A沸石与锌交换的固液比对锌离子交换度的影响。其中,粉状A沸石与球形A沸石的锌离子交换条件为:时间分别为30min与60min,初始浓度均为0.1mol/L,温度均为298K,pH值均为6。由图可知,粉状4A沸石的锌离子交换度随固液比的增加先上升后下降,在固液比为0.06g/mL时,锌离子交换度达到了59.8%。对于球形4A沸石与锌离子交换而言,在固液比为0.1g/mL时锌离子交换度达到最大为32.12%。在相同固液比下,粉状4A沸石的钠离子交换度大于球形4A沸石。
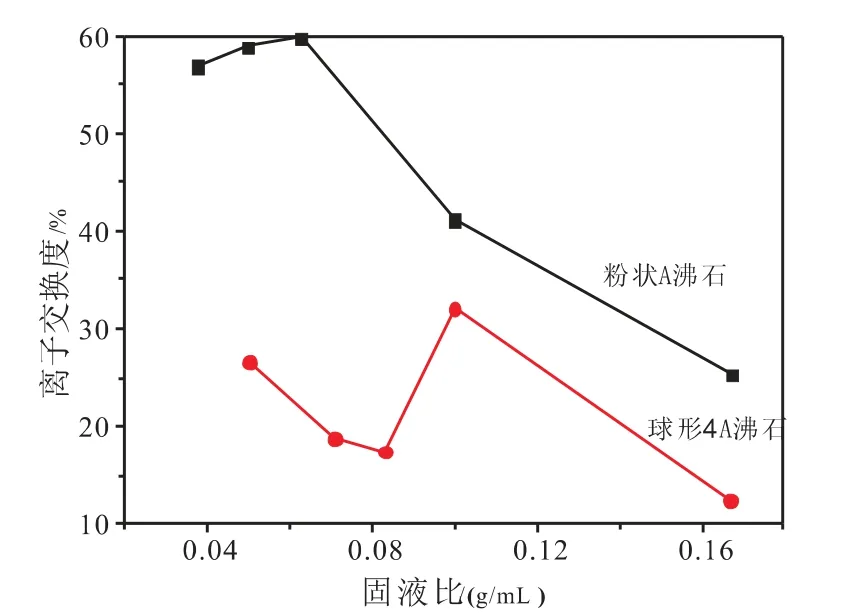
图2 固液比的影响
2.1.3原始浓度的影响

图3 原始浓度的影响
图3为锌离子交换球形4A沸石及粉状4A沸石过程中原始浓度对锌离子交换度的影响。其中,粉状4A沸石与球形4A沸石的锌离子交换条件为:时间分别为30min与60min,固液比均为0.1g/mL,温度均为298K,pH值均为6。由图可观察到,粉状4A沸石与球形4A沸石的锌离子交换度随原始浓度的增加呈现先上升后下降趋势,在原始浓度均为0.5mol/L时,粉状4A沸石的钠离子交换度大于球形4A沸石。
2.1.4 温度的影响
图4为球形4A沸石与粉状4A沸石与锌离子交换过程中温度对锌离子交换度的影响。其中,粉状A沸石与球形A沸石的锌离子交换条件为:时间分别为30min与60min,初始浓度均为0.1mol/L,固液比均为0.1g/mL,pH值均为6。由图可知,随温度的升高,粉状4A沸石的锌离子交换度变化不大,在温度为298K时,粉状4A沸石的锌离子交换度为41.15%,而球形4A沸石的锌离子交换度随温度的升高而下降,温度为298K时,球形4A沸石的锌离子交换度为32.12%,这说明沸石的离子交换过程是放热反应。

图4 温度的影响
综上所述,粉状4A沸石与锌离子交换的最大交换度为59.8%,球形4A沸石与锌离子交换的最大交换度为45.6%,小于粉状沸石的离子交换度。
2.2 XRD表征

图5 样品的XRD图
图5是交换度为45%的球形ZnNaA沸石的XRD图。由图可以看出,交换后的球形ZnNaA沸石与球形4A沸石相比峰强稍有降低,尤其是在10.3°处衍射峰强度降低明显,这表明锌离子交换到了沸石中,但整体的峰型保持不变,保留了4A沸石的晶体结构。
2.3 SEM表征
图6为球形4A沸石交换前后压碎样品的SEM图。从图中可以观察到,球形4A沸石分子筛(图6a)的表面形貌为细小的立方颗粒,球形4A沸石与锌离子交换之后(图6b)形貌并没有发生改变,表明沸石与锌离子交换之后没有破坏晶体形貌,保留了其原样。
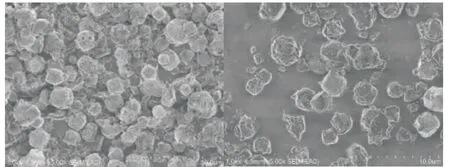
图6 样品的SEM图
2.4 273K-CO2吸附表征
用273K-CO2吸附等温线来测定孔径分布。图7、图8分别为球形4A沸石交换前后273K-CO2的吸附等温线及微孔孔径分布图,其孔径分布图是由NLDFT模型拟合所得。从图中可以看出,球形4A沸石的孔径主要分布在0.30~0.6nm,而交换之后的球形ZnNaA(45)沸石的孔径主要集中在0.55nm左右,还有少量的孔径在0.7nm,说明经锌离子交换后,球形4A沸石的微孔孔径变大,这是由于在锌离子交换过程中一个锌离子交换两个钠离子,因此锌离子交换后样品微孔孔径增大。用NLDFT模型计算交换前后沸石的微孔比表面积与微孔体积。球形4A沸石的微孔体积为0.11cm3/g,微孔比表面积为484m2/g。交换之后球形ZnNaA(45)沸石的微孔体积为0.15cm3/g,微孔比表面积540m2/g。锌离子与沸石中的钠离子交换后沸石的微孔孔径变大,微孔比表面积及微孔体积增加,这说明有一部分锌离子与沸石中的钠离子发生交换,锌离子交换到沸石孔道内。

图7样品在273K下的CO2吸附等温线

图8 样品的微孔孔径分布图
3 吸附性能研究
3.1 气体吸附性能研究
图9为不同交换度的球形ZnNaA沸石在298K下对CO2、CO、CH4、N2的吸附等温线图。从图中可以观察到:球形ZnNaA沸石对气体吸附容量的大小为CO2>CO>CH4>N2, 这 是 因 为CO2的 动 力 学 直 径(0.33nm)小,并且具有高的极化率(2.76×10-24cm3)和四极矩,故沸石对其有极高的吸附容量,提高了其吸附选择性;CO是极性分子,其固有的偶极矩使其与沸石中的阳离子之间具有较强的相互作用力,因此具有较高的吸附容量;CH4和N2都是非极性分子,但是由于CH4具有高的极化率(26×10-25cm3),因此其吸附容量高于具有四极矩的N2吸附容量[9,10]。

表1 298K、100kPa下不同交换度的球形ZnNaA沸石对不同气体的吸附量及分离因数
298K、100kPa下不同交换度球形ZnNaA沸石的气体吸附量与分离因数如表1所示。从表中可以看出,对于ZnNaA-g系列沸石而言,其对CO2、CO的吸附容量随锌离子交换度的增加而上升,对CH4及N2的吸附容量随锌离子交换度变化不大,并且对N2吸附容量总体低于4A沸石。由分离因数可知,ZnNaA-g系列沸石对气体的分离因数随交换度的增加总体上升。对ZnNaA(45)-g沸石而言,其对气体的分离因数较其他沸石呈总体上升趋势,且对CO2/N2分离因数最高达到了11.3。
3.2 球形与粉状沸石气体吸附性能的比较

表2 298K、100kPa下粉状ZnNaA沸石与球形ZnNaA沸石对不同气体的吸附量及分离因数
表2为298K、100kPa下同一交换度的粉状ZnNaA沸石与球形ZnNaA沸石对不同气体的吸附量的变化以及分离因数的比较。从表可以看出,同一交换度下ZnNaA(25)-p、ZnNaA(42)-p沸石对CO2、CO、CH4、N2的吸附容量虽大于ZnNaA(20)-g、ZnNaA(45)-g沸石,但ZnNaA(20)-g、ZnNaA(45)-g沸石对气体的分离选择性高于ZnNaA(25)-p、ZnNaA(42)-p沸石对气体的选择性。这说明在相同交换度下球形ZnNaA沸石对气体的吸附选择性稍高于粉状ZnNaA沸石对气体的吸附选择性。
4 结论
(1)根据锌离子交换度为45%的球形ZnNaA沸石的XRD、SEM、273K下的CO2吸附等温线表征,结果发现:锌离子交换后的球形沸石保留了A型沸石的晶体结构,同时交换之后球形沸石的形貌没有发生改变,但是球形沸石的孔径、比表面积、孔容均增大。
(2)298K、100kPa下不同锌离子交换度的球形ZnNaA沸石对气体吸附容量的大小为CO2>CO>CH4>N2。就分离因数而言,ZnNaA(45)-g沸石对CO2/N2分离因数最高达到了11.3。
(3)与粉状ZnNaA沸石相比,在相同交换度下球形ZnNaA沸石对气体的吸附选择性稍高于粉状ZnNaA沸石对气体的吸附选择性。
