直接球磨法制备铈基载氧体用于甲烷化学链重整制合成气性能研究
2019-02-18吕鹏刚马晓迅
李 波,张 浩,吕鹏刚,徐 龙,马晓迅
(西北大学化工学院,碳氢资源清洁利用国际科技合作基地,陕西省洁净煤转化工程技术研究中心,陕西 西安 710069)
化学链燃烧技术是一种高效、清洁的燃烧技术,它打破了传统的燃料燃烧方式,无需燃料与空气进行接触,在燃烧过程中由载氧体直接向燃料提供所需的氧;避免了燃料与空气的直接接触,根除了氮氧化物的产生,实现了二氧化碳的内捕集[1]。化学链重整技术是基于化学链燃烧技术的基础上提出的,由载氧体提供晶格氧来替代反应所需的分子氧,得到预期的目标产物合成气(H2+CO)。在化学链重整过程中通过控制晶格氧和燃料的比例,使燃料发生部分氧化生成CO和H2[2-6]。载氧体在两个反应器中循环使用,在燃料反应器中发生还原反应,为重整反应提供了所需的晶格氧,被还原的载氧体在空气反应器中发生氧化反应重新获得晶格氧。
在化学链重整过程中,载氧体的选择和制备至关重要。目前研究较多的载氧体主要为Ce、Fe、Zr、Co、La等金属的单一或混合氧化物,其制备方法主要为共沉淀法、浸渍法、水热法、溶胶-凝胶法、柠檬酸络合法等。曾良鹏等[7]采用水热法制备了Ce1-yCoyO2-δ载氧体用于甲烷化学链部分氧化重整,结果表明,水热法制备的Ce1-yCoyO2-δ载氧体形成了铈钴固溶体,增强了储氧能力以及体相晶格氧的释放速率,从而更容易使甲烷发生部分氧化反应,反应产物以CO和H2为主。于鹤等[8]采用共沉淀法制备了Ce-Fe-Zr-O复合载氧体,并将制备的Ce-Fe-Zr-O复合载氧体与焙烧后的MgO一起放入球磨机中球磨制得Ce-Fe-Zr-O/MgO粉末状载氧体,最后将Ce-Fe-Zr-O/MgO粉末状载氧体和水、黏结剂、润滑剂、增塑剂、解胶剂、消泡剂充分混合挤压成型,得到Ce-Fe-Zr-O/MgO整体型载氧体用于化学链部分氧化甲烷制合成气。结果表明整体型载氧体具有很高的循环稳定性,反应过程中合成气氢碳比(H2/CO)一直保持在2.0左右。赵坤等[9]采用燃烧法、微乳液法、共沉淀法和溶胶-凝胶四种方法制备了LaFeO3载氧体用于甲烷化学链重整制合成气,结果表明,燃烧法制备的载氧体反应性能最好,其氢碳比为2。Qin等[10]采用溶胶凝胶法制备了Fe2O3和1%Cu-Fe2O3(Cu负载质量分数为1%)载氧体用于甲烷化学链部分氧化重整制合成气,结果表明在700℃反应时,当Cu负载质量分数为1%时Fe2O3载氧体的甲烷转化率和氧化再生率比未负载Cu的Fe2O3载氧体分别提高了474%和485%。
球磨法是以金属氧化物或金属盐为原料,通过球磨机的高速转动使球磨罐中的玛瑙磨球对原料进行研磨和碰撞,制备得到实验所需的样品[11-12]。吴迪[12]等采用球磨法制备了La2O3和La3+掺杂TiO2光催化剂进行光催化降解实验,结果表明,当La2O3和La3+掺杂比例分别为0.5%和3%,球磨时间为4h,降解速率常数达到最大值分别为0.0467min-1和0.0643min-1。Zhan[13]等采用球磨法制备了铈基催化剂,结果表明,球磨法制备的铈基催化剂具有很高的比表面积(122m2/g)。与共沉淀法、溶胶-凝胶法、水热法等化学方法相比,球磨法具有制备工艺简单、易操作、可以连续生产等优点[12-13]。
魏永刚[14]、闫雨瑗[18]等人研究了不同铈铁比例对载氧体性能的影响,结果表明,Ce7Fe3Oδ载氧体在反应中表现出较好的部分氧化甲烷活性,为此本文选用Ce7Fe3Oδ载氧体作为后续实验的研究对象。
目前有关采用直接球磨法制备载氧体用于甲烷化学链重整的报道相对较少,为此本文采用直接球磨法制备了不同比例的铈铁铜复合载氧体,在气固相固定床催化反应装置上对载氧体的甲烷化学链重整反应特性进行了研究,并与共沉淀法制备的铈铁复合载氧体的反应特性进行了对比。
1 实验部分
1.1 实验试剂与反应原料
实验所用化学试剂、反应原料、规格及生产厂家如表1所示。

表1 实验所用化学试剂Table1 Experimental reagents
1.2 载氧体的制备
1.2.1 直接球磨法制备Ce7Fe3Oδ载氧体
采用直接球磨法制备Ce7Fe3Oδ载氧体,按不同比例称取一定量的硝酸铈(Ce(NO3)3·6H2O)和硝酸铁(Fe(NO3)3·9H2O),将称量好的硝酸盐置于干燥的球磨罐中,在行星式球磨机(QM3SP04,南京驰顺科技发展有限公司)中球磨30min,球磨机转速为500r/min。将球磨后的样品移入坩埚中,放入马弗炉中焙烧,从室温升到800℃,升温速率3℃/min,在800℃下焙烧6h,然后取出压片,筛分成20~40目,得到实验样品。
1.2.2 直接球磨法制备Ce7Fe3CuxOδ载氧体
采用直接球磨法制备Ce7Fe3CuxOδ(x=0、0.1、0.5、1)载氧体,铈、铁、铜物质的量比例分别为7:3、7:3:0.1、7:3:0.5、7:3:1,分别用Ce7Fe3Oδ、Ce7Fe3Cu0.1Oδ、Ce7Fe3Cu0.5Oδ、Ce7Fe3Cu1Oδ表示。按不同比例称取一定量的硝酸铈、硝酸铁、硝酸铜(Cu(NO3)2·3H2O),将称量好的硝酸盐置于干燥的球磨罐中,其它制备过程和Ce7Fe3Oδ载氧体的制备过程完全相同,具体制备过程参照1.2.1。
1.2.3 共沉淀法制备Ce7Fe3Oδ载氧体
按比例称取一定量的硝酸铈和硝酸铁(nCe:nFe=7:3),将其溶于100mL的去离子水中,在30℃的恒温磁力搅拌器中搅拌,同时用蠕动泵将1mol/L的碳酸铵溶液缓慢滴加至硝酸铁和硝酸铈的混合溶液中,使金属离子沉淀,调节pH值9~10时停止滴加,继续搅拌2h后,静置陈化12h,进行抽滤,沉淀经过水洗、醇洗数次后放入烘箱内干燥,110℃干燥12h。干燥后的固体放入马弗炉中焙烧,从室温升到800℃,升温速率3℃/min,在800℃下焙烧6h,然后取出压片,筛分成20~40目,得到实验样品。
1.3 载氧体的表征
1.3.1 程序升温还原(H2-TPR)表征
载氧体的还原性能使用MicrotracBEL公司生产的BELCAT II全自动化学吸附仪进行测定,反应前载氧体在He气氛下进行预处理,温度范围100℃~200℃,升温速率5℃/min,在200℃停留30min,然后降温至100℃待稳定后开始实验。实验过程在φ(H2)为5%的H2/Ar混合气气流中进行,气体流量30mL/min,反应温度从100℃升到950℃,升温速率为15℃/min,载氧体质量均为50mg,在反应过程中系统软件会自动记录氢气的变换曲线和数据。
1.3.2 X射线衍射(XRD)表征
使用日本理学Smart Lab X射线衍射仪对新鲜的载氧体和反应后的载氧体进行物相分析。测定条件为:Cu靶辐射,管电压40kV,管电流40mA,扫描速度为10°/min,扫描范围2θ=5~90°。
1.4 载氧体的活性评价
载氧体活性评价实验在加压固定床气固相催化反应装置(天津鹏翔科技有限公司)上进行,反应时气体总流量为100mL/min,其中CH4流量为5mL/min,N2流量为95mL/min。取1.3g载氧体样品置于石英管中,装入气固相固定床催化反应装置,反应前通入N2,以10℃/min的升温速率从室温升至200℃,恒温保持30min后,继续以20℃/min的升温速率升至反应温度850℃,温度稳定之后通入CH4进行反应。反应后的气体由红外气体分析仪(XLZ-1090,北京西林子科技发展有限公司)进行实时在线检测。
1.5 载氧体的恒温氧化还原循环实验
循环实验条件为:取1.3g载氧体样品置于石英管中,装入气固相固定床催化反应装置,反应时气体总流量为100mL/min,其中CH4流量为5mL/min,N2流量为95mL/min。反应前通入N2,以10℃/min的升温速率从室温升至200℃,恒温保持30min后,继续以20℃/min的升温速率升至反应温度850℃,温度稳定之后通入CH4进行反应。反应18min后关闭CH4继续用N2(95mL/min)吹扫20min,吹扫完成切换CH4气路通入CO2(5 mL/min)进行氧化再生,氧化再生完成后关闭CO2继续用N2吹扫20min。如此反复切换CH4与CO2,可实现载氧体的循环实验。
2 结果与讨论
2.1 不同制备方法对Ce7Fe3Oδ载氧体性能的影响
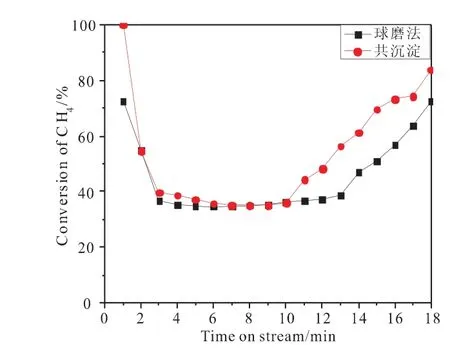
图1 850℃下CH4转化率随时间的变化Fig.1 Effect of reaction time on CH 4 conversion at 850℃
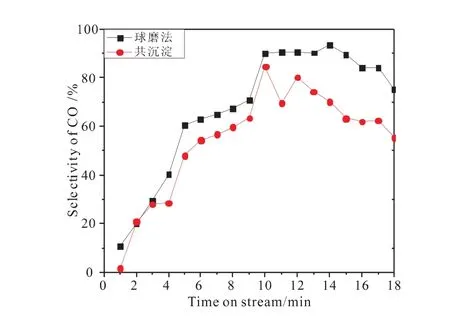
图2 850℃下CO选择性随时间的变化Fig.2 Effect of reaction time on CO selectivity at 850℃
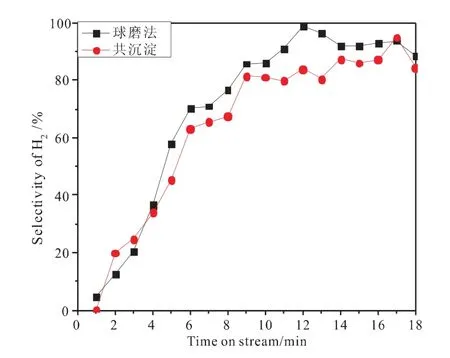
图3 850℃下H2选择性随时间的变化Fig.3 Effect of reaction time on H 2 selectivity at 850℃
图1~图3分别为不同制备方法制备的Ce7Fe3Oδ载氧体在850℃下恒温反应的CH4转化率、CO选择性、H2选择性随时间的变化曲线。
图1是850℃下共沉淀和直接球磨法制备的Ce7Fe3Oδ载氧体CH4转化率随时间的变化。由图可知,共沉淀和直接球磨法制备的载氧体CH4转化率的变化趋势基本一致,反应一开始CH4转化率迅速下降,反应3min时降到最低40%,稳定一段时间后缓慢上升,反应10min后共沉淀制备载氧体的CH4转化率高于直接球磨法制备载氧体的CH4转化率。对比图1、图2、图3我们可以发现,在反应3~10min时,两种方法制备的载氧体的CH4转化率基本重合,而直接球磨法制备载氧体的H2选择性和CO选择性一直高于共沉淀法,这说明和共沉淀法相比直接球磨法制备的载氧体具有较好的反应活性。反应10min后,共沉淀制备的载氧体的CH4转化率高于直接球磨法制备的,而H2选择性和CO选择性却低于直接球磨法制备的载氧体,这是由于随着反应的进行,体相晶格氧的消耗,没有新鲜的晶格氧补充,载氧体与CH4反应时,CH4一部分裂解生成积炭C*和H*[15-16]。由此可知,和共沉淀相比直接球磨法制备的载氧体有较好的反应活性和较高的储氧能力。直接球磨法制备载氧体的CO选择性最大达到90%,H2选择性最大达到100%,和共沉淀法相比均提高了20%,后续实验采用直接球磨法制备所需载氧体。
2.2 添加Cu对直接球磨法制备载氧体性能的影响
图4~图6分别为添加Cu后不同铈铁铜比例的复合载氧体在850℃下恒温反应CH4转化率、CO选择性、H2选择性随时间的变化曲线。

图4 850℃下CH4转化率随时间的变化Fig.4 Effect of reaction time on CH 4 conversion at 850℃
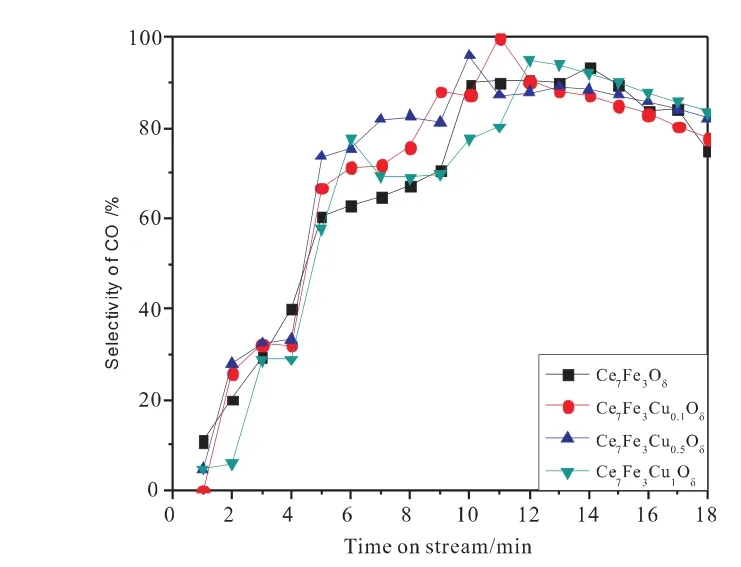
图5 850℃下CO选择性随时间的变化Fig.5 Effect of reaction time on CO selectivity at 850℃

图6 850℃下H2选择性随时间的变化Fig.6 Effect of reaction time on H 2 selectivity of at 850℃
李国祥等[17]认为,过渡金属Cu的氧化物具有较高的反应活性和较大的载氧能力,当Cu按一定比例加入载氧体时,可以提高载氧体的反应活性,这种现象称之为“协同效应”。由图中可以看到,添加Cu以后载氧体CH4的转化率趋势基本一致,反应开始2min时,Ce7Fe3Cu0.1Oδ、Ce7Fe3Cu0.5Oδ、Ce7Fe3Cu1Oδ载氧体CH4的转化率迅速下降至最低点,分别是52%、48%、40%。稳定4min后缓慢上升,反应至11min时CH4转化率达到最大80%,对比Ce7Fe3Oδ载氧体,添加Cu后CH4的转化率提高了30%左右。这是因为,添加Cu不仅可以为载氧体提供反应的活性位点,同时也可以产生氧空位,促进离子扩散,进一步降低CH4反应所需的活化能,提高CH4转化率[10]。添加Cu之后,Ce7Fe3Cu0.1Oδ、Ce7Fe3Cu0.5Oδ、Ce7Fe3Cu1Oδ三 种 载 氧 体CO选择性在反应开始5min时分别达70%、75%、68%左右,对比Ce7Fe3Oδ载氧体CO选择性分别提高了10%、15%、8%左右。添加Cu之后,四种载氧体H2选择性的变化趋势基本一致。由图可知,添加Cu之后载氧体的体相晶格氧的释放速率得到提高,CH4转化率、CO选择性均得到提高。对比CH4转化率、CO选择性,后续实验选择Ce7Fe3Cu0.5Oδ作为研究对象。
2.3 直接球磨法制备Ce7Fe3Cu0.5Oδ载氧体的循环反应性能研究
图7~图10分别为直接球磨法制备Ce7Fe3Cu0.5Oδ载氧体在850℃恒温下进行5次循环反应的CH4转化率、CO选择性、H2选择性、n(H2)/n(CO)随时间的变化曲线。
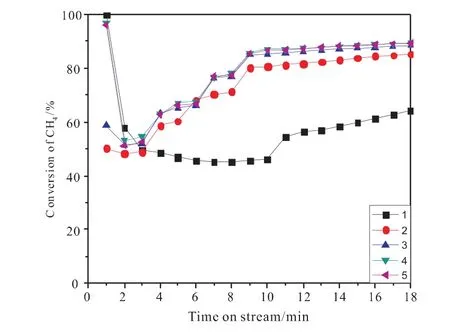
图7 850℃下CH4转化率随时间的变化Fig.7 Effect of reaction time on CH 4 conversion at 850℃
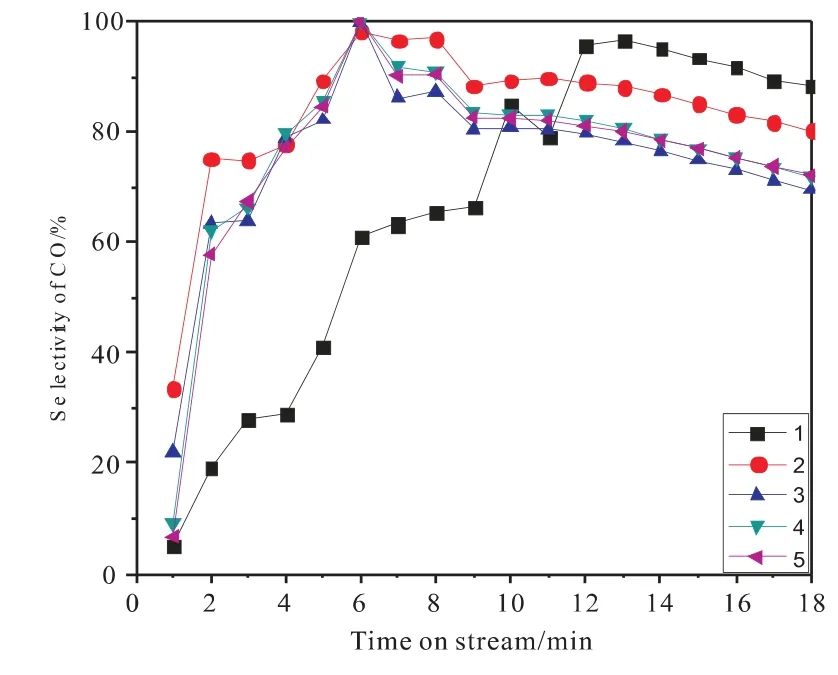
图8 850℃下CO选择性随时间的变化Fig.8 Effect of reaction time on CO selectivity at 850℃
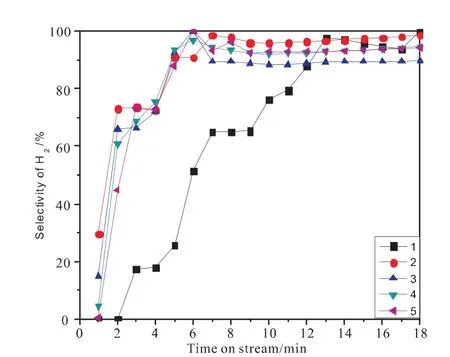
图9 850℃下H2选择性随时间的变化Fig.9 Effect of reaction time on H 2 selectivity at 850℃

图10 850℃下n(H2)/n(CO)随时间的变化Fig.10 Effect of reaction time on H 2/CO molar ratio at 850℃
从图中可以看到,在5次循环反应中,除了第1次其他4次的变化趋势基本一致,特别是第3、4、5次表现出了很高的重复性。对比CH4转化率、CO选择性、H2选择性,可以发现,第2、3、4、5次循环时在反应开始2min后,CH4转化率很快降低到最低点50%左右,随即又缓慢上升,而第一次循环CH4转化率降到最低点后,在最低点稳定7min左右才开始缓慢上升。从图8、9中可知,与第1次循环相比,其他4次循环CO选择性、H2选择性在反应开始后迅速上升,在反应6min时达到最大值100%,随后缓慢降低,到反应结束一直保持很高的选择性分别为80%~90%、90%~100%。与第1次循环相比提高了20%左右。对比图7、8、9可知,与第1次循环相比,其他4次循环载氧体晶格氧的释放速度明显提高。由图10可知,在反应前的8min中,n(H2)/n(CO)值接近于2,8min之后n(H2)/n(CO)值开始大于2,这是因为部分CH4裂解生成了氢气,对比图7可知,在反应后期CH4转化率的升高有一部分是CH4裂解造成的。
2.4 载氧体的XRD表征
图11、12分别为直接球磨法和共沉淀法制备的Ce7Fe3Oδ载氧体反应前后的XRD图。图13、14分别为直接球磨法制备不同铈铁铜比例载氧体反应前后XRD图。
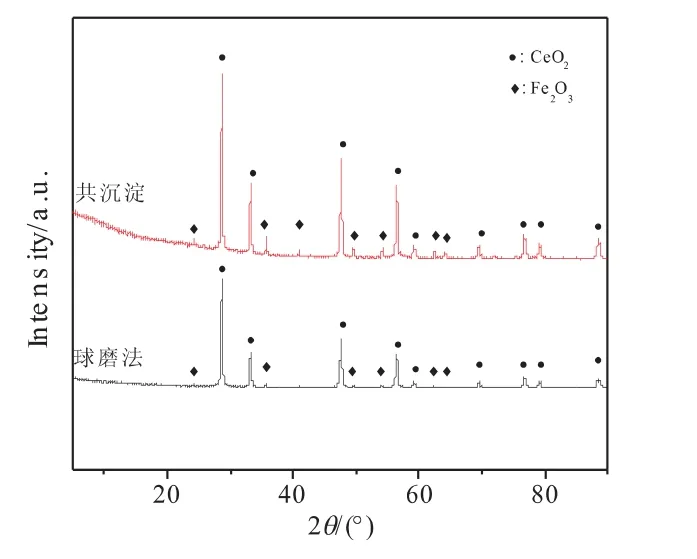
图11不同制备方法制备的Ce7Fe3Oδ载氧体反应前的XRD图Fig.11 XRD patterns of Ce7Fe3Oδoxygen carriers prepared by different methods before reaction
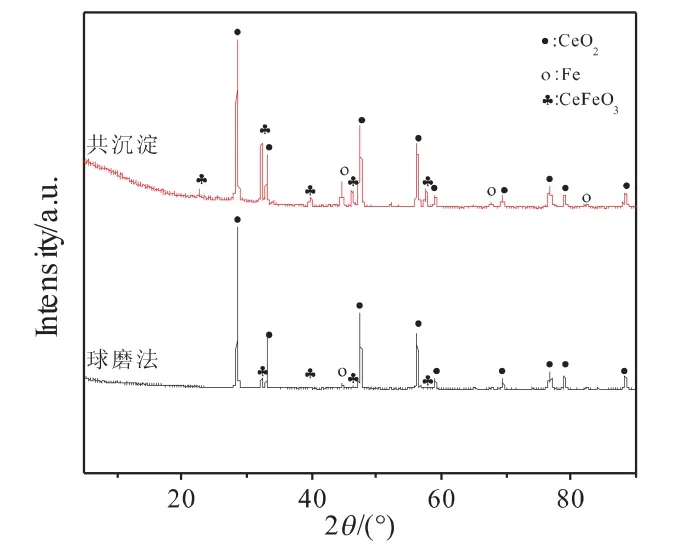
图12不同制备方法制备的Ce7Fe3Oδ载氧体反应后的XRD图Fig.12 XRD patternsof Ce7Fe3Oδoxygen carriers prepared by different methodsafter reaction
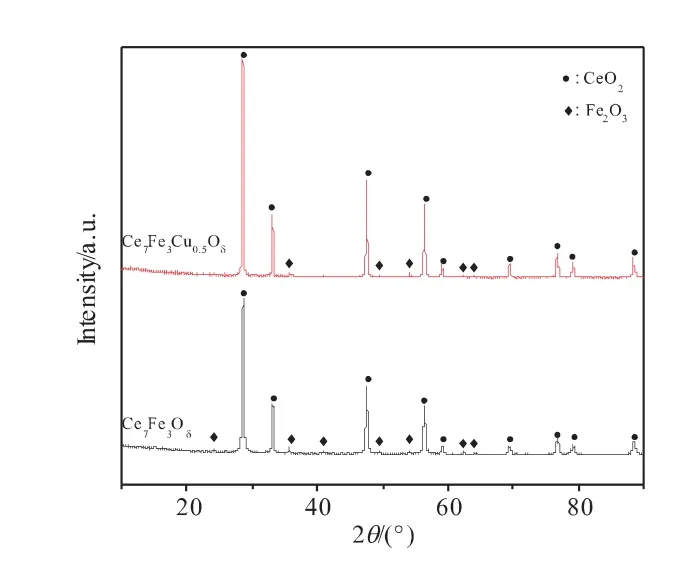
图13 直接球磨法制备载氧体反应前的XRD图Fig.13 XRD patterns of oxygen carriersprepared by direct ball milling before reaction
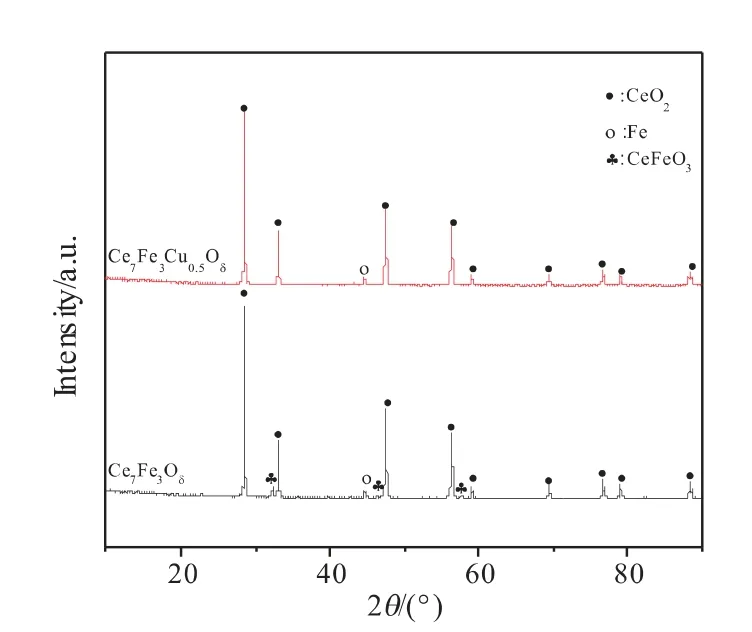
图14 直接球磨法制备载氧体反应后的XRD图Fig.14 XRD patterns of oxygen carriers prepared bydirect ball milling after reaction
由图11、12可以看到,不同方法制备的Ce7Fe3Oδ载氧体反应前都含有CeO2和Fe2O3的衍射峰,反应后均出现了CeO2、Fe和CeFeO3固溶体的主要特征峰。由此可知,不同制备方法对载氧体物相的影响不大。由图13、图14可知,反应后Ce7Fe3Oδ载氧体的XRD图中没有检测到Fe2O3的衍射峰,而是检测到单质Fe的衍射峰和固溶体CeFeO3的衍射峰,对比反应前的XRD图,由图14可以看到反应后样品中CeO2衍射峰的峰强度增大,峰宽变窄。代小平等[18]认为,CeO2与CH4反应时体相晶格,氧不断地向表面移动,形成了大量的氧空位,掺杂的Fe3+取代Ce4+进入氧化铈晶格,从而形成CeFeO3固溶体。CeFeO3固溶体的构型属于ABO3型钙钛矿氧化物,这种构型具有更加显著的储氧能力和氧迁移能力[18]。CeFeO3固溶体的形成会产生一些易移动的氧或键能较弱的体相晶格氧,加快了体相晶格氧的释放速率,当体相晶格氧的释放速率足够快,会加快CO和H2的生成,同时抑制积炭的产生[16]。由图14可知,Ce7Fe3Cu0.5Oδ载氧体在反应后没有检测到CeFeO3固溶体,这是因为添加Cu之后载氧体中晶格氧释放的更充分,进而使CeFeO3固溶体被还原为单质Fe和CeO2[19]。对比图13、14可知,Ce7Fe3Cu0.5Oδ(wCu=2.7%)载氧体反应前后均没有检测到单质Cu或CuO的晶相,这是因为Cu负载量相对较少,在载氧体的制备过程中,Cu均匀分散在铈铁复合载氧体中[10]。
2.5 载氧体的H2-TPR表征
图15是载氧体的H2-TPR图。由图15可知,共沉淀法和直接球磨法制备Ce7Fe3Oδ载氧体还原峰的出峰温度可以划分成四个温度段,分别记做Ⅰ(400~550℃)、Ⅱ(550~650℃)、Ⅲ(650~800℃)和Ⅳ(800~900℃),Ⅰ温度段归属为Fe2O3被还原为Fe3O4,Ⅱ温度段归属为表面CeO2的还原和Fe3O4被还原为FeO,Ⅲ温度段归属为CeO2体相晶格氧被还原和FeO被还原为Fe,Ⅳ温度段归属为深层CeO2和Fe2O3的还原。和共沉淀法相比,直接球磨法制备CeFeO3载氧体的四个还原峰温度段均向低温段移动,载氧体中的氧化物更容易被还原,对比图2、图3可知,这也是直接球磨法制备载氧体在反应后期H2选择性和CO选择性高于共沉淀法的原因。
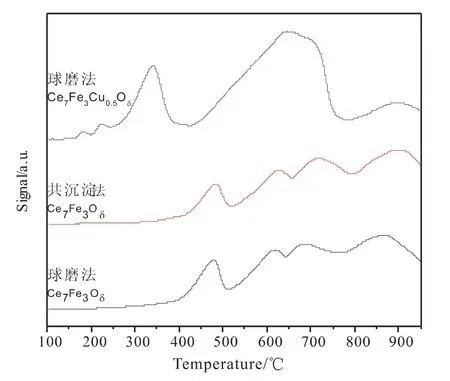
图15 载氧体的H2-TPR图Fig.15 H 2-TPR profiles of oxygen carriers
直接球磨法制备Ce7Fe3Cu0.5Oδ载氧体还原峰的出峰温度段也可以划分成四个温度段,Ⅰ(150~250℃)、Ⅱ(300~400℃)、Ⅲ(400~750℃)和Ⅳ(大于800℃)。Ⅰ温度段归属为表面小颗粒CuO的还原和中型CuO的还原,Ⅱ温度段归属为体相CuO的还原、Fe2O3被还原为Fe3O4、Fe3O4被还原为FeO和表面CeO2的还原,Ⅲ温度段归属为CeO2体相晶格氧被还原和FeO被还原为Fe,Ⅳ温度段归属为深层CeO2和Fe2O3的还原。一般来讲,还原峰的峰形和峰温反映了样品的组成和活性组分之间的协同作用,由图15可知,添加Cu后载氧体还原峰的出峰温度段明显有所降低,还原峰面积变大,这是因为Cu的掺杂提高了载氧体的载氧能力,降低了CH4活化的能垒,促进载氧体表面氧空位的形成,在CH4活化过程中,表面上吸附的CHx自由基与Fe2O3中的氧原子发生反应形成氧空位[10],掺杂的Fe3+取代Ce4+进入氧化铈晶格从而形成CeFeO3固溶体,CeFeO3固溶体的形成有助于载氧体还原峰温度的降低[20]。
3结论
对共沉淀法和直接球磨法制备的Ce7Fe3Oδ载氧体进行活性评价,结果发现直接球磨法制备的载氧体有很好的反应活性,其CO选择性达到最大90%。与共沉淀法相比,其CO选择性提高了20%。对添加Cu的载氧体进行活性评价,结果证明,添加Cu之后载氧体的体相晶格氧的释放速率得到提高,CH4转化率、CO选择性均得到提高;其中,直接球磨法制备的Ce7Fe3Cu0.5Oδ载氧体表现出较好的反应活性,添加Cu之后其CO选择性提高了15%。经五次循环反应后Ce7Fe3Cu0.5Oδ载氧体一直保持较好的循环特性,其CO平均选择性一直稳定在80%左右。
