水芹中芹菜素的提取纯化与抗氧化活性研究
2019-02-18黄志强吴娜梅唐明明孙汉巨李延红何述栋刘和平郜四羊
黄志强,吴娜梅,唐明明,孙汉巨,李延红,何述栋,刘和平,郜四羊
(1.合肥工业大学食品与生物工程学院,安徽合肥 230009;2.安徽四平食品开发有限责任公司,安徽铜陵 244000)
芹菜素,又叫芹黄素,是天然存在的一种黄酮类化合物,有“植物雌激素”之称,广泛存在于多种水果、蔬菜、豆类和茶叶中,其中芹菜含量最高。芹菜素的化学名称为5,7,4'-三羟基黄酮(5,7,4'-trihydroxyflavone),其4',5,7位置的3个羟基和C2,C3之间的双键决定了其独特的生理学效应和生物学特性。芹菜素的分子式为C15H10O6,分子量为270,不溶于水,易溶于乙醇、二甲基亚砜(DMSO)。纯品呈浅黄或黄绿色,是天然的抗氧化剂,有降血压和舒张血管、预防动脉粥样硬化、抑制肿瘤等作用[1]。
水芹(Oenanthe javanica),为伞形科草本植物,又名水英、野芹菜等[2]。其营养丰富,含有多种人体不可缺少的营养物质,如黄酮、多糖、矿物质及挥发油类,具有良好的食用价值[3]。同时,水芹在临床对高血压病、高脂血症、心脑血管疾病、乙型肝炎具有防治作用。有研究报道,水芹中黄酮含量很高,但有关水芹中芹菜素的报道较少。试验对水芹黄酮的提取进行了优化研究,并对芹菜素的提取纯化、鉴定及其抗氧化性进行了初步研究,旨在为水芹功能成分分析和深加工提供理论依据。
1 材料与方法
1.1 原料与试剂
水芹,桐城市牯牛背农业开发有限公司提供;无水乙醇(分析纯)、硝酸铝、亚硝酸钠、氢氧化钠(粉状)、芦丁标准品、X-5型大孔吸附树脂、AB-8型大孔吸附树脂、HP-20型大孔吸附树脂、磷酸(优级纯)、甲醇(色谱纯);芹菜素标准品,上海源叶生物科技有限公司提供;浓盐酸、去离子水。
1.2 仪器及设备
722E型分光光度计,上海光谱仪器有限公司产品;HH-2型数显恒温水浴锅,江苏金坛市荣华仪器制造有限公司产品;FA2004型电子分析天平,上海精科天平有限公司产品;BT-100型恒流泵,上海沪西分析仪器厂有限公司产品;85-2型恒温磁力搅拌器,金坛市城东新瑞仪器厂产品;DHG-9070A型电热恒温干燥箱,上海跃进医疗仪器厂产品;SHZ-D型循环水式真空泵,巩义市予华仪器有限责任公司产品;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂产品;LGJ-12型冷冻干燥机,北京松源华兴科技发展有限公司产品;SQW-40DⅡ型超微粉碎机,山东三清易辰有限公司产品;层析柱,上海厦美生化科技发展有限公司产品;E2695型制备液相色谱仪,美国WATERS有限公司产品;质谱仪,美国WATERS有限公司产品。
1.3 芹菜素的提取及纯化
1.3.1 工艺流程
水芹→清洗→切碎→冷冻干燥→超微粉碎→水浴提取→树脂吸附→乙醇洗脱→旋蒸→冷冻干燥→制备液相分离。
1.3.2 操作要点
(1)清洗。用蒸馏水清洗水芹的叶和茎,除去水芹叶、茎中肉眼可见的杂质。
(2)切碎。用洁净的刀将水芹叶、茎切成指甲大小的碎片。
(3) 冷冻干燥。在-60℃,3~10 Pa条件下,将水芹叶、茎碎片进行冷冻干燥,使水分含量≤0.5%。
(4)超微粉碎。采用偏振式超微粉碎机对干燥后的水芹进行超微粉碎,粉碎时间15 min。
(5)水浴提取。用乙醇溶液浸提,选用不同梯度的料液比、乙醇体积分数、提取温度和提取时间进行浸提。
(6)树脂吸附。按吸附及洗脱操作条件,将提取液加入层析柱中,吸附流速2.5 mL/min,平衡时间3 h。因黄酮被AB-8型大孔树脂吸附,而其他糖类、蛋白等成分不被树脂吸附,采用去离子水洗脱树脂,至流出液完全透明为止。
(7)乙醇洗脱。用90%乙醇溶液洗脱大孔树脂,至流出液为无色为止,收集洗脱液。
(8) 旋转蒸发。在温度40℃,真空度≥4 kPa条件下,采用旋转蒸发器,将洗脱液进行真空浓缩,至液体至原体积的1/3为止。
(9) 冷冻干燥。在-60℃,3~10 MPa条件下,将浓缩液进一步冷冻干燥,使水分含量≤0.5%,得到黄酮粉末。
1.4 试验方法
1.4.1 水芹中粗黄酮含量标准曲线的确定及其含量测定
粗黄酮含量的测定采用硝酸铝-亚硝酸钠比色法,以芦丁为标准品在510.0 nm处进行比色测定,然后,以吸光度为纵坐标,芦丁质量浓度为横坐标,绘制标准曲线,回归方程为[4-5]:

式中:X——芦丁质量浓度,mg/mL;
Y——吸光度A。
水芹粗黄酮的提取采用水浴法提取[6]。利用标准曲线计算样品粗黄酮总量,根据公式(1)计算提取物粗黄酮得率。

式中:Y——标准曲线上对应的吸光度;
M——所用原料的质量,g。
1.4.2 水芹中粗黄酮提取的单因素研究[7-9]
(1) 乙醇体积分数对水芹中粗黄酮提取的影响。称取0.5 g水芹粉于置5个20 mL烧杯内,分别加入15 mL体积分数为60%,70%,80%,90%,100%的乙醇为提取剂,在70℃条件下回流提取4 h,计算粗黄酮得率,确定较适宜的乙醇体积分数。
(2)提取温度对水芹中粗黄酮提取的影响。称取0.5 g水芹粉置于5个20 mL烧杯内,加入80%乙醇15 mL为提取剂,在提取温度分别为50,60,70,80,90℃条件下回流提取4 h,计算粗黄酮得率,确定较适宜的提取温度。
(3)提取时间对水芹中粗黄酮提取的影响。称取0.5 g水芹粉于5个20 mL烧杯内,加入80%乙醇15 mL作为提取剂,在70℃条件下回流提取2,3,4,5,6 h,计算粗黄酮得率,确定较适宜的提取时间。
(4)料液比对水芹中粗黄酮提取的影响。称取0.5 g水芹粉置于7个50 mL烧杯内,以80%的乙醇为提取剂,其料液比为1∶10,1∶15,1∶20,1∶25, 1∶30,1∶35,1∶40,在70℃条件下回流4 h,计算粗黄酮得率,确定较适宜的料液比。
1.4.3 水芹中粗黄酮的提取工艺优化
考虑到不同提取因素间的相互作用,在单因素试验基础上,以乙醇体积分数、提取温度、提取时间和料液比为4个主要因素,进行四因素三水平L9(34)正交试验,确定水芹中粗黄酮的最佳提取工艺。
1.4.4 大孔吸附树脂纯化水芹粗黄酮[10-12]
(1) 大孔树脂的预处理。将 AB-8,X-5和HP-20型这3种大孔吸附树脂分别用90%乙醇浸泡24 h,同时不停搅拌,使大孔吸附树脂和乙醇充分接触,完成后用蒸馏水洗至无醇味;然后再用5%的盐酸溶液浸泡4 h,用蒸馏水洗至pH值为中性;最后,用5%的氢氧化钠溶液浸泡4 h,用蒸馏水洗至pH值为中性,备用[13]。
(2)大孔吸附树脂的静态吸附和静态解析试验[14]。准确称取预处理过的大孔吸附树脂(AB-8,X-5和HP-20型) 各3 g,置于250 mL锥形瓶中,加入黄酮提取液60 mL,恒温(25℃) 下振荡24 h至吸附平衡,取出后再次过滤,在波长510 nm处测定吸光度,根据公式(1)计算黄酮得率。用蒸馏水将吸附饱和的大孔吸附树脂洗至洗脱液无色,再次过滤,并且吸干表面水分,加入90%乙醇30 mL,于室温下振荡12 h,将树脂滤出,于波长510 nm处测定吸光度,根据公式(1)计算黄酮得率,并根据公式(2)计算吸附率,公式(3)计算解析率。

式中:C0——初始质量浓度,mg/mL;
CV——剩余质量浓度,mg/mL;
Cd——解析液质量浓度,mg/mL;
V1——解析液体积,mL;
V——溶液体积,mL。
(3) 大孔吸附树脂对粗黄酮纯化[15-18]。采用湿法装柱,用3 BV去离子水将柱子压实,然后将粗黄酮提取液以2 mL/min的流速上柱吸附,富集15 min后,再用去离子水洗至上层液呈无色,再用90%的乙醇洗脱,收集洗脱液直至洗脱液为无色。将收集到的液体进行浓缩,再用冷冻干燥机进行干燥,制得粗黄酮备用。
1.4.5 制备型液相色谱制备芹菜素
精确称量20 mg粗黄酮样品于20 mL小烧杯中,再加入10 mL甲醇,超声溶解10 min,取出后将溶液过0.22μm膜,备用。其中,制备型液相色谱条件设置为:Galaksil EP-C18M型色谱柱(20 mm×250 mm,平均粒径10μm);流动相:乙腈-0.2%磷酸水溶液(35∶65,V∶V),流动相流速5 mL/min,检测波长345 nm,柱温25℃,进样量5 mL[19-20]。
1.4.6 分析型高效液相色谱验证芹菜素
样品制备方法同上,高效液相色谱条件设置为:SepaxGP-C18型色谱柱(250 mm×4.6 mm,平均粒径5μm);流动相:乙腈-0.2%磷酸水溶液(35∶65,V∶V),流动相流速1.0 mL/min,检测波长345 nm,柱温30℃,进样量20 L[21]。
1.4.7 质谱分析
采用四级杆飞行时间质谱仪对利用制备型液相色谱仪制得的芹菜素单体进行MS/MS分析,且MS/MS条件为:ESI离子源、电喷雾离子化正离子采集模式,扫描范围50~500 m/z,毛细管电压3 500 V,雾化气压40.0 psi,干燥温度310℃,干燥气流速度9 mL/min[22]。
1.4.8 抗氧化活性研究
(1) 清除DPPH自由基(DPPH·) 的能力。精确吸取芹菜素粗提物及单体样品溶液(质量浓度梯度为20,30,40,50,60 g/mL) 各 2 mL,分别与2 mL浓度为2×10-4mol/L的DPPH无水乙醇溶液混合,充分摇匀后放置30 min。以2 mL蒸馏水与无水乙醇的混合溶液为参比,于波长517 nm处测定吸光度,记为A1;精确吸取样品溶液各2 mL分别与2 mL蒸馏水混合均匀,以蒸馏水为参比,于波长517 nm处测定吸光度,记为A2;精确吸取2 mL浓度为2×10-4mol/L DPPH无水乙醇溶液与2 mL蒸馏水混合均匀后,以2 mL蒸馏水与2 mL无水乙醇的混合溶液为参比,于波长517 nm处测定吸光度,记为A0。以上吸光度均各测3次[23]。以VC为阳性对照,根据公式(4) 计算清除率:

(2) 清除羟基自由基(·OH) 的能力。精确吸取芹菜素粗提物及单体样品溶液(质量浓度梯度为2,4,6,8,10 g/mL) 各1 mL,依次加入1 mL 9 mmol/L FeSO4溶液、1 mL 9 mmol/L水杨酸乙醇溶液和1 mL 9 mmol/LH2O2,充分摇匀,于37℃水浴下反应30 min,对同样浓度的VC作同样处理作为阳性对照,以蒸馏水为参比,于波长510 nm处测定吸光度,记为A1;以蒸馏水代替样品作为待测溶液,于波长510 nm处测定吸光度,记为A0;以蒸馏水代替FeSO4,1 mL 9mmol/L水杨酸和1 mL 9 mmol/L H2O2溶液,于波长510 nm处测定吸光度,记为A2。以上吸光度均各测3次[24]。根据公式(5) 计算清除率:
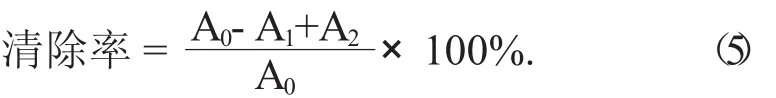
(3) 清除超氧阴离子(O2-·) 的能力。取25℃下预热过pH值8.2,浓度50 mmol/L Tris-HCl缓冲溶液2.25 mL,置于10 mL试管中,加入芹菜素粗提物及单体样品溶液(质量浓度梯度为1,2,4,6,8 g/mL)2 mL,再加入25℃下预热过的45 mmol/L邻苯三酚溶液75 L,迅速混匀,反应4 min后加入20 L浓度为10 mol/L HCl溶液终止反应,对同样浓度的VC作同样处理并作为阳性对照,以蒸馏水为参比,于波长320 nm处测定吸光度,记为A1;按上述方法,以2 mL蒸馏水代替样品,于波长320 nm处测定吸光度,记为A2;以蒸馏水代替邻苯三酚溶液,于波长320 nm处测定吸光度,记为A0。以上吸光度均各测3次[25]。根据公式(6) 计算清除率:

2 结果与分析
2.1 水芹中粗黄酮的提取工艺优化
2.1.1 水芹中粗黄酮提取的单因素试验结果
水芹中粗黄酮提取的单因素试验结果见图1。

图1 水芹中粗黄酮提取的单因素试验结果
乙醇体积分数对水芹中粗黄酮提取的影响如图1(a)所示。很显然,随着乙醇体积分数的提高,黄酮得率明显上升,且乙醇体积分数达到80%时,黄酮得率最高(30.24 mg/g)。乙醇体积分数进一步提高后黄酮提取量有所下降。由于黄酮类化合物结构各异,其溶解特性因极性不同而有所差异。水芹黄酮中含多种成分,既有黄酮苷类又有苷元类,所以选用一定比例的乙醇溶液能够最大程度地提取出来。
提取温度对水芹中粗黄酮提取的影响如图1(b)所示。可以看出,当提取温度从50℃上升到70℃时,黄酮得率显著上升,从9.11 mg/g上升至30.24 mg/g,这是由于提取温度升高可加快分子扩散速率,从而促进黄酮类物质的析出。但提取温度进一步上升时,黄酮得率明显下降,这可能因为提取温度较高,破坏了黄酮类化合物的结构,并增加了其他非黄酮物质的析出。
提取时间对黄酮得率的影响如图1(c) 所示。显而易见,提取时间从2 h上升至4 h时,黄酮得率提高到最高值(30.24 mg/g),随着提取时间的延长,黄酮得率无明显变化。这可能是因为黄酮成分的溶出需要一个过程,随着提取时间的延长,而达到饱和状态,使得黄酮得率无明显变化。
料液比对黄酮得率的影响如图1(d)所示。很明显,当料液比从1∶10上升至1∶30时,黄酮得率快速上升到最大值(30.24 mg/g)。然而,随着料液比的进一步提高,黄酮得率不仅没有增大,甚至还出现了略微的下降,这可能是因为黄酮成分的溶出已经达到饱和。
2.1.2 水芹中粗黄酮的最佳提取工艺的确定
考虑到不同提取因素间的相互作用,在单因素试验的基础上,选择L9(34)正交试验进行最佳提取工艺的确定。
正交试验因素与水平设计见表1,正交试验结果见表2。
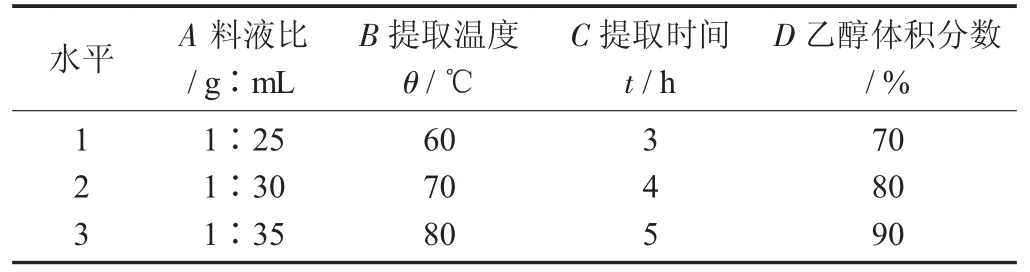
表1 正交试验因素与水平设计

表2 正交试验结果
由表2可知,影响从水芹中提取粗黄酮的主次因素排列次序为料液比>提取温度>乙醇体积分数>提取时间。根据结果观察,8号试验的黄酮得率最高,提取工艺为料液比1∶35,提取温度70℃,提取时间3 h,乙醇体积分数90%。然而从极差分析的结果看,最佳组合为A3B3C2D3。所以,对A3B2C1D3和A3B3C2D3进行验证试验,结果分别为33.76,36.75 mg/g,最终确定A3B3C2D3为水芹中粗黄酮的最佳提取工艺,即料液比1∶35,提取温度80℃,提取时间4 h,乙醇体积分数90%。
2.2 大孔吸附树脂的筛选
评定大孔吸附树脂性能,不仅需要有较大的吸附量,还需要较大的解析率,所以可以通过测定大孔吸附树脂AB-8,HP-20和X-5型这3种的吸附率和解析率来进行筛选。
3种大孔树脂对水芹黄酮的吸附率和解析率见表3。
由表3可知,弱极性的AB-8型大孔树脂对水芹黄酮的吸附率和解析率最大,分别为69.87%和72.57%,故选择AB-8型大孔树脂对水芹黄酮进行纯化。分析其原因,可能是水芹黄酮中非极性物质相对比较少。

表3 3种大孔树脂对水芹黄酮的吸附率和解析率/%
2.3 制备型液相色谱分析结果
芹菜素粗提物的制备液相色谱图见图2。

图2 芹菜素粗提物的制备液相色谱图
由图2可以看出,黄酮化合物得到了较好的分离,分离出的单体有4种,出峰时间分别为5.35,9.45,11.01,15.38 min,其相对含量分别为12.23%,46.32%,23.34%,18.26%[19]。
芹菜素分析型高效液相色谱图见图3。
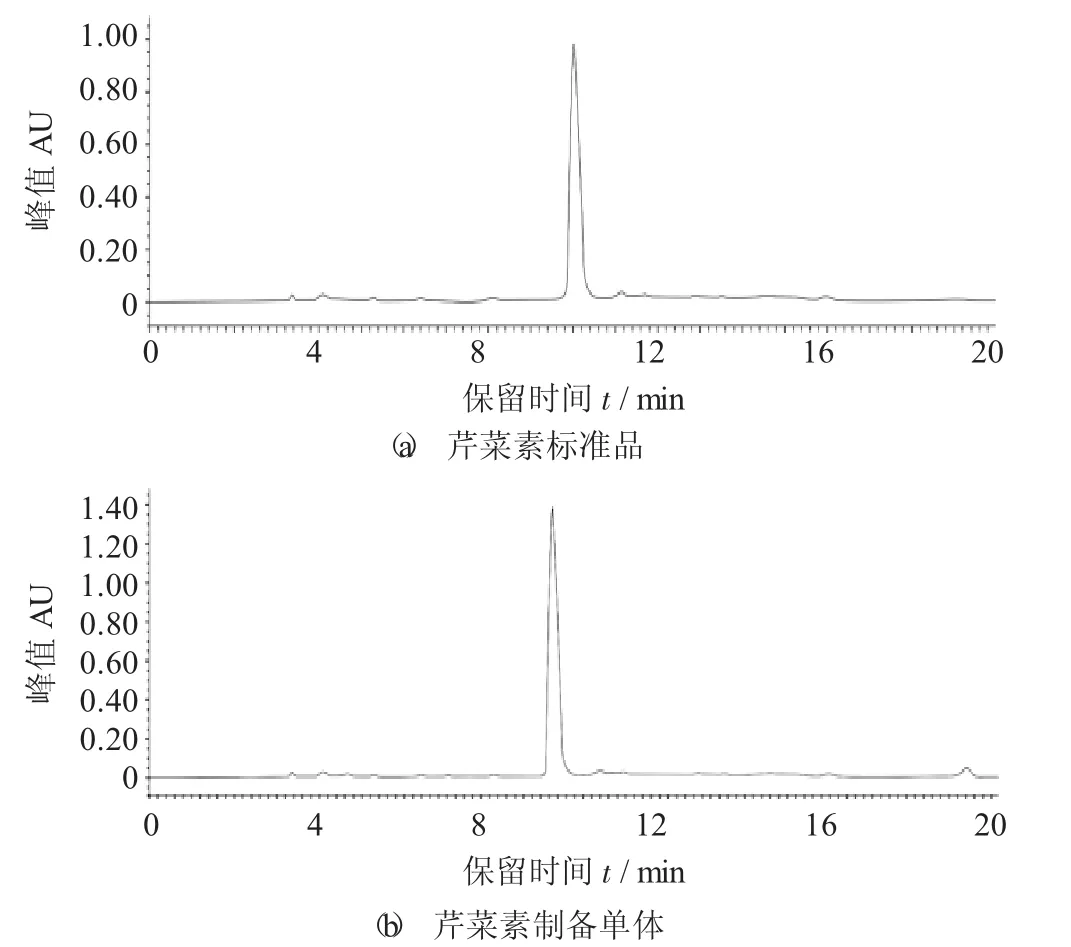
图3 芹菜素分析型高效液相色谱图
相同的色谱条件下,芹菜素标准品的高效液相色谱图如图3(a)所示,得出其出峰时间为10.06 min。通过制备液相收集出2号峰的液体。将收集的单体进一步进行高效液相分析,结果如图3(b) 所示,其出峰时间为9.52 min,为单一色谱峰,制备效果较好。
2.4 质谱分析结果
芹菜素单体质谱图见图4。

图4 芹菜素单体质谱图
由图4可知,基峰269 m/z是芹菜素去质子化后形成的准分子离子峰,说明芹菜素具有较强的酸性,容易失去氢质子形成负离子而被检测。质谱峰187 m/z和268 m/z等可能是269 m/z的碎片离子,另一些相对丰度较低的峰则可能来自溶液中电喷雾溶剂和样品溶剂或芹菜素标准品所含的少许杂质[23]。
2.5 抗氧化活性研究结果
2.5.1 清除DPPH自由基能力
芹菜素对DPPH自由基清除能力见图5。

图5 芹菜素对DPPH自由基清除能力
显然,DPPH自由基清除能力与芹菜素单体的质量浓度呈正相关的关系,同一质量浓度下,芹菜素单体、粗提物和VC的清除能力大小为VC>芹菜素单体>粗提物。在质量浓度为60 g/mL时,VC的清除率高达94.83%。芹菜素能直接作用于DPPH自由基,其原因可能是其直接提供H+给DPPH自由基,也可能是其转移电子到DPPH自由基。
2.5.2 清除羟基自由基(·OH)能力
芹菜素对羟基自由基清除能力见图6。

图6 芹菜素对羟基自由基清除能力
由图6可知,和清除DPPH自由基类似,VC的清除效果最好,芹菜素单体对羟基自由基的清除能力弱于VC,且羟基自由基清除能力与芹菜素单体的质量浓度呈正相关关系,同一质量浓度下,芹菜素单体、粗提物和VC的清除能力大小为VC>芹菜素单体>粗提物。在质量浓度为10 g/mL时,芹菜素单体和VC的清除能力接近,VC的清除率达到了60.82%,芹菜素单体的清除率为57.49%。这可能是因为芹菜素提供H+与·OH结合,使其还原成惰性化合物或稳定的自由基。
2.5.3 清除超氧阴离子(O2-·) 能力
芹菜素对超氧阴离子自由基清除能力见图7。

图7 芹菜素对超氧阴离子自由基清除能力
很明显,相同质量浓度下,芹菜素单体、粗提物和VC的清除能力大小为VC>芹菜素单体>粗提物。但在质量浓度为4 g/mL以上时,芹菜素单体和VC的清除能力相差不大;质量浓度为8 g/mL时,VC的清除率达到了82.64%,芹菜素单体的清除率为79.78%。关于清除O2-·的机理相关研究较少,猜测其原理与清除DPPH自由基和羟基自由基的原理相似,均提供不稳定的自由基。
3 结论
以水芹为原料,首先通过单因素试验和四因素三水平正交试验优化了水芹中黄酮的提取工艺,最佳提取工艺为料液比1∶35,提取温度80℃,提取时间4 h,乙醇体积分数90%。通过大孔吸附树脂对粗黄酮进行分离与纯化,确定了AB-8型大孔吸附树脂对粗黄酮的纯化效果最好。通过制备液相色谱对粗黄酮进行分离纯化,经高效液相色谱分析(HPLC) 和质谱进行验证出分离的该物质为芹菜素单体,且纯度较高。同时,芹菜素粗提物及单体对DPPH自由基、羟基自由基和超氧阴离子自由基都具有一定的清除能力,其中芹菜素单体的抗氧化性要大于粗提物,且芹菜素单体对超氧阴离子自由基的清除能力较强。
