猕猴桃籽油微乳液氧化稳定性及体外抗氧化活性研究
2019-02-18蔡程晨朱式业熊武国李加兴张广艳
蔡程晨,朱式业,熊武国,李加兴,,易 倩,张广艳
(1.吉首大学化学化工学院,湖南吉首 416000;2.吉首大学林产化工工程湖南省重点实验室,湖南张家界 427000;3.湖南省澧县中医医院,湖南澧县 415500)
猕猴桃又叫藤梨、阳桃、猕猴梨[1],其主要营养成分含量位居其他水果前列,因而有“水果之王”的美誉[2]。现有研究结果表明,猕猴桃果实中含种籽0.8%~1.6%,千粒质量1.2~1.6 g,含油量高达35.6%。猕猴桃籽油中亚油酸、亚麻酸等多不饱和脂肪酸占75%以上,特别是亚麻酸含量达64.1%,这是目前发现的除苏子油外亚麻酸含量最高的天然植物油[3]。有研究表明,猕猴桃籽油具有调节血脂、延缓衰老等保健功能和护肤功效[4]。由此可见,把猕猴桃籽油用于护肤品领域具有十分广阔的前景。
存在过多对机体有破坏作用的自由基,如超氧阴离子、羟基自由基等活性氧自由基会在生物机体正常代谢过程中会产生。在正常情况下,机体产生的过多自由基会循序被体内的清除剂所清除,因而机体自由基处于一种动态平衡之中。如果失衡或者清除过慢,过多的自由基会使生物大分子受到攻击,加速机体的衰老进程,并诱发炎症、恶性肿瘤、免疫失调等多种疾病[5]。一方面可通过运动来保证身体内的自由基正常,另一方面人们将研究重点放在了抗氧化剂的应用上。目前,大部分的抗氧化剂都是通过化学合成的,会影响到人体健康,因而天然抗氧化剂引起了人们的广泛关注。
猕猴桃籽油作为一种天然抗氧化剂因富含多烯酸、易于氧化而制约了其应用,成为在食品与日化品应用领域中的技术瓶颈,因而将其制备成微乳液以提高其氧化稳定性,可进一步扩大其应用范围。因此,试验以W/O型猕猴桃籽油微乳液为研究对象,采用加速氧化试验与体外抗氧化模型探讨猕猴桃籽油微乳液的氧化稳定性和体外抗氧化活性,可为猕猴桃籽油微乳液在食品与日化品领域的开发应用提供理论依据。
1 材料与方法
1.1 试验材料
猕猴桃籽油,湖南优镒农业开发有限公司提供,采用超临界萃取工艺提取;磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇、三羟甲基氨基甲烷、浓盐酸、氢氧化钠、焦性没食子酸、过氧化氢、七水合硫酸亚铁、水杨酸等,均为分析纯。
1.2 仪器与设备
FA2014型电子天平、7230G型可见光分光光度计,上海舜宇恒平科学仪器有限公司产品;电子万用炉,天津市泰斯特仪器有限公司产品;HH-S型水浴锅、DF-101S型集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司产品;800型电动离心机,常州市金环区环宇科学仪器厂产品;UV-2450型紫外分光光度计,日本岛津公司产品;BCD-215TS型冰箱,青岛海尔股份有限公司产品;GZX-9146·MBE型电热恒温鼓风干燥箱,上海博讯实业有限公司医疗设备厂产品;PHS-3C型pH计,上海仪电科学仪器股份有限公司产品。
1.3 试验方法
1.3.1 猕猴桃籽油微乳液的制备方法
首先,将复合表面活性剂(吐温和司盘) 和助表面活性剂按2∶1混合,再按1∶1比例加入IPM与猕猴桃籽油混合油相,然后用微量滴定管逐滴加入去离子水,同时在一定温度下搅拌,直至溶液由浑浊变为澄清(形成微乳液),即可得到猕猴桃籽油微乳液。
1.3.2 猕猴桃籽油微乳液氧化稳定性试验
采用加速氧化试验探讨猕猴桃籽油微乳液和普通猕猴桃籽油的氧化稳定性。将猕猴桃籽油微乳液和普通猕猴桃籽油放置在65℃干燥箱中,每隔24 h测定其过氧化值,探讨不同贮藏时间对猕猴桃籽油微乳液氧化稳定性的影响。
1.3.3 还原能力测定试验
将猕猴桃籽油微乳液用无水乙醇分别配制成质量浓度为2,4,6,8,10 mg/mL的猕猴桃籽油微乳液,分别取1 mL上述猕猴桃籽油微乳液于试管中,依次加入0.2 mol/mL pH值6.6的磷酸盐缓冲液2.5 mL,1%铁氰化钾2.5 mL,混匀,于50℃水浴中保温20 min,再加入10%三氯乙酸2.5 mL,混匀,以转速3 000 r/min离心10 min后取上清液2.5 mL于试管中,加去离子水2.5 mL和0.1%三氯化铁0.5 mL,常温反应5 min后于波长700 nm处测定吸光度[6],以吸光度大小评价还原能力的高低。以相同浓度VE为阳性对照,临用前以无水乙醇配制成与试验猕猴桃籽油微乳液同等浓度的对照液。做3次平行。
1.3.4 体外抗氧化活性试验
(1) O2-·清除试验。将猕猴桃籽油微乳液用无水乙醇分别配制成质量浓度为3,6,9,12,15 mg/mL,各加入0.05 mol/L的Tris-HCl缓冲液4.5 mL于试管中,置于25℃水浴锅预热20 min后,分别取1 mL上述猕猴桃籽油微乳液和3 mmol/L的邻苯三酚溶液0.1 mL,混匀,于25℃下反应5 min后加入浓度8 mmol/L的HCl溶液1 mL终止反应,于波长299 nm处测定样品溶液的吸光度A1[7]。以相同浓度VE为阳性对照,蒸馏水做空白对照,做3次平行。按下式计算对·的清除率:

式中:A1——1 mL样品液+4.5 mL Tris-HCl缓冲液+0.1 mL邻苯三酚溶液+1 mL HCl溶液;
A2——1 mL样品液+4.5 mL Tris-HCl缓冲液+0.1 mL邻苯三酚溶液+1 mL无水乙醇溶液;
A3——1 mL蒸馏水+4.5 mL Tris-HCl缓冲液+0.1 mL邻苯三酚溶液+1 mL HCl溶液。
(2) DPPH·清除试验。将猕猴桃籽油微乳液用无水乙醇分别配制成质量浓度为40,80,120,160,200 mg/mL,分别取3 mL上述超微细猕猴桃籽油溶液于试管中,加入浓度0.2 mmol/L的DPPH·溶液2 mL,混匀后避光静置30 min,于波长517 nm处测定吸光度[8]。以相同浓度VE为阳性对照,临用前以无水乙醇配制成与试验猕猴桃籽油微乳液同等浓度的对照液。蒸馏水做空白对照,做3次平行。按下式计算对DPPH·的清除率:
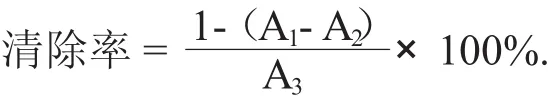
式中:A1——3 mL样品溶液+2 mL DPPH·溶液;
A2——3 mL样品溶液+2 mL无水乙醇溶液;
A3——3 mL蒸馏水+2 mL DPPH·溶液。
(3) ABTS+·清除试验。将 7.4 mmol/L ABTS+·的K2S2O8溶液(K2S2O8浓度为2.6 mmol/L) 在室温避光保存12 h,制得ABTS+·储备液。经磷酸盐缓冲液(pH值7.4) 稀释,使其在波长734 nm处的吸光度达到0.70±0.02,得到ABTS+·自由基工作液。将猕猴桃籽油微乳液用无水乙醇分别配制成质量浓度为20,40,60,80,100 mg/mL,分别取0.2 mL样品溶液与试管中,加入0.8 mL ABTS+·工作液混合,振摇10 s,以充分混合,暗处反应6 min,于波长734 nm处测定吸光度[9],以相同浓度VE为阳性对照,做3次平行。结果用ABTS+·清除率表示。
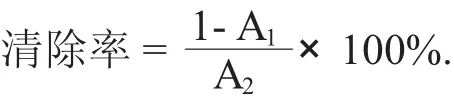
式中:A1——0.8 mL ABTS+·工作液+0.2 mL样品溶液;
A2——0.8 mL ABTS+·工作液+0.2 mL无水乙醇。
(4)·OH清除试验。将猕猴桃籽油微乳液用无水乙醇分别配制成质量浓度为12,16,20,24,28 mg/mL,分别取1 mL上述猕猴桃籽油微乳液于试管中,依次加入浓度为6 mmol/L FeSO4溶液1 mL,浓度为6 mmol/L水杨酸乙醇溶液1 mL,最后加入浓度为8mmol/L的H2O2溶液1 mL以启动反应,于37℃水浴中加热30 min后终止反应,于波长510 nm测定吸光度A1[10]。以相同浓度VE为阳性对照,临用前以无水乙醇配制成与试验猕猴桃籽油微乳液同等浓度的对照液。蒸馏水做空白对照,做3次平行。按下式计算·OH清除率:

式中:A1——1 mL样品溶液+1 mL FeSO4溶液+
1 mL水杨酸乙醇溶液+1 mL H2O2溶液;
A2——1 mL样品溶液+1 mL FeSO4溶液+1 mL水杨酸乙醇溶液+1 mL无水乙醇溶液;
A3——1 mL蒸馏水+1 mL FeSO4溶液+1 mL水杨酸乙醇溶液+1 mL H2O2溶液。
1.3.5 过氧化值测定方法
按照GB 5009.227—2016食品安全国家标准 食品中过氧化值的测定方法进行测定。1.3.6 数据分析
所有试验数据均采用平均差±标准差,利用Origin 8.5软件对数据进行处理并绘制图表。
2 结果与分析
2.1 猕猴桃籽油微乳液的氧化稳定性
贮藏时间对猕猴桃籽油微乳过氧化值的影响见图1。

图1 贮藏时间对猕猴桃籽油微乳过氧化值的影响
由图1可知,在烘箱加速氧化试验中,普通猕猴桃籽油和猕猴桃籽油微乳液的过氧化值均随贮藏时间延长而升高,猕猴桃籽油原油增幅为8.71,而猕猴桃籽油微乳液过氧化值的增幅仅为0.15,表明猕猴桃籽油微乳液的抗氧化稳定性优于普通猕猴桃籽油,与加入的表面活性剂本身具有抗氧化活性有关[11]。
2.2 猕猴桃籽油微乳液的还原力测定
猕猴籽油微乳还原能力的曲线见图2。
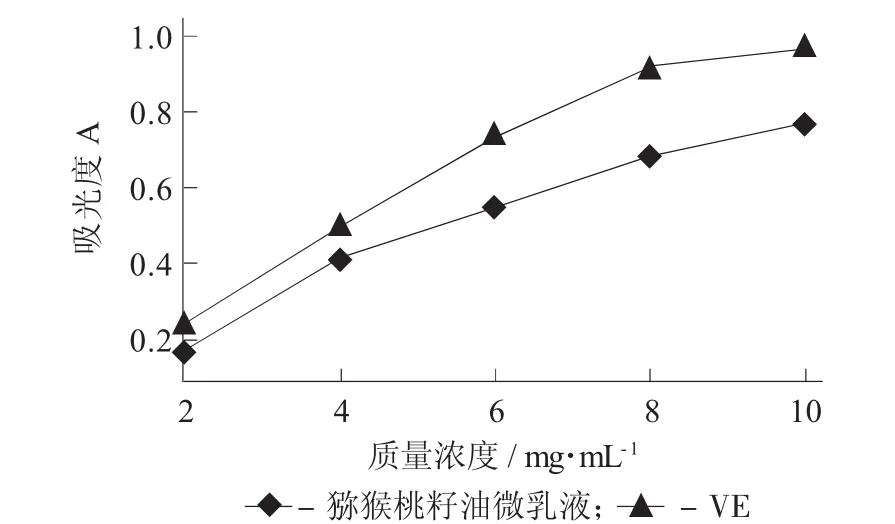
图2 猕猴籽油微乳还原能力的曲线
由图2可知,猕猴桃籽油微乳液和VE还原力均呈线性增长趋势。根据还原能力的测定方法,在波长700 nm处测定的吸光度越大,则抗氧化剂的还原能力越强[12]。还原力强的溶液同时也是良好的电子供应者,其供应的电子除了Fe3+还原为Fe2+外,也参与自由基反应,与自由基结合生成稳定的物质。说明在还原力能力上,VE的抗氧化能力高于猕猴桃籽油微乳液。
2.3 猕猴桃籽油微乳液体外抗氧化活性
2.3.1 猕猴桃籽油微乳液对O2-·清除率的影响
O2-·通常作为自由基链式反应的引发剂,可以经过一系列反应产生其他自由基,进一步对机体造成危害[13]。因此,研究猕猴桃籽油微乳液对O2-·的清除能力是研究其抗氧化活性的重要指标。
猕猴桃籽油微乳质量浓度对O2-·清除率的影响见图3。
由图3可知,猕猴桃籽油微乳液对O2-·的清除能力随着质量其浓度的增加而提高。这是因为猕猴桃籽油微乳液中富含多酚类物质[14],可提供氢原子(或正电子),使自由基转变为非活性的或较为稳定的化合物,从而能中断自由基的链锁反应[15]。当质量浓度超过12 mg/mL时,猕猴桃籽油微乳液对O2-·的清除作用趋于平缓,当其质量浓度达到15 mg/mL时,清除率达87.57%,呈现出良好的O2-·清除能力。
2.3.2 猕猴桃籽油微乳液对清除DPPH·的影响
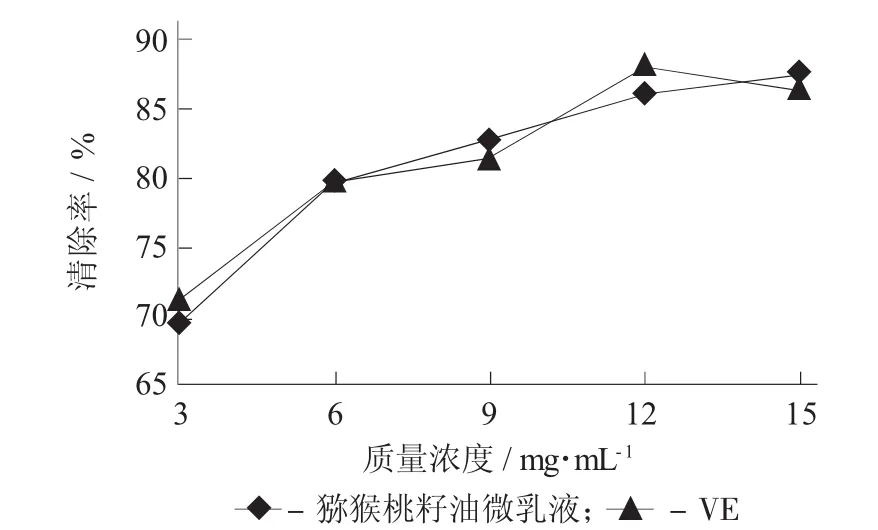
图3 猕猴桃籽油微乳质量浓度对O2-·清除率的影响
当有自由基清除剂存在时,DPPH·的单电子被捕捉而使其颜色变浅,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计进行快速的定量分析,从而评价试验样品的抗氧化能力。此抗氧化能力用清除率表示,清除率越大,抗氧化能力越强[16]。
猕猴桃籽油微乳液质量浓度对DPPH·清除率的影响见图4。
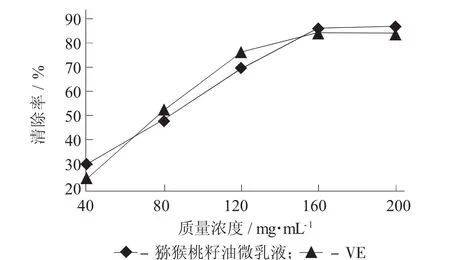
图4 猕猴桃籽油微乳液质量浓度对DPPH·清除率的影响
由图4可知,猕猴桃籽油微乳液和VE均对DDPH·有清除能力,且随着质量浓度的增加而增加。当质量浓度超过160 mg/mL后,猕猴桃籽油微乳液对DPPH·清除能力比VE的清除能力要高,而DPPH·的清除活性与抗氧化剂分子中有效酚羟基的数目与新形成的抗氧化剂自由基的稳定性有关[17]。由此推断猕猴桃籽油微乳液具有良好的DPPH·清除能力。
2.3.3 猕猴桃籽油微乳液对ABTS+·清除率的影响
ABTS+·的清除原理是电子转移过程,并且较DPPH·更容易发生反应。ABTS+·水溶液与过硫酸钾避光反应后,形成深蓝色的ABTS+·储备液,当加入不同质量浓度微乳液和VE时,储备液颜色变浅,测得吸光度的减少幅度,即为微乳液和VE对自由基的清除率。
猕猴桃籽油微乳液质量浓度对ABTS+·清除率的影响见图5。

图5 猕猴桃籽油微乳液质量浓度对ABTS+·清除率的影响
由图5可知,在20~100 mg/mL范围内ABTS+·清除率与猕猴桃籽油微乳和VE溶液之间呈良好的线性关系。因为酚类化合物的抗氧化活性不仅取决于取代基的供电子效应,还取决于酚羟基周围空间位阻[18]。由于VE的侧链能够直接参与到细胞的氧化还原过程,使得自由基的活力降低。因此,VE清除ABTS+·的能力比较猕猴桃籽油微乳液好。
2.3.4 猕猴桃籽油微乳液对·OH清除率的影响
和其他自由基相比,·OH是体内最活跃的活性氧自由基,产生于生命活动的氧化代谢过程,可使氨基酸、蛋白质、脂类和核酸等大分子发生氧化损伤,诱导细胞凋亡或使转化细胞脱离正常细胞的控制无限生长而癌变[19]。
猕猴桃籽油及其微乳质量浓度对·OH清除率的影响见图6。

图6 猕猴桃籽油及其微乳质量浓度对·OH清除率的影响
由图6可知,猕猴桃籽油微乳液和VE对·OH的清除能力有所差异,但均表现出了清除能力,并且呈明显剂量依赖关系。猕猴桃籽油微乳液对·OH清除率在不同质量浓度时明显高于VE的清除率,两值相差40%以上。
3 结论
(1)猕猴桃籽油微乳液的过氧化值随贮藏时间的延长而逐渐升高,但远低于普通猕猴桃籽油,说明猕猴桃籽油微乳液具有较好的抗氧化稳定性。
(2)猕猴桃籽油微乳液的体外抗氧化试验结果表明,猕猴桃籽油微乳液具有一定的还原力和自由基清除能力,其抗氧化能力与其质量浓度有较好的量效关系。当质量浓度为15 mg/mL时,猕猴桃籽油微乳液对O2-·清除率为87.57%。
(3)猕猴桃籽油微乳液可清除自由基、阻断自由基链式反应,在一定质量浓度范围内能抑制自由基的氧化损伤,这为猕猴桃籽油微乳液的进一步研究和应用提供了理论依据,也可为猕猴桃资源的综合开发利用提供一条新途径。
