“缺血后适应”用于深低温停循环器官保护效应研究
2019-02-15张仁腾
张仁腾, 刘 宇, 李 宁, 徐 殊, 唐 亮, 张 永
北部战区总医院 心血管外科,辽宁 沈阳 110016
深低温停循环技术使许多常规技术难以处理的复杂先心病、Stanford A型主动脉夹层、复杂主动脉弓部病变、战场创伤休克等疾病的救治成为可能[1-2]。然而,深低温停循环会造成严重全身炎症反应及器官缺血再灌注损伤。缺血后适应(ischemic postconditioning,IPOC)是在缺血器官恢复再灌注过程中给予多次短时间“灌注-缺血”操作。有动物实验显示,IPOC有助于缓解器官缺血再灌注损伤及炎症反应[3]。IPOC应用于深低温停循环手术,可能保护全身各器官,且操作简单、实施方便、不干扰手术进程。本研究拟探讨“缺血后适应”对于心、肾、肝等多器官的保护效应。现报道如下。
1 对象与方法
1.1 实验动物及主要仪器 实验动物为清洁级健康成年巴马香猪12只(北部战区总医院实验动物中心提供),雌雄不限。体质量39~53 kg,平均体质量(46.2±5.1)kg。将12只香猪随机分为深低温停循环组(A组)与深低温停循环IPOC组(B组),每组各6只。主要仪器:滚压泵体外循环机及膜式氧合器;体外循环管道为Edward公司16F动脉插管、18F静脉插管;Sorin公司变温水箱;Datex-Ohmeda公司S/5多功能监护仪;动物麻醉呼吸机。
1.2 研究方法
1.2.1 动物麻醉 实验猪术前12 h禁食,4 h禁水。采用氯胺酮20.0 mg/kg及阿托品0.5 mg肌内注射诱导麻醉,1.5%~2.0%异氟醚面罩吸入5 min后行气管插管,呼吸机辅助呼吸,吸入氧浓度50%,潮气量10 ml/kg,呼吸频率15~20次/min。手术期间,以异氟醚、泮库溴铵、芬太尼维持麻醉稳定。胸部贴电极片行心电监护,猪舌中部夹氧饱和度探头监测末梢血氧饱和度,肛门置温度探头监测直肠温度。右颈部、胸部、下腹部、双侧腹股沟备皮。术区以安尔碘消毒,铺无菌单。左侧股静脉、右侧股动脉及右侧股静脉分别穿刺置管,监测中心静脉压、动脉压,并建立静脉输液通路。
1.2.2 体外循环及深低温停循环 右颈部气管旁行约4 cm长纵向切口,切开皮肤、皮下组织;胸锁乳突肌中点内侧肌间沟内分离出右侧颈总动脉及颈内静脉,以5-0 Prolene缝线于颈总动脉及颈内静脉预置荷包缝线;股静脉注射肝素钠300 U/kg,全身肝素化(激活全血凝固时间>400 s)。切开血管后,分别置入16F动脉插管及18F静脉插管(静脉插管置入右心房内),建立体外循环。预充600 ml器官保护液(按照Taylor等[4]设计),灌流流量维持于75~80 ml/(kg·min),平均动脉压维持于50~80 mmHg(1 mmHg=0.133 kPa)。控制室内温度在20℃~25℃,体外循环逐渐降温,同时,放置冰袋于小猪腹部、胸部和脑部,促进均衡降温。心电图成直线为循环停止标志,直至直肠温度15℃时,停止转流和机械呼吸。停循环后,涨肺并挤压肝,依靠重力作用,促使静脉血回流至血袋保存,备复温时回输。停循环90 min后进行转流复温,复温速率<0.5℃/min,直至直肠温度达到37℃左右。复温过程如出现心室颤动,体外电极除颤复跳,恢复机械通气。B组动物恢复体外循环初,给予IPOC处理,即3个轮回的灌注30 s/阻断30 s。A组动物无此操作。循环稳定后逐渐减流量并停机,鱼精蛋白中和肝素,拔除体外循环插管。整个过程根据a-稳态调节动脉血气及电解质于正常范围。术后根据呼吸状况,决定气管插管应用时间。根据循环状况,酌情应用心功能支持(强心、利尿)。间断静脉注射氟比洛芬酯镇痛,静脉应用头孢呋辛抗感染至术后24 h。
1.2.3 生命体征监测 围术期持续监测生命体征,分别记录实验动物麻醉诱导后、转流初期、停循环、心复跳、脱离体外循环等时刻的直肠温度、平均动脉压及心率。
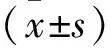
2 结果
2.1 两组直肠温度、平均动脉压及心率比较 所有动物均顺利度过围术期。两组动物麻醉诱导后、转流初期、停循环、心脏复跳、脱离体外循环5个时间点的直肠温度、平均动脉压、心率等生命体征数据比较,差异均无统计学意义(P>0.05,表1~3)。

表1 两组不同时间点直肠温度比较温度/℃)

表2 两组不同时间点平均动脉压比较血压/mmHg)

表3 两组不同时间点心率比较心率/次·min-1)
2.2 两组实验室指标比较 术后第1、3天,两组动物ALT、AST、Cr及TNT指标均有一定程度升高,至第7天逐渐接近正常。术后第1天,A组的ALT、Cr、TNT均明显高于B组(P<0.05);但两组AST比较,差异无统计学意义(P>0.05)。术后第3天及第7天,A组动物ALT、AST、Cr及TNT指标仍稍高于B组,但组间比较,差异均无统计学意义(P>0.05)。见表4。

表4 术后1、3、7 d化验指标比较
3 讨论
深低温停循环是婴幼儿复杂先天性心脏病及成人复杂大血管疾病外科治疗中的重要手段,可提供无血的手术视野,减少血管钳和管道的干扰。然而,全身器官缺血及再灌注损伤和系统性炎症反应会造成严重器官损害。停循环期间,全身各器官均处于缺血缺氧状态,细胞内三磷酸腺苷含量减少,钠泵活性降低,细胞水肿。组织再灌注后,氧自由基过度产生、脂质过氧化致细胞内钙超载,激活多种蛋白酶,破坏细胞膜,导致细胞损伤至死亡。上述过程同时激活全身及局部炎性反应,多种炎性因子、细胞介质、生物分子、神经递质失调控[5],引发多系统瀑布反应,细胞信号传导通路及基因表达紊乱,致大量细胞凋亡,进而引起术后相应器官功能损害。深低温停循环及再灌注过程中使全身各组织器官遭受广泛而深刻的损伤,术后多器官并发症发生率高且并发症均较严重。近年来,有研究发现,缺血预处理及IPOC可能减轻组织炎性反应及缺血再灌注损伤[6-7]。缺血预处理通过对某一器官进行反复短暂的缺血训练,达到使之耐受更长时间缺血的目的。IPOC是在缺血器官恢复再灌注过程中,给予多次短时间“灌注-缺血”操作,具有对抗缺血再灌注损伤的效应。考虑到组织缺血的不确定性(如急性心肌梗死),“后适应”可能较“预适应”更方便于临床应用。
本研究实验动物的麻醉及手术过程顺利,均于术后12 h内麻醉清醒并脱离呼吸机辅助。所有实验动物均顺利度过围术期,可见IPOC操作方便易行,并未明显干扰手术进程。术后近期两组动物ALT、AST、Cr、TNT等化验指标均有一定程度升高,显示深低温停循环过程对肝、肾、心等器官均有损伤。术后第1天,B组的ALT、Cr、TNT均明显低于A组,表明IPOC短期内有助于减轻术后肝、肾、心等多器官损伤。分析其保护机制可能在于IPOC减轻了全身及局部缺血再灌注损伤和炎性反应,从而减少了细胞死亡及调亡[8-9]。其后相应指标逐渐趋向正常,两组间也无明显差异,显示在之后器官修复过程中,IPOC保护作用并不显著。
大部分动物实验研究显示,IPOC具有明显的器官保护效应[10-14]。但在有限的临床研究中,其器官保护效应却颇有争议,很大一部分临床研究未发现其保护效应。动物实验与临床研究结果差异可能与如下因素有关:(1)实验动物以低龄雄性为主,而现实患者兼具两性,且以高龄多见[10];(2)实验动物以鼠类等小型动物为主,与人类生理有较大差异;(3)实验动物大多健康,而现实患者多合并器官慢性病史、高血压或糖尿病、血脂紊乱等代谢异常[11-12];(4)动物缺血模型相对一致,而现实患者闭塞血管及开通方式多样(如急性心肌梗死时,犯罪冠状动脉及血管再通方式不一)[13-14]。上述差异均可能从细胞及分子生物学角度影响研究对象对IPOC的反应。
综上所述,IPOC有助于缓解深低温停循环术后近期肝、肾、心等多器官损伤,其中,以术后第1天获益最为显著。但是,动物研究距离实现临床转化仍有较长的距离。下一步应该模拟临床实际构建动物模型,以观察IPOC的作用效果,并探索更加有效且易于临床应用的IPOC模式,如进一步优化“灌注/阻断”次数和时程等。
