26 280例结直肠癌患者MLH1和PMS2基因表达情况及临床病理特征的多中心回顾性研究
2019-02-13张园园邹霜梅王振宁韩方海夏立建张睿俞金龙乌新林赵志勋王锡山
张园园 邹霜梅 王振宁 韩方海 夏立建 张睿 俞金龙 乌新林赵志勋 王锡山
作者单位:100091 北京,医渡云(北京)技术有限公司医学部1;100021 北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院病理科2;110072 沈阳,中国医科大学附属第一医院胃肠肿瘤外科3;510120 广州,中山大学孙逸仙纪念医院胃肠外科4;250014 济南,山东省千佛山医院普外科5;110042 沈阳,辽宁省肿瘤医院结直肠外科6;510280 广州,南方医科大学珠江医院普外科7;010050 呼和浩特,内蒙古医科大学附属医院胃肠外科8;100021 北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院结直肠外科9
张园园, 邹霜梅, 王振宁, 等. 26 280例结直肠癌患者MLH1和PMS2基因表达情况及临床病理特征的多中心回顾性研究[J/CD]. 中华结直肠疾病电子杂志, 2019, 8(1): 16-22.
根据最新的中国癌症发病率报告显示,结直肠癌位于中国癌症新发病例和死亡病例的男性第5位、女性第4位,严重威胁着公众的健康[1]。在过去的几十年里,结直肠癌诊疗水平飞速提高,这在很大程度上得益于分子病理和基因组学的发展,使得医师对于结直肠癌有了更加精确细致的诊断,从而使不同类别的患者接受更加精准的治疗[2]。
在结直肠癌多种分子分型当中,错配修复基因是很重要的一组分子标记,包括从1966年林奇发表了N系和M系家族谱系遗传病到1984年林奇综合征、遗传性非息肉病性结直肠癌专业命名,再到1993年首次在结直肠癌患者中应用错配修复基因导致的微卫星不稳定理论来阐述林奇综合征。1995年以后,全部影响微卫星不稳定的错配修复基因已经确定,主要有:MHL1、MSH2、MSH6、PMS2[3-7]。不同组合的缺失不仅能够很好地预测患者预后,同时还影响患者手术的选择及对辅助治疗的反应[8]。错配修复基因不仅对于林奇综合征患者有重要意义,近年来发现它还对散发型结直肠癌患者同样具有重要意义[9-10]。然而目前仍然缺乏大规模的临床研究来验证。
另外,随着大数据时代的到来,大量的研究也已经从单打独斗到信息资源的整合。而在医学领域,大数据对于疾病的防控和治疗具有非凡的意义。通过对既往数据的整合和挖掘,可以寻找到全新的发现,进而指导疾病的早筛和临床治疗策略的选择。因此本研究基于结直肠癌大数据平台,回顾性探究了明确诊断为原发性结直肠癌且接受手术切除的患者MLH1和PMS2蛋白的表达情况,探讨其与临床病理特征之间关系,寻找其内部关联,并进一步判定该基因表达在中国结直肠癌人群中的影响及意义。
资料与方法
一、一般资料
中国结直肠癌联盟是由中国医学科学院肿瘤医院牵头,中国医科大学附属第一医院、山东千佛山医院、辽宁省肿瘤医院、内蒙古医科大学附属医院、中山大学孙逸仙纪念医院、南方大学珠江医院共同参与的学术平台。本研究纳入自2010年1月至2018年12月的患者205 071人次的数据。纳入标准:(1)出院诊断为原发性结直肠癌;(2)接受过手术切除原发病灶;(3)MHL1、MSH2、MSH6、PMS2免疫组化结果完整。
二、方法
本研究的数据采集依托医渡云科研平台,经过各中心伦理委员会批准,采取免之情同意方式获取患者除敏感信息外的全量医疗数据,包括电子病例系统、医院信息管理系统、检验信息管理系统、医疗影像存档和通信系统或放射科信息管理系统、移动护理信息系统、重症监护信息系统、手术麻醉信息管理系统、病案管理系统。检索有明确诊断结论(信息来源于病理学诊断、出院诊断、诊断名称)为原发性结直肠癌。
三、统计学分析
采用 SAS 9.4(SAS Institute Inc.,Cary,NC,USA)进行数据分析,计数资料采用频数和百分比表示,采用卡方检验分析其统计学差异;符合正态分布的计量资料用均数和标准差进行描述,并采用t检验进行分析,以P<0.05为差异有统计学意义。
结 果
一、结直肠癌MHL1、MSH2、MSH6、PMS2蛋白表达情况
在接受了错配修复基因检测的26 280患者中,MLH1缺失率最高,占比4%;其次是PMS2,占比3.25%;MSH6占比2.89%,MSH2占比2.3%。四个错配修复基因蛋白存在多种缺失组合,有570人同时存在MLH1和PMS2蛋白表达缺失,占比2.17%;有288人同时存在MSH2和MSH6,占比1.1%。
二、MLH1和PMS2蛋白表达缺失患者的临床特征
我们首先观察两种蛋白在发生缺失时的临床病理特征。对于性别而言,男性患者MLH1和PMS2蛋白缺失率高于女性患者:MLH1男性占比55.75%;女性占比44.25%。PMS2男性占比55.13%,女性占比44.87%。在发病年龄上,MLH1蛋白缺失的患者平均年龄为(61.76±11.94)岁,PMS2蛋白缺失的患者为(61.89±11.86)岁。在MLH1蛋白缺失的患者里,观察到12人(占比1.12%)伴发第二原发癌,而在PMS2蛋白缺失患者里有7人(占比0.96%)。肿瘤大小方面,病灶平均最长径均值分别是MLH1组(5.84±2.46)cm和PMS2组(5.90±2.55)cm。平均清扫淋巴结数目MLH1组(22.67±11.34)个和PMS2组(5.90±2.55)个。MLH1蛋白缺失的患者中,有明确肿瘤家族史患者208人(19.81%),PMS2蛋白缺失的患者172人(22.61%)。从患者肿瘤部位分布情况来看,直肠癌在两种蛋白表达缺失患者中比例最高,(MHL1占比46.46%和PMS2占比42.45%),其次是右半结肠癌(MHL1占比27.78%和PMS2占比29.5%),左半结肠癌占比最低(MHL1占比25.76%和PMS2占比28.06%)。
我们进一步比较其病理分期,按照TNM标准进行分期,首先对于T分期而言,在所有MLH1蛋白表达缺失的1 048例患者中T0期0例(0%),Tis期6例(0.56%),T1期5例(6.18%),T2期118例(11.24%),T3期471例(44.94%),T4期389(37.08%);对于N分期,N0期638例(60.82%),N1期252例(23.98%),N2期159(15.20%);M分期中,M0期738例(70.37%),M1期311例(29.63%)。在所有MLH1蛋白表达缺失的1 048例患者中T0期0例(0%),Tis期6例(0.79%),T1期48例(6.29%),T2期78例(10.24%),T3期354例(46.46%),T4期276(36.22%);对 于N分 期,N0期 450例(59.05%),N1期168例(22.05%),N2期144(18.09%);M分期中,M0期561例(73.68%),M1期201例(26.32%)。见表1。
三、MLH1蛋白表达情况对结直肠癌患者临床及病理特征的影响
与MLH1正常表达的患者相比,MLH1蛋白表达缺失的患者男女比例差异存在统计学意义(χ2=8.060,P=0.0045),其发病年龄小于正常表达组患者(t=4.350,P<0.0001)。其第二原发癌的发病率也高于正常表达组(χ2=60.309,P<0.0001)。在肿瘤大小方面,MLH1蛋白表达缺失的患者的肿瘤最大径大于正常表达组(t=7.730,P<0.0001),同时,清扫淋巴结总数目也高于正常表达组。此外,与正常组相比,MLH1表达缺失组呈现明显家族聚集倾向(χ2=11.605,P=0.001)。而在部位上,不同肿瘤部位MLH1蛋白缺失的发生率差异具有统计学意义(χ2=6.047,P=0.049),其中直肠与左半结肠MLH1蛋白缺失的比例低于正常组,而右半结肠缺失比例高于正常组。肿瘤T分期方面,不同T分期MLH1蛋白缺失的发生率差异具有统计学意义(χ2=46.309,P<0.0001),其中T3的比例缺失组高于正常组,而T4的比例则相反,表现为缺失组低于正常组。而对于N分期和M分期两组间差异未见统计学意义。见表2。
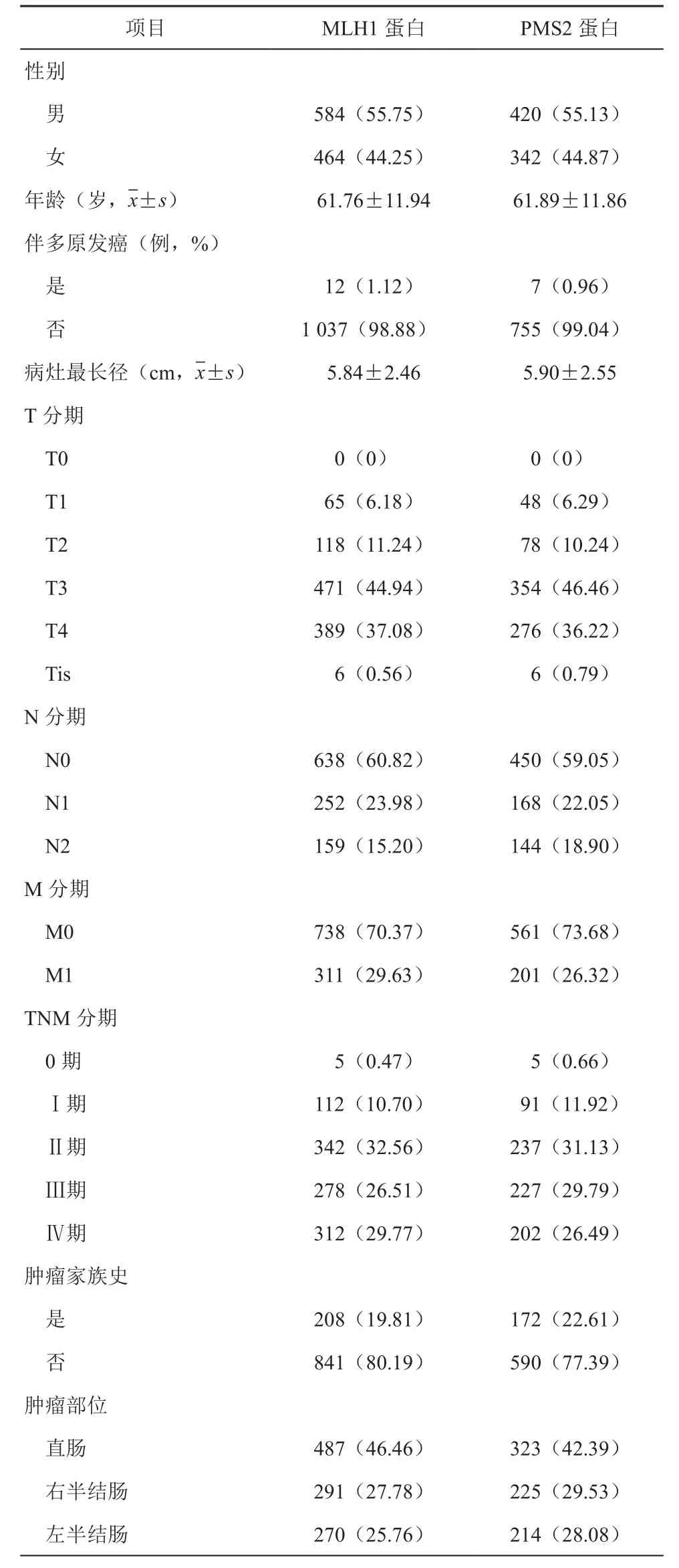
表1 患者的病理信息[例(%)]
四、PMS2蛋白表达情况对结直肠癌患者临床及病理特征的影响
与MLH1的结果相似,PMS2蛋白缺失的男女比例低于正常表达组(χ2=7.872,P=0.005),其发病年龄小于正常表达组患者(t=4.310, P<0.0001)。第二原发癌的发病率也高于正常表达组(χ2=26.790,P<0.0001)。在肿瘤大小方面,MLH1蛋白表达缺失的患者的肿瘤最大径大于正常表达组(t=8.550,P<0.0001),同时,清扫淋巴结总数目也高于正常表达组。但是,与MLH1不同的是,PMS2表达缺失组未见呈现明显家族聚集倾向。而在部位上,右半结肠MLH1蛋白缺失的发生率同样高于正常表达组患者。肿瘤T分期方面,不同T分期MLH1蛋白缺失表达的发生率差异具有统计学意义(χ2=51.580,P<0.0001),其中T3的比例缺失组高于正常组,而T2跟T4的比例则相反,表现为缺失组低于正常组。对于N分期两组间未见统计学差异。需要格外指出的是M分期中,PMS2蛋白缺失患者的远处转移率低于正常组患者(χ2=5.987,P=0.0008)。见表3。
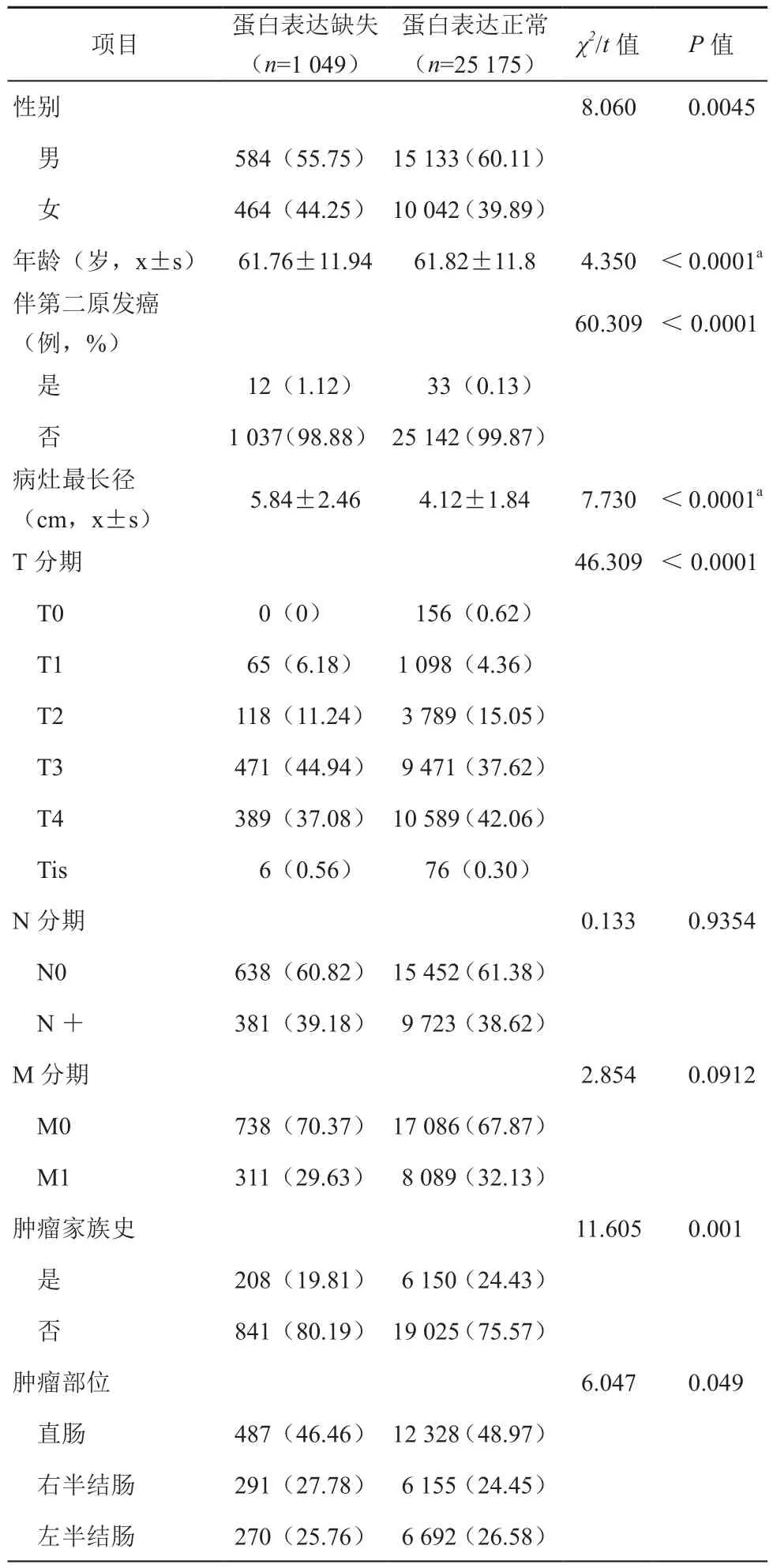
表2 MLH1蛋白表达情况对结直肠癌患者临床及病理特征的影响[例(%)]
讨 论
错配修复基因在结直肠癌诊疗过程中有着非常重要的作用,可对诊断精准分型,是手术治疗选择、是否需要辅助化疗或放疗、预测化疗治疗反应的重要依据。目前对于结直肠癌而言,微卫星状态作为已判定预后和判断部分期别结直肠癌用药预后的重要指标,并已经写入指南。而微卫星不稳定属于一种基因水平的变异,其根源主要是错配修复蛋白功能缺失,目前已经有研究证实微卫星不稳定状态与四种错配修复基因的符合率在97.8%。本研究的重大意义在于首次通过临床大样本数据,对中国人群结直肠癌错配修复基因在结直肠癌患者蛋白表达缺失状态以及与临床特征之间的关系进行探讨。我们回顾性地分析了中国结直肠癌联盟7家医院诊断为结直肠癌且行肿瘤切除术的患者的数据,利用免疫组化检测错配修复基因蛋白表达缺失情况,分别分析MHL1、PMS2蛋白表达缺失情况与临床特征之间的关系。
本文共纳入结直肠癌患者205 071人,其中进行免疫组化检测错配修复基因的患者共26 280人,总体检测率12.8%。在接受了错配修复基因检测的26 280患者中,MLH1缺失率最高,占比4%;其次是PMS2,占比3.25%;MSH6占比2.89%,MSH2占比2.3%。四个错配修复基因蛋白存在多种缺失组合,有570人同时存在MLH1和PMS2蛋白表达缺失,占比2.17%;有288人同时存在MSH2和MSH6,占比1.1%。既往研究显示西方国家人群错配修复基因的缺失率为15%~20%[15];我国也有报道,其错配修复基因缺失率在11.4%[16],但入组患者只有102例;而西班牙人群错配修复基因缺失率仅为4.3%[17],可以看出不同地域不同人群错配修复基因的比例具有很大差异。而对于四种错配修复基因MLH1、PMS2、MSH2和MSH6的突变率,Amira等[18]报道分别为15%、15%、21%和13%,而韩国Kim等[19]研究则为MLH1、MSH2和MSH6缺失率分别是3.7%、2%、5.2%。因此从上述数据可以看出,我国及韩国等亚洲地区结直肠癌患者错配修复基因的蛋白缺失率较低,进一步提示不同人种及地域会影响错配修复基因的表达。
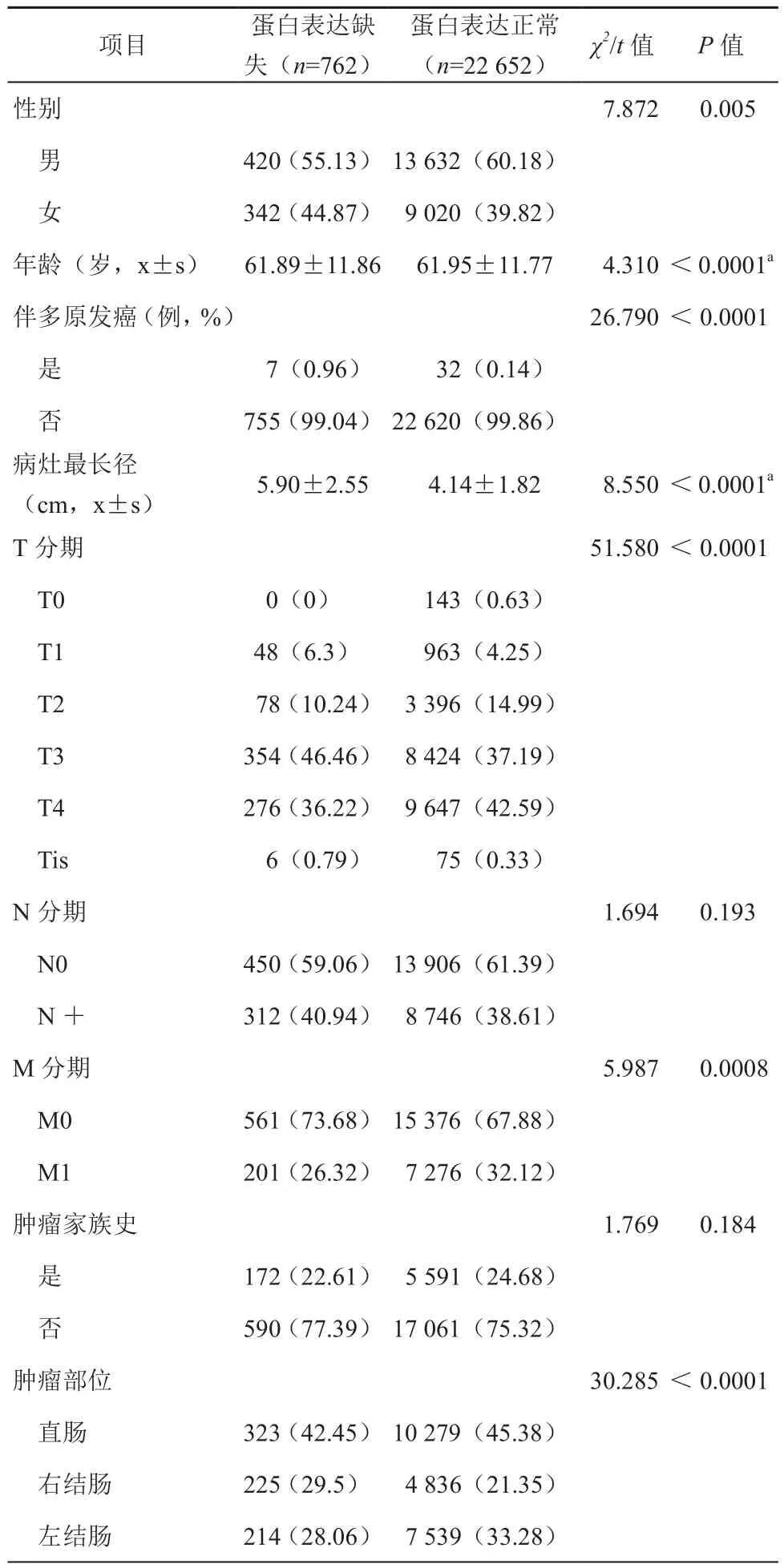
表3 PMS2蛋白表达情况对结直肠癌患者临床及病理特征的影响[例(%)]
另外,错配修复基因是人体内的重要体系,能够维持遗传物质的稳定性与完整性,他们之间与同源的错配修复蛋白组成二聚体共同发挥生物学功能。其中,MLH1和MSH2为主导蛋白,PMS2和MSH6为配对蛋白,一旦主导蛋白突变,则会引起二聚体的降解,导致主导蛋白与配对蛋白的共缺失。因此MLH1一旦缺失,则会伴有PMS2的缺失。本研究四个基因蛋白表达缺失有两个以上同时出现的组合中,以MHL1与PMS2同时缺失比率最高,其次是MSH2与MSH6同时缺失。其他组合情况,包括两个蛋白表达同时缺失、三个蛋白表达同时缺失、四个蛋白表达缺失均可见。从本研究结果中可以对既往的研究结果进行进一步的印证。
错配修复基因缺失的结直肠癌具有一定的临床病理特征,例如:发病年龄早,好发于右半,且预后良好。本研究亦可以大致得出类型结果,而需要指出的是,虽然在年龄上差异有统计学意义,但是从数值上,两组均值相差并不大,进一步分析可能是由于在MLH1缺失的患者中,一部分是基因突变原因造成的,另一部分则是由基因甲基化或者BRAF突变所引起的。前者具有明显的遗传倾向,所以发病较早;而后者则不具有遗传倾向,与散发性结直肠癌发病年龄相同,所以两种情况整合后,会使组间年龄差异变小。除了上述特征,本研究尚发现MLH1和PMS2表达缺失的患者与正常组相比存在性别上的差别,这种差别在既往研究中虽然未报道,但是在既往的临床工作中我们也发现了相应的规律,因此下一步有必要进一步探讨性别对错配修复基因蛋白表达的作用机制。在MLH1与PMS2的患者中,蛋白表达缺失患者合并第二原发癌的比例均高于蛋白表达无缺失组,同样地,在合并有第二原发癌的患者中,蛋白表达缺失患者的比例高于未合并第二原发癌的患者,差异均有统计学意义。肿瘤最长径均大于蛋白表达正常组患者。提示错配修复功能缺陷患者有更大的肿瘤负荷。
对于病理分期而言,T分期在两个蛋白表达缺失组和正常组之间均有显著性差异,进一步分析发现MHL1与PMS2蛋白表达缺失组患者T0至T2的比例小于蛋白表达正常组患者,而T3至T4的患者比例则大于蛋白表达正常组患者。本研究发现M分期与PMS2蛋白缺失存在明显关联,缺失组患者发生远处转移的发生率明显低于正常组,这在一定程度上能解释错配修复基因突变的结直肠癌患者预后较好,与此同时我们也会对PMS2的表达情况与肿瘤转移的发生机制进行进一步研究和探讨。
本研究为多中心大样本回顾性研究,其研究结果真实可靠,但本研究仍存在以下局限:(1)数据有所缺失:所有信息均来自临床病例材料,研究变量有不同程度的缺失;(2)数据不够规范:病例书写的不规范、检查报告结果记录的不统一等导致可提取的有效数据以及可深入分析的指标值有限。提示规范病历书写、病理学取材及报告乃至规范化的治疗流程非常重要;(3)后续随访:其结果非常重要,如能明确错配修复基因蛋白表达缺失及其病理特点与治疗及预后的关注,那么研究结果将更有意义。
