Drebrin在慢性脑缺血大鼠脑组织中表达的变化
2019-02-08杜开先张晓莉王丽君贾天明
李 林 杜开先 张晓莉 董 燕 韩 瑞 王丽君 关 静 贾天明
郑州大学第三附属医院小儿神经科,河南 郑州 450052
目前脑血管疾病的发病率逐渐增高,也加重了我国的经济负担。其中慢性脑缺血起病隐匿,早期症状容易受忽视,最终可导致海马区神经元变性、学习和记忆障碍、睡眠障碍、情绪障碍等。因此本研究通过双侧颈总动脉永久性结扎(2VO)建立大鼠慢性脑缺血模型,通过水迷宫试验观察慢性脑缺血大鼠学习记忆能力,免疫组化方法检测慢性脑缺血大鼠脑组织Drebrin的表达变化,探讨慢性脑缺血所致认知功能障碍的可能的机制。
1 材料与方法
1.1实验动物与分组由郑州大学医学院动物中心提供健康成年无视力缺陷Wistar大鼠120只,体质量300 g左右,雌雄不限。随机分为3组:正常对照组,假手术组,模型组,每组40只,其中每组又分为4周和8周组,各亚组20只。
1.2试剂与仪器山羊PV-9003免疫组化检测试剂盒(北京中杉金桥生物有限公司)、浓缩型DAB显色试剂盒(北京中杉金桥生物有限公司)、山羊抗Drebrin多克隆抗体(Santa Cruz公司)、Morris水迷宫仪(中国医学科学院药物研究所)等。
1.3慢性脑缺血动物模型建立采用永久性结扎双侧颈总动脉(2VO)建立大鼠慢性脑缺血模型。大鼠术前禁食12 h,禁水4 h,10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,双重丝线结扎双侧颈总动脉。术后大鼠均置于原通风的动物房喂养,给予足够的食物和水。假手术组不结扎双侧颈总动脉,余处理同模型组大鼠。正常对照组不做手术处理。
1.4学习记忆能力检测分别在4周和8周后用Morris水迷宫试验对各组大鼠进行学习记忆功能检测。检测历时5 d,训练4次/d。水迷宫的平台位于东南象限,每次采用不同的入水点,每次训练120 s。若大鼠在120 s内不能找到平台,则将其诱导到平台上停留10 s;若大鼠在规定时间内找到平台,则让其在平台上停留10 s,结束一次训练。分别记录各组大鼠第5天的潜伏期进行统计学分析。
1.5免疫组化染色各组大鼠学习记忆功能检测结束后,常规灌注取大脑组织,多聚甲醛固定,石蜡包埋切片。按PV免疫组化操作。Drebrin一抗浓度为1:100,阴性对照由PBS代替一抗。每只动物取5张切片,每张切片高倍镜下选取4个不同视野,计数每一个视野中的阳性细胞数,计算平均数。

2 结果
2.1Morris水迷宫试验结果统计结果分析显示,正常对照组潜伏期与假手术组大鼠相比差异无统计学意义(P>0.05);模型组大鼠潜伏期明显延长,与对照组比较差异有统计学意义(P<0.05),说明模型组大鼠学习记忆能力明显下降。其中,8周模型组大鼠潜伏期与4周模型组大鼠相比有显著延长(P<0.05),说明随着缺血时间延长,大鼠学习记忆能力持续下降。
2.2Drebrin免疫组织化学结果如下图所示,Drebrin免疫反应阳性为分布在树突和轴突中的棕黄色颗粒。正常对照组及假手术组大鼠脑组织中Drebrin阳性细胞数均较多,两者相比差异无统计学意义(P>0.05)。慢性脑缺血4周模型组的Drebrin阳性细胞与正常对照组相比明显减少(P<0.05),8周模型组Drebrin阳性细胞数与4周模型组相比显著减少(P<0.05)。结果见表2。

表1 各组大鼠不同时间点Morris水迷宫试验潜伏期比较
注:同一时间点,与假手术组比较,*P<0.05;与4周组比较,●P<0.05

表2 慢性脑缺血后不同时间点Drebrin的表达
注:同一时间点,与假手术组比较,*P<0.05,与4周组比较,●P<0.05
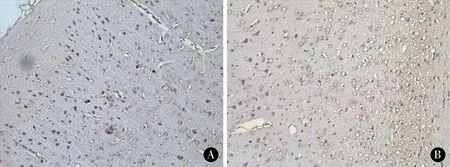

图1 各组大鼠大脑皮质Drebrin免疫组化染色结果(DAB染色,×200) A:正常对照组;B:模型组4周;C:模型组8周
Figure1Drebrinimmunohistochemicalstainingofcerebralcortexofratsineachgroup(DABstaining,×200)A:Normalcontrolgroup;B:Modelgroup4weeks;C:modelgroup8weeks
3 讨论
Drebrin,又称大脑发育调节蛋白(developmentally regulated brain protein),一种树突棘上纤维状肌动蛋白(filamentous actin,F-actin)的固有结合蛋白,主要分为两种亚型:成年型Drebrin A和胚胎型Drebrin E,它可以使f-actin和突触后致密区(postsynaptic density,PSD)募集到丝状伪足,调节肌动蛋白骨架的结构形态;Drebrin也参与轴突细胞骨架的调控,促进轴索侧支的形成[1]。Drebrin A在树突棘中的聚集可以抑制m-Dia2驱动的肌动蛋白聚合,进而促进肌动蛋白结构从线状变为分枝状[2]。在高分辨原子力显微镜下发现Drebrin通过显著改变f-actin的双螺旋和单纤维结构调节它的结构和机械重组[3]。新研究发现Drebrin在毛果芸香碱致颞叶癫痫成年鼠模型脑中表达是减少的,并指出Drebrin和突触结构完整性、稳定性和功能密切相关[4],并且Drebrin在谷氨酸能神经元树突棘表达明显高于γ-氨基丁酸能神经元[5]。研究表明Drebrin基因敲除神经元树突棘的易损性是增加的[6]。在树突棘处,F-actin与Drebrin A在肌动蛋白结合位点(actin binding site,ABS)结合可形成稳定的结构,这是构成记忆保持的基础[7],而Drebrin和f-actin在PSD-95形成稳定的复合物是完成长时程突触电位维持的关键[8]。有研究表明,在N-甲基-D-天冬氨酸型谷氨酸受体(NMDARs)过度活化诱导的兴奋性毒性状态下Drebrin可发生降解,进而的导致F-actin与Drebrin复合物减少,导致学习记忆能力下降[9]。同时,Drebrin可逆的磷酸化/脱磷酸作用参与大脑皮层神经元的径向迁移[10]。在出生后早期的小鼠中,抑制Drebrin表达不仅影响成神经细胞的形态,还影响成神经细胞的迁移和定向[11]。研究发现神经功能障碍伴随的认知功能障碍中树突棘Drebrin的缺失是突触功能障碍的共同的典型特征[12]。目前认为,Drebrin在树突棘可塑性和大脑高级功能如学习和记忆方面起到重要作用[13],Drebrin在树突棘的增加能够促进LTP 的产生和增强[14]。RIKA等[15]试验发现Drebrin A基因敲除大鼠表现出一种固执的类似精神分裂症的行为,并证明大脑Drebrin的减少导致了认知功能障碍,并且Drebrin减少程度可以反映认知障碍的程度[12]。
临床上常见的慢性脑缺血导致的脑损伤是脑低灌注及认知功能障碍,发病早期主要表现为认知功能障碍损害,最终发展为持久或进展性的认知与神经功能障碍。在低灌注及低代谢状态下,大鼠的学习记忆功能减退[16]。研究发现,在大鼠幼年时药物造成脑缺血损伤,6 个月后发现大鼠脑组织树突棘明显减少[17]。急性脑缺血灶周围树突棘明显缺失,约可减少38%[18]。阻断SD大鼠一侧大脑中动脉后,缺血区域树突棘密度明显降低[19]。大脑中动脉阻断模型中脑缺血后7 d海马CA1区Drebrin表达是减少的[20]。慢性脑缺血导致进行性的学习和记忆功能障碍,因此慢性缺血脑组织中Drebrin的表达的变化具有重要意义。本实验结果显示随着脑缺血时间延长,成年大鼠学习记忆能力持续下降,且脑组织中Drebrin表达持续降低。因此推测慢性脑缺血通过减少Drebrin的表达,阻断树突棘f-actin和PSD-95的簇集作用,减少簇集型丝状伪足的密度,抑制树突棘的形成[21]。另外Drebrin表达减少抑制Drebrin-actin复合物的形成,使树突棘固有蛋白解聚[12],影响神经元树突棘正常的结构和功能,而且使谷氨酸能和 γ-氨基丁酸能突触传递减少[22],最终导致大脑高级功能障碍。
