紫外分光光度法快速测定庆大霉素C1a含量在高通量筛选中的应用
2019-01-30田江涛李敏超杭海峰郭美锦储炬庄英萍
田江涛 李敏超 杭海峰 郭美锦 储炬 庄英萍
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
庆大霉素(gentamicin, GM)属于氨基糖苷类抗生素,对革兰阳性菌和阴性菌具有广谱抗菌活性[1]。庆大霉素C1a是庆大霉素单组分之一,是合成依替米星(etimicin, ETM)的重要前体物质[2],依替米星具有抗菌活性高、疗效好、低毒性等优点而备受关注[3-6]。目前庆大霉素C1a主要通过庆大霉素多组分分离纯化得到,本实验室利用生产庆大霉素单组分C1a的绛红小单孢菌工程菌株,可发酵产出单一组分且含杂质较少的庆大霉素C1a。但该菌株产量较低,菌种稳定性差,影响发酵效益。
高通量筛选技术常用于药物筛选、微生物作用机理研究、酶制剂定量分析等[7-10]。在高通量筛选技术筛选庆大霉素C1a诱变菌株过程中,庆大霉素C1a的快速检测是影响高通量筛选效率的瓶颈。由于庆大霉素C组分的分子结构中不含共轭双键,无紫外吸收峰,不能使用常规的方法进行检测,目前应用庆大霉素的检测方法来测定庆大霉素C1a的含量[11]。庆大霉素检测方法有浊度法、生物法、高效液相色谱法、薄层层析法等。实验室常用的检测方法是柱前OPA衍生样品,使该样品具有官能团,然后通过高效液相色谱法测定其含量。在高通量筛选诱变菌株过程中,需要对多个样品进行处理,常规的检测方法不利于大量样品的快速检测,需要建立庆大霉素C1a的快速检测方法。
提高抗生素发酵生产效价的源头是获得高产菌株,近年来关于成功获得高产菌株的报道很多[12-15],但是关于庆大霉素单组分C1a生产菌诱变和高通量筛选的相关文献很少。
1 材料与方法
1.1 材料
1.1.1 出发菌株
绛红小单孢菌(Micromonospore purpurea)由河南仁华生物科技有限公司(平顶山)提供。
1.1.2 培养基
(1)斜面培养基组成(g/L):淀粉10,KNO31,K2HPO4·3H2O 0.3,MgSO4·7H2O 0.5,NaCl 0.5,L-天冬酰胺 0.02,CaCO31,麸皮17,琼脂粉14,pH7.8,121℃高压湿热灭菌30min。
(2)种子培养基(g/L):玉米粉15,淀粉10,葡萄糖1,低温豆粉10,蛋白胨2,KNO30.5,CaCO35,121℃高压湿热灭菌30min。
(3)发酵培养基(g/L):玉米粉15,淀粉31,葡萄糖5,高温豆粉31,CaCO31,羽毛粉2,KNO30.5,(NH4)2SO40.6,CoCl2·6H2O 0.01,121℃高压湿热灭菌30min。
(4)平板培养基(g/L):淀粉10,KNO31,K2HPO4·3H2O 0.3,MgSO4·7H2O 0.5,NaCl 0.5,L-天冬酰胺 0.02,CaCO31,麸皮17,琼脂粉14,pH7.8,121℃高压湿热灭菌30min。
1.1.3 试剂
庆大霉素C1a标准品(河南仁华生物科技有限公司,纯度为91.59%);硼酸(分析纯);硫酸(分析纯)配制成质量分数为50%的溶液;磷钨酸钠(分析纯)配制成1×10-2g/mL水溶液;庆大霉素C1a标准溶液浓度为1000u/mL。
1.2 方法
1.2.1 庆大霉素C1a含量测定(紫外分光光度法)
(1)发酵液预处理:将一定质量的草酸加入发酵液中,玻璃棒搅拌,测得pH值为4.0~5.0,用胶头滴管滴加50%硫酸溶液,使pH值为1.5~1.7之间。40℃水浴锅中反应1h。将酸化的发酵液加入10mL离心管,放入低速离心机中,转速为4000r/min,离心10min,取上清液,待用。
(2)检测波长确定:分别取1.5mL pH值为3的磷钨酸钠水溶液与1.5mL pH值为3的酸化后发酵液上清液,加入100mL的容量瓶中,混合均匀,定容至100mL。各取200μL样品加入96孔石英酶标板中,在酶标仪中进行光谱扫描,测定不同波长条件下磷钨酸钠溶液和发酵上清液的吸光值。通过特征吸收峰的最大吸光值确定检测波长。
(3)反应温度和反应时间的确定:在100mL容量瓶中加入1.5mL磷钨酸钠溶液与1mL庆大霉素C1a标准品溶液,定容至100mL。将反应温度设置为15、25和30℃。在波长为248nm条件下,测定反应时间为2、4、8、16、30和60min的上清液吸光值。
(4)标准工作曲线的建立:分别取0.1~2mL效价为1000u/mL的庆大霉素C1a标准溶液,放置于100mL容量瓶中,加入1.5mL浓度为1×10-2g/mL的磷钨酸钠水溶液,定容至100mL,静置0.5h,取200μL上清液,置于96孔石英酶标板中,在248nm的波长条件下测定上清液的吸光值。以庆大霉素C1a效价为横坐标,吸光值为纵坐标,制作磷钨酸钠吸光度与庆大霉素C1a效价的标准曲线。
1.2.2 庆大霉素C1a含量测定(高效液相色谱法)
按照中国药典2015年版,高效液相色谱法(通则0512)测定庆大霉素C组分含量的方法测定其含量[11]。
1.2.3 菌种的不同诱变方法
(1)ARTP诱变:通过血球计数板对孢子悬浮液进行计数,制备108个/mL的单孢子悬浮液。用移液枪取20μL均匀涂布在铁环中央,在诱变距离为2mm条件下,参考ARTP诱变的相关文献[16],设定诱变时间为30、60、90、120、150、180和300s,对照组不进行照射诱变。取980μL的无菌水,将铁环的孢子清洗至1.5mL离心管中,分别将对照组和实验组的孢子悬浮液进行梯度稀释,取每个浓度梯度100μL菌液均匀涂布于筛选平板中,每个浓度梯度做3组平行实验。在36℃,湿度40%~60%条件下,培养10d。培养结束后,对同浓度梯度培养皿中的菌落数进行计数,计算诱变致死率。将对照组的单菌落与诱变菌株单菌落分别接入含有种子培养基的24孔板中,设置温度为36℃,湿度40%~60%,摇床转速为250r/min,培养48h;以10%的接种量,接入对应的24孔板发酵培养基中,设置温度为36℃,湿度40%~60%,摇床转速为250r/min,培养96h。对发酵产物进行酸化处理,通过紫外分光光度法,快速测定样品的含量。对数据进行统计分析,计算正突变率,确定ARTP诱变时间。
(2)微波诱变:在超净工作台中,取100μL的108个/mL单孢子悬浮液置于1.5mL的EP管中,放入微波炉中,设定功率为600W,参考微波诱变的相关文献[17],设定诱变时间为30、60、90、120、150、180和300s。取900μL的无菌水将诱变菌株洗出,将未诱变孢子悬浮液和不同诱变时间的菌体进行梯度稀释,每个梯度的悬浮液取100μL均匀涂布于筛选平板中,每个浓度梯度做3组平行实验。在36℃,湿度40%~60%的条件下,培养10d。培养结束后,对同浓度梯度培养皿中的菌落数进行计数,计算诱变致死率。将单菌落接入24孔板中进行培养,测定庆大霉素C1a的含量,统计获得正突变株的个数,计算微波诱变的正突变率,确定微波诱变时间。
(3)LiCl诱变:在超净工作台中,在1.5mL的EP管中加入500μL浓度为20%的氯化锂溶液和500μL孢子数为108个/mL的单孢子悬浮液。诱变时间分别为5、10、15和20min。吸取100μL不同诱变时间的单孢子悬浮液,涂布于筛选培养基中,通过培养获得单菌落,计算致死率。单菌落在24孔板培养,测定样品含量,计算正突变率,从而确定LiCl诱变时间。
(4)ARTP和LiCl复合诱变
将500μL浓度为10%的氯化锂溶液加入500μL孢子数为108个/mL的单孢子悬浮液中,振荡混合5min,取20μL的LiCl诱变的单孢子悬浮液进行ARTP诱变,诱变时间为60、90、120、150和180s。通过梯度稀释的方式将复合诱变的单孢子悬浮液稀释至103个/mL,取100μL加入筛选培养基中。计算致死率和正突变率。确定ARTP和LiCl复合诱变的条件。
1.2.4 高通量筛选诱变菌株
(1)初筛:将浓度为108个/mL的单孢子悬浮液,通过不同方式进行诱变。稀释一定倍数,分散涂于平板培养基中进行培养。挑选生长旺盛,面积小且突起的孢子,接入24孔板中进行种子培养43h。一方面以10%的接种量接入24孔板发酵培养基进行发酵培养;另一方面取100μL种子液,接入孔板斜面中,进行斜面培养。通过紫外分光光度法,快速检测24孔板中发酵液效价,标注产量高于对照组的菌株所对应的孔板斜面,进行复筛。
(2)复筛:将初筛获得的高产菌株与对照组菌株的斜面接入500mL三角瓶中,进行摇瓶培养。通过紫外分光光度法检测摇瓶中庆大霉素C1a的含量,筛选含量高于对照组效价10%的菌株进行下一步的菌株稳定性实验。
(3)稳定性验证:将高产的菌株进行传代培养,连续培养5代,记录每一代的效价变化。挑选稳定性好且效价高的诱变菌株。将活化的种子,按照10%的接种量,加入发酵摇瓶中进行第一代培养。发酵进行48h时,在超净工作台中,取出对数期的种子液,按照10%的接种量,加入发酵摇瓶中,进行第二代培养。第一代发酵培养96h后,检测发酵产物效价,连续进行五代培养。
1.2.5 高产稳定性菌株5L发酵罐培养
在5L发酵罐中,对高产稳定性菌株和出发菌株进行分 批发酵。通过测定菌浓、残糖量、摄氧率(oxygen uptake rate, OUR)、溶氧和产物效价等过程参数,考察诱变菌株的代谢特性,初步分析高产原因。
2 实验结果与讨论
2.1 庆大霉素C1a快速检测方法的建立
2.1.1 反应上清液pH对吸光度的影响
通过滴加H2SO4和NaOH溶液调节磷钨酸钠溶液与庆大霉素C1a标准液的反应上清液的pH值。不同pH磷钨酸钠反应上清液吸光值的光谱扫描图如图1所示。
实验结果表明,pH为1时吸收峰在265nm处;当pH为2时,吸收峰在255nm处;pH在3~7的范围内,反应上清液吸收峰在248nm;当pH值大于7时,上清液无特征吸收峰,庆大霉素C1a与磷钨酸钠溶液反应不产生白色沉淀物质。上述结论与pH对紫外分光光度法检测庆大霉素波长的影响基本一致[18]。另一方面pH在3~6时,特征吸收峰在248nm的反应体系比较稳定,特征峰的吸光值和波长变化不大。当样品与磷钨酸钠反应后pH值为3~6时,该方法可适用于反应体系的检测。
2.1.2 检测波长确定
对pH值为3的磷钨酸钠溶液和发酵上清液进行光谱扫描,根据磷钨酸钠溶液的特征吸收峰来确定检测波长。实验结果如图2所示。
实验结果表明在波长为240~260nm范围内,磷钨酸钠溶液具有特征吸收峰,发酵上清液则没有吸收峰。并且在波长为248nm时,磷钨酸钠与发酵液的吸光度差值最大。因此确定合适的测定波长为248nm。

图1 不同pH条件下反应上清液的光谱扫描图Fig.1 The spectra of the supernatant with different pH values

图2 不同波长条件下的吸光度Fig.2 The absorbance at different wavelengths

表1 温度和时间反应变化对吸光度的影响Tab.1 The effects of temperature and reaction time on absorbance
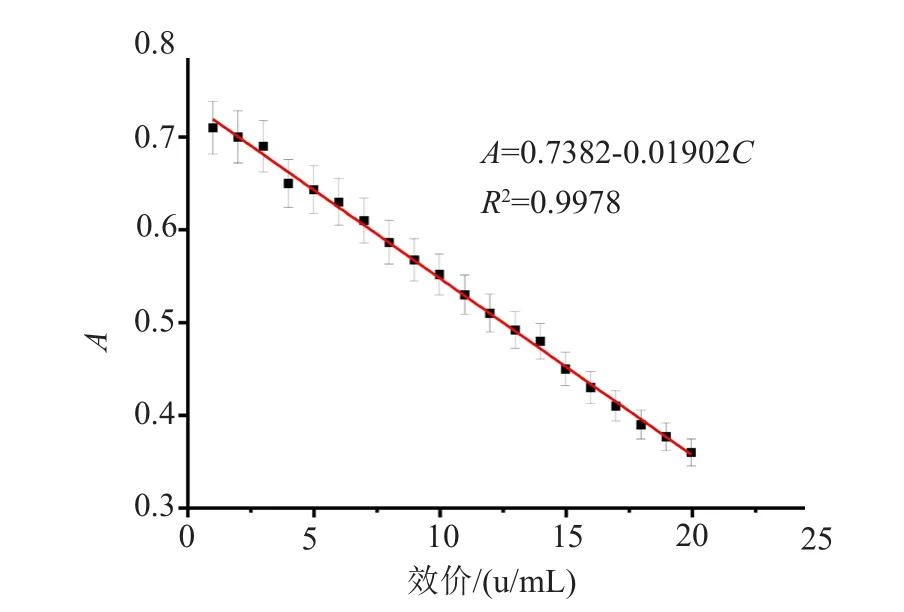
图3 分光光度法庆大霉素C1a测定标准曲线Fig.3 The standard curve of gentamicin C1a detection by spectrophotometry
2.1.3 反应时间和反应温度对吸光值的影响
反应时间和温度是影响化学反应达到平衡的两个重要因素。庆大霉素C1a与磷钨酸钠溶液反应,生成白色沉淀物质。在反应过程中反应速度与反应温度有关,产物稳定性与反应时间相关。实验结果如表1所示,在相同反应时间条件下,不同温度的吸光度数值无明显变化,可以将室温(25℃)作为反应温度。在一定温度条件下吸光度随着时间的增加而逐渐减小,在30min时,吸光值趋于恒定值。在最初的几分钟,吸光值下降较快,说明溶液快速反应,反应体系不稳定,在30min之后,吸光值保持一定值,溶液稳定。综上所述,确定反应液的反应温度为室温(25℃),反应时间为30min。实验结果与相关文献报道结果相同[18]。
2.1.4 庆大霉素C1a标准工作曲线
在波长为248nm条件下测定磷钨酸钠与庆大霉素C1a反应上清液的吸光值。以庆大霉素C1a效价为横坐标,上清液的吸光度为纵坐标,绘制庆大霉素C1a的标准工作曲线。
由图3可知,当庆大霉素C1a浓度为0~20u/mL时,庆大霉素C1a浓度与在波长为248nm时的吸光度有较高的线性关系。庆大霉素C1a的含量越高时,上清液的吸光度越小。线性方程式如式(1)所示,其中C为庆大霉素C1a的浓度u/mL,A为与磷钨酸钠反应后上清液吸光度,相关系数为0.9978。在波长为248nm时,通过测定反应上清液的吸光度,可以计算庆大霉素C1a的浓度。

2.1.5 高效液相色谱法与紫外分光光度法的比较
通过高效液相色谱法与紫外分光光度法分别测定发酵液中庆大霉素C1a的含量。两种不同检测方法的实验结果如表2所示,最大相对误差为3.98%。两种不同的检测方法具有一致性。紫外分光光度法具有较高的准确性,检测速度快,可以应用于高通量筛选和诱变菌株的稳定性实验。
2.2 菌株的不同诱变方式
2.2.1 ARTP诱变
使用常温室压等离子体仪器对绛红小单孢菌进行诱变,在其等离子发射源与单孢子悬浮液的距离,气体流速,输出功率等参数一定的条件下,通过改变诱变时间,进行诱变实验。诱变使用的工作气体为高纯氮(99.99%),产生的等离子体温度控制在25~35℃之间。通过计算菌体致死率,确定诱变时间。
实验结果如图4所示:随着诱变时间的增加,孢子致死率增加,90s之前ARTP对孢子的诱变效果明显。在120s时,致死率高达95%,180s后孢子致死率达到100%,选择诱变时间为120s。
2.2.2 微波诱变
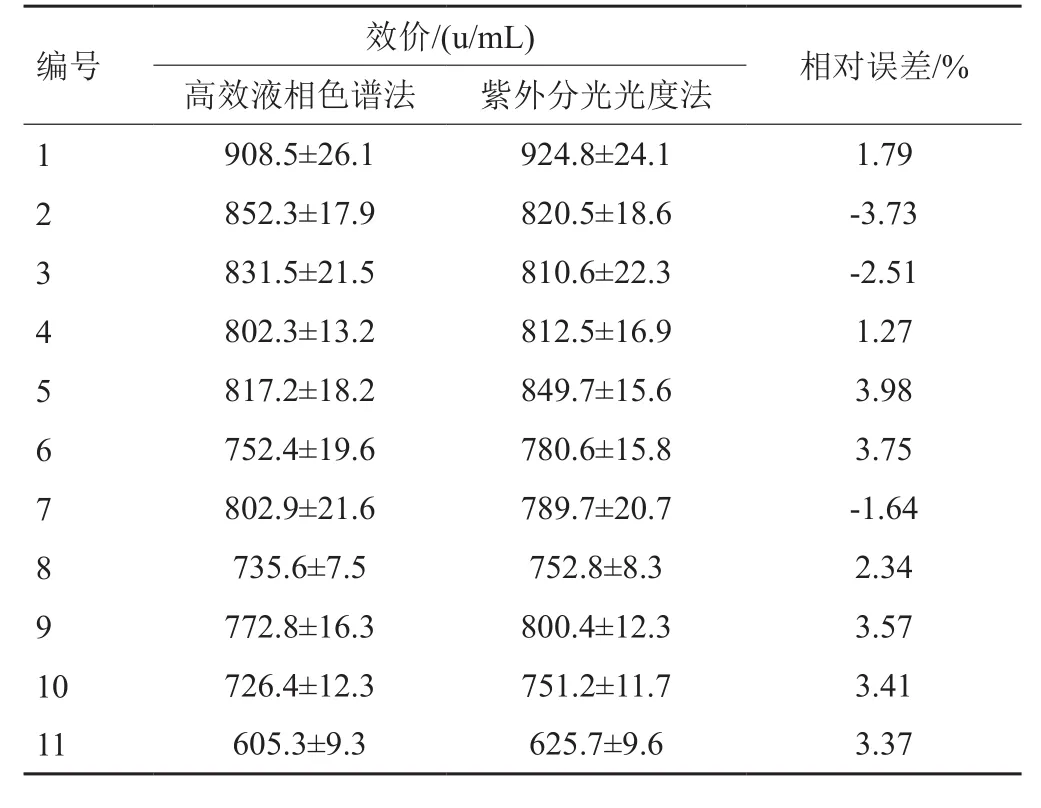
表2 高效液相色谱法和分光光度法测定发酵液中庆大霉素C1a含量的比较Tab. 2 Comparison of the gentamicin C1a contents in the broth determined by HPLC and spectrophotometry
在一定功率条件下,通过改变诱变时间,对单孢子悬浮液进行微波诱变,获得高产诱变单菌落。通过计算诱变致死率,确定微波诱变时间。

图4 ARTP诱变孢子致死率Fig.4 Lethality rate of the spores by ARTP
微波诱变实验结果如图5所示,随着诱变时间增加,致死率升高,在150s之后致死率接近于100%。当诱变致死率达到90%时,微波诱变时间为135s。
2.2.3 氯化锂诱变
使用20%氯化锂诱变试剂与庆大霉素C1a单孢子悬浮液作用,随着作用时间的增加,突变率增大。如图6所示,当诱变时间为20min后,菌体致死率只有10%,远远小于ARTP和微波诱变方式的致死率。说明通过氯化锂单一诱变方式诱变庆大霉素C1a菌种,致死率低,产生高产菌株的概率小。可以采取ARTP+LiCl的复合诱变方式,对菌株进行诱变。
2.2.4 复合诱变
通过ARTP与LiCl复合诱变的方式,对庆大霉素C1a单孢子悬浮液进行诱变。通过计算致死率,确定复合诱变时间。如图7所示,样品菌种致死率随着诱变时间的增加而提高,当诱变时间为120s时,致死率高达 98%,150s时,致死率为100%。

图5 微波诱变孢子致死率Fig.5 Lethality rate of the spores by microwave
诱变时间的确定:当致死率达到90%时,ARTP诱变时间在90s到120s之间。复合诱变过程中加入化学试剂LiCl,可以提高菌体致死率,在90s之前高致死率的现象明显,确定诱变时间为110s。

图6 氯化锂诱变孢子致死率Fig.6 Lethality rate of the spores by LiCl

图7 ARTP和LiCl复合诱变孢子致死率Fig.7 Lethality rate of the spores by the combination of ARTP and LiCl
2.3 诱变菌株高通量筛选
2.3.1 初筛
通过快速检测的方法测定发酵液效价,标记高产菌株。通过不同诱变方式获得2336株诱变菌株,经过24孔板培养进行初步筛选,测定结果如图8所示。其中含量高于对照组诱变菌株共计475株,效价高于对照组10%的高产菌株有221株,其中最高效价为925u/mL,该高产菌株是通过LiCl和ARTP复合诱变获得,多数诱变菌株发酵的效价低于对照组(625.7u/mL)。
2.3.2 复筛
对初筛高于对照组效价10%的诱变菌株进行编号。其中编号为A101-A140和A201-A250是ARTP诱变方式的高产菌株,共计90株;W101-W130和W201-W228为微波诱变方式的高产菌株,共计58株;L1-L8为LiCl诱变方式的高产菌株,共计8株;AL101-AL120、AL201-A220和AL301-AL325为ARTP+LiCl复合诱变方式的高产菌株,共计65株。对初筛获得的221株高产菌株进行摇瓶复筛,结果如图9所示,得到高于对照组效价10%以上的突变株10株。其中复筛最高效价为950u/mL,编号为AL324。
2.3.3 庆大霉素C1a初筛、复筛实验数据汇总

图8 4种不同诱变方式的24孔板初筛结果Fig.8 The results of 4 different mutation methods with 24 MTPs in preliminary screening process
通过上述4种不同诱变方式,共计获得2336株诱变菌株,如表3所示,其中ARTP诱变方式为841株,微波诱变方式为623株,LiCl诱变方式为452株,ARTP和LiCl复合诱变420株。正突变率分别为23%、20%、4%和33%,高产菌分别为193株、125株、18株和139株,共计475株。含量高于对照组含量10%的菌株为221株。其中LiCl诱变方式致死率最低,致死率仅为10%。实验结果表明,在庆大霉素C1a菌种诱变中,LiCl只能作为辅助诱变剂使用且正突变最低。不同诱变方式的正突变株的最高效价分别为821、793、732和925u/mL,通过ARTP和LiCl复合诱变方式获得的突变菌效价最高,与对照相比产量提高48%。采用复合诱变(ARTP+LiCl)的方式诱变菌株,正突变率较高。王风芹等[19]通过ARTP和亚硝基胍对兼性厌氧产丁醇芽孢杆菌(Bacillussp.)C2菌株进行复合诱变,获得了高产菌株。

图9 4种不同诱变方式的摇瓶复筛结果Fig.9 The results of 4 different mutation methods with shake flask in rescreening process

表3 不同诱变方式的初筛数据Tab. 3 The data summary of different mutation methods in preliminary screening process
通过摇瓶复筛筛选出10株效价高于对照组10%效价的诱变菌株。其中ARTP诱变方式为2株,微波诱变方式为2株,LiCl诱变方式为1株,ARTP+LiCl复合诱变方式为5株。通过摇瓶培养进行复筛实验,在10株高产诱变菌株中,ARTP+LiCl复合诱变方式获得的菌株最高效价950u/mL,编号为AL324,比出发菌株提高了52%,该诱变方式可以较大概率获得高产菌株。这10株诱变菌株编号分别为A114、A213、W112、W127、L7、AL109、AL120、AL205、AL217和AL324。
2.4 高产菌株稳定性验证实验
将复筛得到的10株高产菌株进行稳定性验证实验。将种子培养液按照10%的接种量加入发酵摇瓶中进行连续5代的培养实验,验证菌株的稳定性。通过紫外分光光度法快速测定发酵液效价,结果如图10所示:AL324、AL120、AL205和AL217在培养5代过程中,产物效价比较稳定,可以作为高产菌株进行后续相关研究。A114、A213、W112、W127、L7和AL109在培养2~3代之后,产物效价有大幅度的减少,其中A114、A213、W112、AL109效价与对照组效价(600u/mL)接近,而W127、L7低于对照组效价,这可能是由于在连续培养过程中菌种产生回复突变造成的[20]。
2.5 高产菌株5L发酵罐验证
由摇瓶复筛的结果可知,AL324菌株的发酵单位最高,经过5次传代稳定性考察,产物浓度基本保持在900u/mL以上。而AL120、AL205、A217经过5次传代虽然发酵效价保持在800u/mL,但是明显低于AL324高产菌株。鉴于此,在5L发酵罐上进行验证实验采用出发菌株作为对照组(control),AL324作为实验组,考察高产菌株代谢性能变化。
图11为高产菌株与出发菌株过程参数对比曲线图,分别对比了在5L发酵罐培养过程中的菌浓、残糖、OUR、溶氧和庆大霉素C1a的发酵单位。由图11A可知,出发菌株与高产菌株在发酵过程中菌浓并没有明显差异;图11B中可知,高产菌株残糖下降速率明显高于出发菌株,而在过程曲线图11C中也明显看到高产菌株耗氧能力明显强于出发菌株,在40h前高产菌株的OUR明显高于出发菌株;从图11E中可以看出C1a含量AL324菌株明显高于出发菌株,发酵96h后AL324效价能达到1193u/mL,比对照组效价提高了81.3%。综合各曲线图分析表明,高产菌株AL324代谢活性要高于出发菌株。
3 结论

图10 高产稳定性菌株验证实验Fig.10 The genetic stability verification with high yield GM C1a mutants
为了得到高产的庆大霉素C1a生产菌株,本论文建立了庆大霉素C1a的快速检测方法,在此基础上采用ARTP等诱变方法和高通量筛选技术获得了高产稳定的菌株。

图11 高产菌株AL324与出发菌株过程参数对比图Fig.11 The comparison of the process parameter between the high yield mutant of AL324 and the parent strain
(1)建立了紫外分光光度法测定庆大霉素C1a含量的快速检测方法。磷钨酸钠在248nm紫外波长条件下有特征吸收峰,磷钨酸钠与庆大霉素C1a能发生反应生成白色沉淀物质,通过测定反应上清液的吸光值,可以计算庆大霉素C1a的含量。结果表明,反应上清液吸光值与庆大霉素C1a效价具有线性关系,相关系数为0.9978。与高效液相色谱法对比,该方法的最大相对误差为3.98%,说明本文建立的庆大霉素C1a快速检测方法的有效性。
(2)考察了庆大霉素C1a菌株的不同诱变方法(ARTP、微波、LiCl和ARTP+LiCl),并通过高通量筛选获得了高产稳定的菌株。通过对2336株菌株的初筛,获得了221株产量提高10%以上的菌种,通过摇瓶复筛获得了10株菌株,其中ARTP+LiCl复合诱变产生的AL324菌株摇瓶效价提高了52%,复合诱变的正突变率较高。然后进行稳定性传代实验,获得了4株高产稳定性菌株。在5L发酵罐验证实验中,AL324菌株效价比出发菌株提高了81.3%。
