遗传改造刺糖多孢菌菌株生产多杀菌素J和L
2019-01-30党福军王继栋覃重军夏海洋
党福军 王继栋 覃重军 夏海洋,*
(1 中国科学院上海生命科学研究院植物生理生态研究所合成生物学重点实验室,上海 200032;2 浙江省抗真菌药物重点实验室,浙江海正药业股份有限公司,台州 317000)
刺糖多孢菌(Saccharopolyspora spinosa)发酵产生多杀菌素(spinosyn)家族的具有杀虫活性的化合物(图1),其中以多杀菌素A和D活性最高,多杀菌素A和D的混合物开发成spinosad杀虫剂,因其独特的杀虫机理、对人畜及天敌安全及环境友好等特性,获1999年美国总统绿色化学品挑战奖[1]。由刺糖多孢菌突变株发酵产生的多杀菌素J和L,经过化学修饰变成新型杀虫剂乙基多杀菌素(spinetoram, 图1),对多杀菌素不能防治的仁果类食心虫苹果小卷叶蛾(Cydia pomonella)有特效,其杀虫谱比多杀菌素更广,具有对主要有益昆虫影响更小,单位面积用量更低,在环境中残留期短等优点,也被称为第二代多杀菌素,获得了2008美国总统绿色化学品挑战奖[2-4]。
多杀菌素J和L与多杀菌素A和D结构上的差异为鼠李糖残基上3'-O位点上甲基(图1)。2001年,多杀菌素生物合成基因簇被报道(Genbank索取号:AY007564)[5-6],2011年刺糖多孢菌基因组测序后(Genbank索取号:NZ_AEYC00000000.1)[7],本文在原报道的多杀菌素生物合成基因簇基础上拼接出图2基因簇结构,基因簇的两侧分别有可能的lacI和tetR家族的调控基因。前人研究证实其生物合成基因簇中spnI编码鼠李糖2'-O-甲基转移酶,spnK编码鼠李糖3'-O-甲基转移酶,spnH编码鼠李糖4'-O-甲基转移酶,分别参与多杀菌素鼠李糖残基上不同位点的甲基化修饰,spnK突变株可产生多杀菌素J和L[8-9]。
由于刺糖多孢菌遗传操作困难,本实验室前期通过发掘糖多孢菌遗传因子建立了刺糖多孢菌的位点特异性整合体系[10],积累了大量的刺糖多孢菌遗传操作经验。本文在构建刺糖多孢菌黏粒文库基础上,结合λ-Red和FLP位点特异性重组酶介导的体内重组,建立了刺糖多孢菌的基因敲除技术。通过去除spnK编码保守区域序列,在工业菌株中构建了spnK失活的突变株,突变菌株可以大量产生多杀菌素J和L。
1 材料与方法
1.1 菌株和质粒
本试验使用的菌株和质粒见表1。刺糖多孢菌(S.spinosa)工业菌株SN1303由浙江海正药业股份有限公司提供。
1.2 DNA基本操作和常规试剂
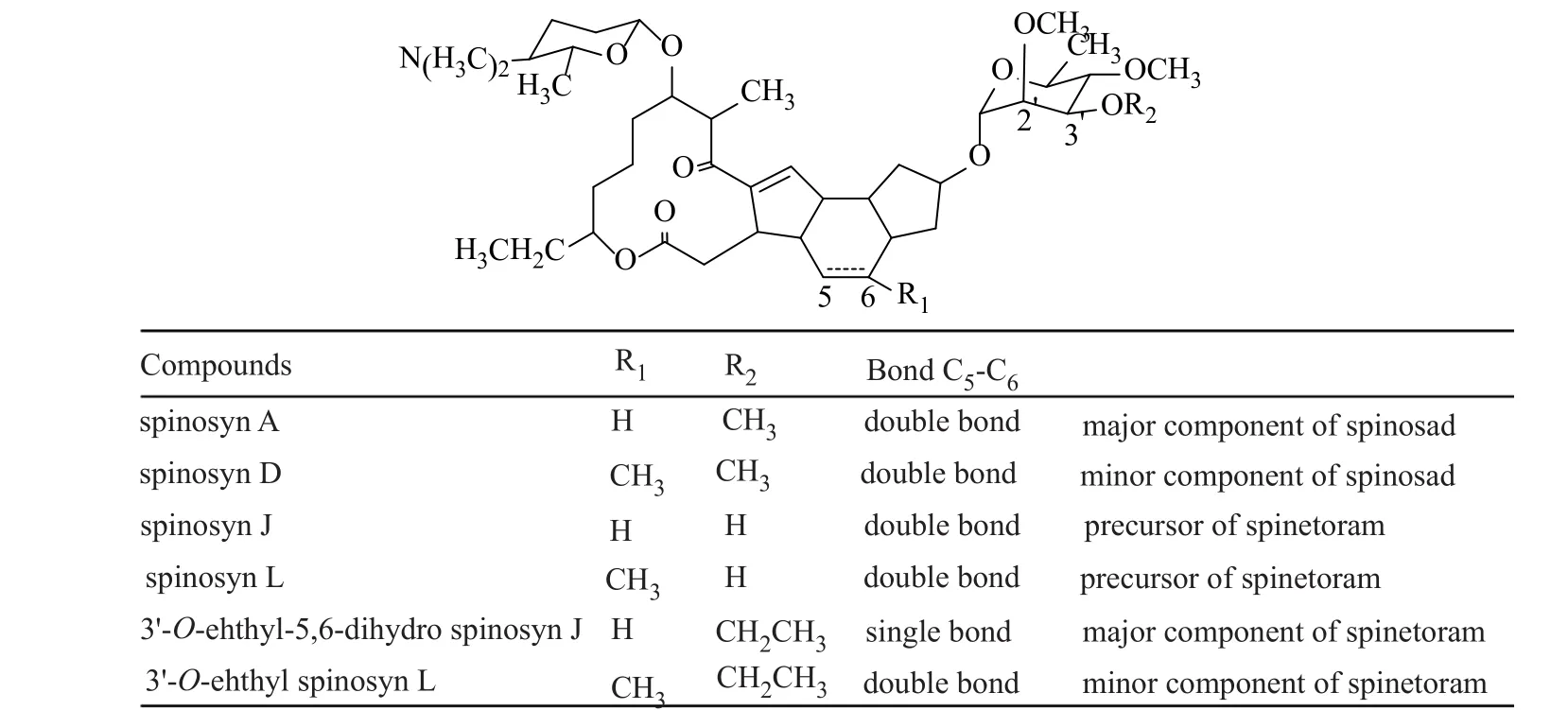
图1 多杀菌素系列化合物结构Fig.1 The chemical structures of spinosyn and its derivative

图2 刺糖多孢菌中多杀菌素生物合成基因簇及侧翼基因Fig.2 Spore biosynthetic gene clusters and flanking genes in Saccharopolyspora spinosa
基因组DNA提取和PCR等操作技术见文献[13]。大肠埃希菌培养、质粒转化和刺糖多孢菌基因组文库构建等基本操作技术参考文献说明进行[14]。大肠埃希菌和刺糖多孢菌接合转移的方法参见文献[10]。λ-Red介导的体内重组、FLP介导的位点特异性重组切除抗性表达盒等操作按照文献描述进行[11,15]。所用抗生素如氯霉素、壮观霉素、潮霉素和阿泊拉霉素等,购于Sigma-Aldrich公司;其他生化和化学试剂购于上海生物工程公司。本研究中所用酶购于赛默飞世尔科技(中国)有限公司。PCR扩增所用引物序列及其用途见表2。

表1 本研究所用菌株和质粒Tab. 1 Strains and plasmids used in this study
1.3 spnK基因失活载体的构建和突变株的获得
将spnK基因编码的氨基酸序列与其他O-甲基转移酶序列比对,选取覆盖活性中心的保守的41aa对应的123bp序列作为替换失活靶点,以此来构建spnK失活载体(图3)。以pHY778中的FRT-aadA-FRT为模板,利用引物PSN23/PSN24扩增出抗性盒,借助λ-Red置换柯斯黏粒pXSC10[插入部分覆盖了多杀菌素合成基因簇(Genbank索取号:AY007564)中<1~29972bp区域的黏粒]中spnK基因内部123bp目标区域,获得中间载体pXS2324;将pXS2324转化入BT340菌株,借助FLP诱导重组,去除aadA抗性表达盒,从而获得由FRT重组后81bp的SCAR序列替换spnK基因内123bp保守区域的失活载体pXS2324M。通过接合转移将pXS2324M导入刺糖多孢菌SN1303中,获得阳性接合子;阳性接合子非抗性选择培养一代后,挑选抗性丢失菌株,PCR扩增筛选出spnK失活突变株,并通过测序证实靶标区域的改变。

表2 本研究所用PCR引物Tab. 2 Primers used in this study
1.4 刺糖多孢菌发酵及产物分离分析
刺糖多孢菌斜面培养使用牛奶培养基(全脂奶粉20g/L,酵母抽提物3g/L,葡萄糖5g/L,琼脂20g/L),30℃培养7d;适量孢子接入种子培养基(全脂奶粉1%,葡萄糖1%,酵母抽提粉0.5%,蛋白胨0.5%),置摇床中250r/min,28℃培养72h;按接种量10%将种子培养物转接到发酵培养基(全脂奶粉1%,葡萄糖10%,酵母抽提粉0.5%,蛋白胨1%,豆油1%,K2HPO40.1%,CaCO30.5%),置摇床中250r/min,28℃培养8d,取样分析。

图3 SpnK保守结构域失活示意图Fig.3 The schematic graph of inactivation the conserved domain of SpnK

图4 基于黏粒文库的基因敲除Fig.4 Gene replacement on the basis of cosmid library
取2mL发酵液加入4mL无水甲醇,超声波处理0.5~1h,12000r/min离心10min,取上清液直接用于HPLC分析。HPLC分析条件:Agilent Zorbax Eclipse XDB-C8(4.6mm×150mm, 5μm;货号:993967-906)色谱柱,检测波长246nm;流动相甲醇:乙腈:水(含0.05%乙酸铵)=45:45:10;流速1.0mL/min。目标产物LC-MS分析,产物纯化后NMR结构确认均由海正药业中央研究院分析测试中心完成。
2 结果与分析
2.1 刺糖多孢菌基因敲除体系建立
利用图4A所示的黏粒载体pHX31,构建刺糖多孢菌的基因组文库,通过PCR筛选,获得了覆盖多杀菌素生物合成基因簇的黏粒,其中黏粒pXSC10覆盖了基因簇(Genbank索取号:AY007564)中<1~29972bp区域,覆盖了我们拼接出的多杀菌素生物合成基因簇(图2)附近的tetR基因(sspn_RS0122895,位于Genbank索取号:NZ_GL877879,S. spinosaNRRL 18395基因组Scaffold000002序列中851038..851640 nt),因此我们选择该tetR基因测试敲除效率。通过利用来自质粒pSN09的FRT-hyg-FRT抗性表达盒替换黏粒pXSC10上的tetR,获得质粒pCM232。进一步通过接合转移将pCM232导入刺糖多孢菌SN1303中,筛选潮霉素抗性接合子。
随机挑选6个纯化后的潮霉素抗性接合子(命名CM232-1~6),分别涂布含潮霉素和阿泊拉霉素平板,检测菌株的生长,并通过PCR检测目标基因的替换情况,结果显示(图4B),接合子1、3、4、6仅能扩增出替换后的条带,2和5还能扩增出未替换的条带,并且1、3、4、6仅能在含潮霉素平板生长,2和5可以在两种平板生长,因此计算tetR敲除效率可以达到66%。
2.2 spnK基因失活突变株的获得
将spnK基因失活载体pXS2324M通过接合转移方法导入刺糖多孢菌SN1303,非选择条件培养一轮后选择抗性丢失菌株,利用引物PSN26和P81F-1进行PCR扩增,图5的凝胶电泳结果显示,在可能的双交换突变株中,扩增出预期的1039bp条带。进一步用引物PSN25和PSN26扩增突变株染色体上的∆spnK完整片段,测序证实在突变株中spnK基因目的序列已按照预期被替换,阳性突变株命名为SN1306。将pXSC10通过结合转移导入突变株SN1306中,获得单交换的回补菌株SN1310。

图5 PCR扩增和电泳验证spnK基因敲除的突变株Fig.5 Agarose gel electrophoresis of PCR products from spnK null mutants
2.3 HPLC和LC-MS检测突变株的发酵产物
将出发菌株SN1303、突变株SN1306和回补菌株SN1310进行液体发酵,发酵液处理后利用高压液相色谱(HPLC)检测产多杀菌素情况(图6)。
HPLC结果显示,突变株SN1306产生了不同于多杀菌素A和D的发酵产物,且出峰时间提前。回补菌株SN1310虽然产量低于SN1303,但发酵产物组分相同,由此推测SN1306发酵产物的变化是由spnK基因的失活导致的。进一步利用HPLC-MS分析突变株SN1306发酵产生的两个主要产物compound I和II分子量分别为717和731(图6),比多杀菌素A(MW:731)和D(MW:745)的分子量分别相应的减少了14,刚好是一个甲基取代的分子量差异,与出发菌株相比,突变株发酵产物结构上可能是少了-CH3,结合文献比对,推测新生产的compound I和II分别为多杀菌素J和L。
2.4 NMR证实突变株发酵产物的结构
利用突变株SN1306发酵产物大量提取,通过柱层析、制备色谱等技术获得约8mg的compound I, 用HPLC-MS检测样品纯度可用于核磁共振(NMR)分析,13C NMR和1H NMR光谱分析数据如下表(表3)。
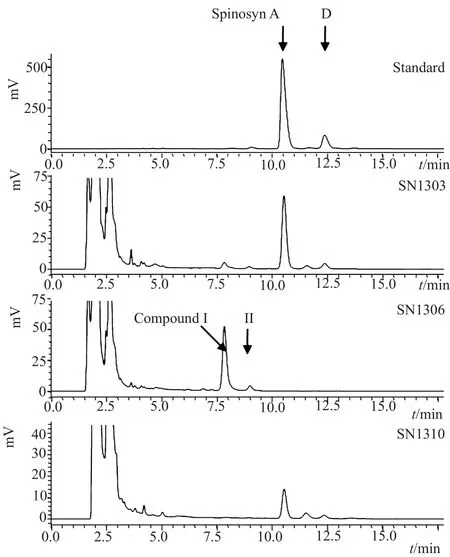
图6 HPLC检测菌株发酵产物Fig.6 HPLC chromatogram of fermentation products from different strains
比较Compound I与多杀菌素 A和D的13C NMR和1H NMR数据,显示compound I在鼠李糖3'-O位点上失去一个甲基,因此确定新合成的产物为多杀菌素J。结合HPLC-MS分析结果(图7),确认SN1306发酵的主要产物为多杀菌素J(compound I)和L(compound II)。
3 讨论
刺糖多孢菌基因操作困难,并且缺乏有效的基因敲除体系[16]。目前刺糖多孢菌中多通过插入失活方法获得突变株[6,8,16]。本文结合黏粒文库和λ-Red,建立了刺糖多孢菌的高效的基因敲除系统,测试对目标基因tetR的敲除效率可达66%,结合文献分析[11,15-16],认为敲除效率高的主要原因是黏粒上携带的长同两侧源臂,其可以大幅增加重组效率。本实验室后续的测试表明,3kb以上的同源臂可以实现在刺糖多孢菌中目标基因敲除(数据未显示)。
多杀菌素生物合成基因簇中spnJKL在同一个操纵子内,spnK的插入失活导致菌株检测不到产生多杀菌素类似物,可能由于插入产生的极性效应[5],因此要获得spnK失活不影响下游基因转录,需要采用阅读框内敲除策略。本文通过比较分析spnK基因编码氨基酸序列,选取保守活性结构域的编码序列(123bp)作为靶标,借助λ-Red和FLP重组构建了读框内失活spnk载体,获得的spnK突变株可产生乙基多杀菌素前体多杀菌素J和L,其发酵产量同出发菌株相近。因此利用该策略可以定向改造任何多杀菌素高产菌株,获得高产多杀菌素J和L的工程菌株。
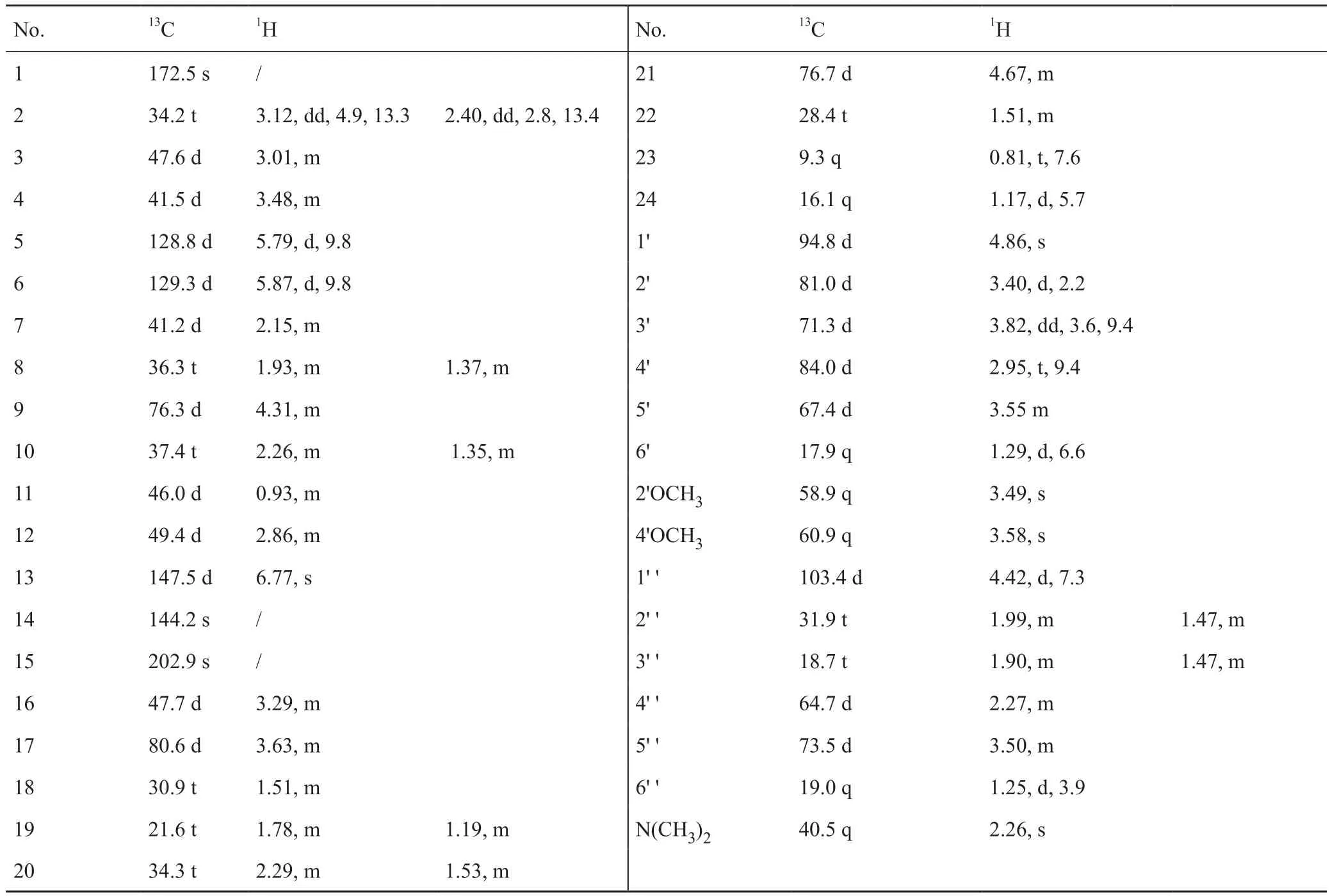
表3 SN1306产生的compound I的13C-NMR和1H-NMR数据Tab. 3 The 13C-NMR和1H-NMR data of compound I produced by strain SN1306
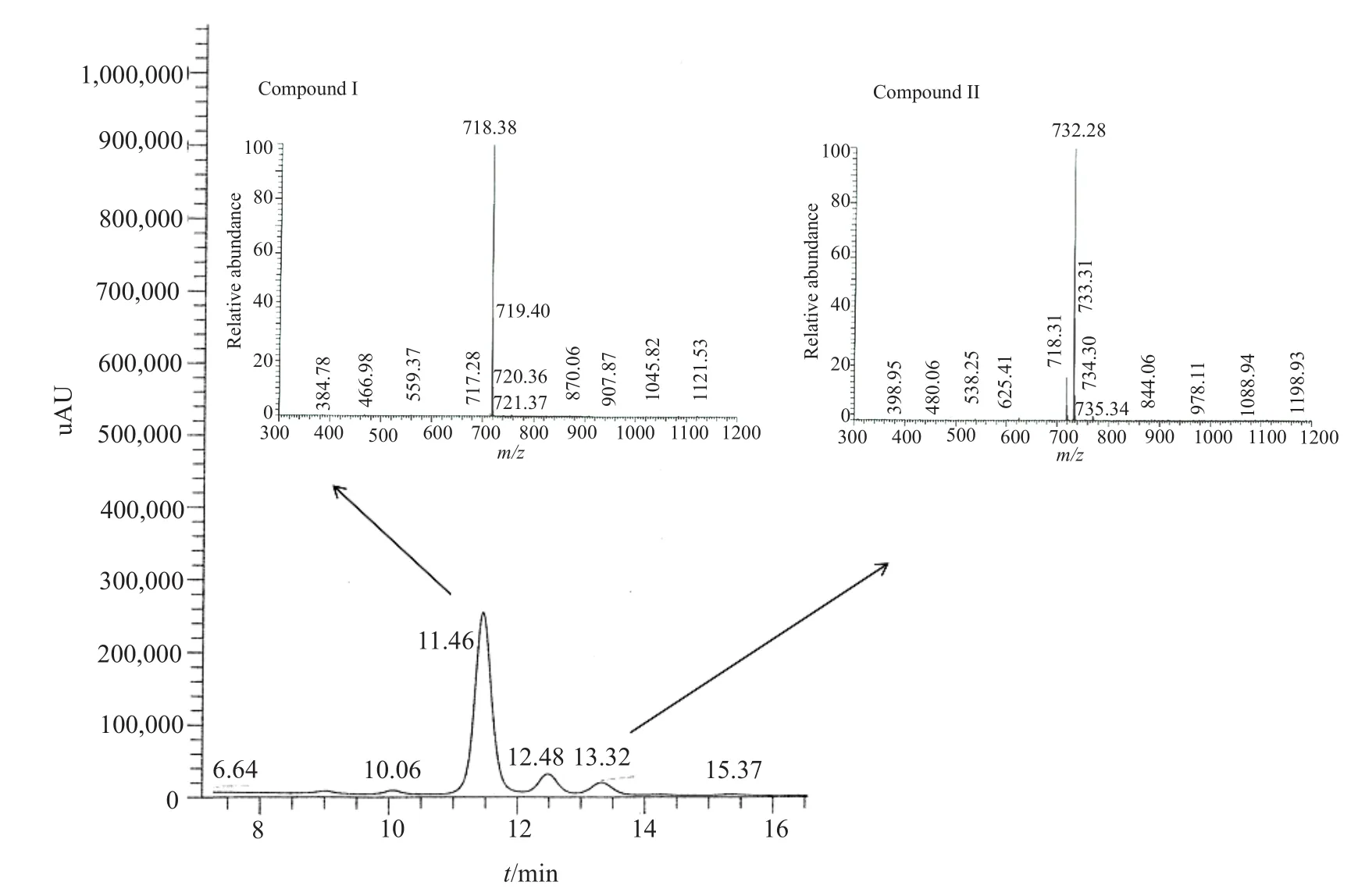
图7 菌株SN1306发酵代谢产物HPLC-MS图Fig.7 HPLC-MS chromatogram of metabolites from strain SN1306
