铜绿假单胞菌MexXY外排泵调控机制研究进展
2019-01-30鞠晓红王月华孙艳美
鞠晓红 王月华 孙艳美
(吉林医药学院,吉林 132013)
铜绿假单胞菌(Pseudomonas aeruginosa, PA)广泛存在于自然环境,是引起医院感染的重要条件致病菌,在免疫功能低下人群具有高感染性和高致死率特点。当生存环境发生改变,菌细胞为了维持自身平衡并在劣势环境中获得生存,许多正常条件下不表达或低表达基因被诱导性高表达,对抗环境压力。其中,耐药性变异是细菌最主要的生存手段。在铜绿假单胞菌众多耐药机制的研究中,RND家族的重要地位日益凸显,成为近年来的研究热点[1-3]。作为RND家族重要成员之一的MexXY外排泵,由于兼具组成性和诱导性表达双重性,在铜绿假单胞菌天然耐药和获得性耐药中均发挥重要作用。本文在简要介绍铜绿假单胞菌RND外排泵系统的基础上,重点对近年来有关MexXY表达调控机制的研究进展做一综述,以期为抗假单胞菌药物研制提供新靶点、为耐药逆转提供新思路。
1 铜绿假单胞菌RND外排泵系统简介
外排泵系统(efflux pump system)又称药物主动转运(active drug efflux)系统,由细菌染色体编码,在革兰阴性菌中普遍存在。根据超分子结构及序列同源性将外排泵分为5大家族,即RND家族、主要易化超家族(major facilitator superfamily, MFS)、多药和毒性化合物外排(multidrug and toxic compound extrusion, MATE)家族,小多重耐药家族(small multidrug resistance, SMR)和ATP结合盒(ATP-binding cassette, ABC)家族。目前,铜绿假单胞菌中发现的外排泵均属于RND家族,介导天然耐药和(或)获得性耐药,是其多重耐药和泛耐药的物质基础。功能性RND外排泵以跨膜的三聚体形式转运底物(图1),即位于细胞膜的RND转运子、位于周浆间隙的膜融合蛋白(membrane fusion protein, MFP)和位于外膜的通道蛋白(outer membrane protein, OMP)3部分组成,三聚体镶嵌在细胞的内外膜上形成外排孔道,减少有害物质在菌体内积聚。目前已命名的铜绿假单胞菌RND外排泵有12种,分别是MexAB-OprM、MexCDOprJ、MexEF-OprN、MexXY-OprM、MexJKOprM、MexVW-OprM、MexGHI-OpmD、MexMNOprM、MexPQ-OpmE、MuxABC-OpmB、TriABCOpmH和CzcCBA,前4种在临床耐药菌株中高表达最为常见[4-6]。其中,MexAB-OprM和MexXY-OprM在野生株中组成性低表达,诱导后高表达;MexCD-OprJ和MexEF-OprN属于诱导性表达。
4种临床常见高表达外排泵中,MexAB-OprM、MexCD-OprJ和MexXY-OprM属于负调节表达,分别受负调控蛋白MexR、NfxB和MexZ的调控,编码基因位于相应外排泵编码区上游,均与外排泵转录方向相反。MexEF-OprN属于正调节表达,受正调节蛋白MexT调控,编码基因亦位于外排泵上游,但与之转录方向一致。除此之外,RND外排泵还受到其他调节机制的调节,如群体感应系统、双组分系统以及生存环境等。由于MexXY利用MexAB系统的外膜蛋白OprM,故MexAB-OprM表达下调影响MexXY系统的表达水平,而MexAB-OprM、MexCD-OprJ和MexEF-OprN之间表达存在逆向关系,暗示RND外排系统的调控机制和调控网络极其严谨精密,各成员之间存在着极为复杂的相互关联。目前有关各外排泵之间调节表达相关性的研究较少,有待于进一步深入探讨,明确各成员之间的协同或拮抗关系及调控机制,为耐药控制提供思路。
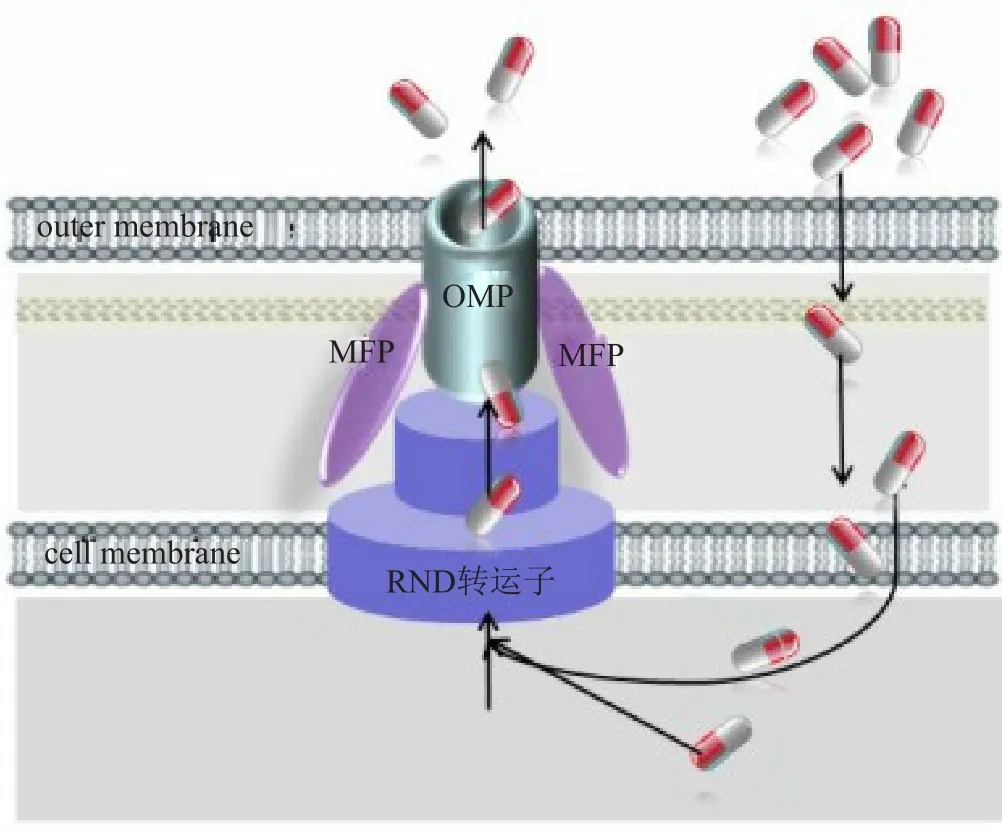
图1 铜绿假单胞菌RND外排泵结构示意图Fig.1 Schematic of RND effulx pump structure of Pseudomonas aeruginosa
2 MexXY外排泵结构与功能
MexXY外排泵发现于1999年,由mexXY操纵子编码,在野生株中低水平组成性表达,暴露于核糖体靶向药物后被诱导高表达[7]。mexXY操纵子全长5461bp,有2个开放阅读框(open reading framework,ORF):mexX(1170bp)和mexY(3141bp),分别编码膜融合蛋白MexX和RND转运子MexY。由图1可知,MexY位于细菌细胞膜上,由跨膜区域和突出周质区域两部分组成,利用质子驱动力为能量,识别并结合外排底物,决定外排底物的特异性;MexX位于菌细胞的周浆间隙,在形成功能性外排泵的动态过程中,诱导或稳定外膜蛋白的开放状态,同时包围在MexY外面,形成一个跨越整个周质通道的稳定复合物,将MexY识别的药物直接排出细胞外。MexX包含389个氨基酸残基,分子量约41KD,MexY包含1046个氨基酸残基,分子量约113KD。mexXY操纵子缺乏编码通道蛋白的基因,虽可利用OpmB、OpmG、OpmI等作为外膜蛋白,但最主要利用的是MexAB-OprM外排泵组成性表达的OprM,组成功能性MexXY-OprM三聚体,MexAB-OprM表达下调可降低MexXY外排泵表达水平。在PA7分支,mexXY操纵子有第3个ORF,编码OprM样蛋白OprA作为外膜通道蛋白,组成MexXY-OprA三聚体,OprA与伯克霍尔德菌属外排泵外膜蛋白高度同源[8]。
MexXY外排泵最主要的功能是通过外排胞内药物介导铜绿假单胞菌天然和获得性耐药,稳定高表达MexXY菌株对所有底物药物耐药性升高2~16倍。核糖体靶位药物(如四环素、庆大霉素、红霉素等)是诱导MexXY高表达的特异底物,外排氨基糖苷类、四环素类、大环内酯类、氟喹诺酮类、氯霉素、替加环素和两性离子型头孢菌素(头孢吡肟、头孢吡普)等抗菌药物。其中氨基糖苷类是MexXY专一的特异底物, 在MexY周质连接槽(periplasm-linked cleft)有其识别区,是氨基糖苷类耐药决定子[9-10]。MexXY还可作为MexAB-OprM的补偿机制协同外排氟喹诺酮类药物,导致该类药物耐药水平升高。高氧环境亦可诱导MexXY表达上调,囊性肺纤维化(CF)患者分离菌株稳定高表达MexXY,可能是细菌在局部活性氧富集环境下的应激反应[11-12]。由此推测,MexXY可能在细菌的抗氧化保护中亦发挥重要作用。
3 MexXY外排泵的表达及调控机制
MexXY外排泵表达受基因水平、转录水平和蛋白水平的复杂调控,任一环节突变都可能导致MexXY高表达。目前已鉴定的MexXY高产突变株有3型,分别是agrZ、agrW1和agrW2突变型[13]。agrZ型是负调控基因mexZ自身突变,导致基因失活或编码蛋白改变;agrW1型是各种原因导致的核糖体缺陷,通过PA5471通路解除MexZ蛋白的阻遏作用,本质上是对核糖体损伤的保护性应激反应;agrW2型与双组分系统ParRS突变有关。最近,Lau等[14]发现一条新的调控途径-AmgRS双组分系统,不依赖上述已知的调节基因,说明MexXY的表达调控可能还涉及更多的未知因素,在局部或全局水平发挥调节作用。
3.1 MexZ通路
MexZ蛋白是负调控基因mexZ的编码产物,属于TetR超家族转录调节子,包含178个氨基酸残基,分子量约19KD,N端有典型的DNA结合域,即高度保守的螺旋-转角-螺旋基序,强效抑制mexXY转录。编码基因mexZ位于mexXY操纵子上游,是mexXY的转录抑制子。无诱导因素存在时,MexZ以同源二聚体形式结合在mexX上游的mexZ~mexX间隔区域DNA上,结合位点是mexX翻译起始点上游-104~66bp之间的20bp回文序列,mexXY启动子所在区域[15]。MexZ直接抑制mexXY转录或通过阻断RNA聚合酶进入启动子结合点阻遏mexXY操纵子转录。各种原因诱导mexZ变异、MexZ结合DNA能力下降或mexZ~mexX间隔区DNA突变,均可解除MexZ的抑制,暴露mexXY启动子DNA,转录翻译MexXY。耐药菌株mexZ测序结果显示[16],57.9%菌株存在变异,以移码突变为主(87.9%),其中19.3%发生错义突变,主要位于二聚体功能区和DNA结合区,46位甘氨酸突变为缬氨酸(G46V)菌株MexZ结合DNA能力完全丧失。抗菌药物不能通过直接作用于mexZ,抑制MexZ表达或干扰MexZ与间隔区mexXY启动子DNA结合诱导MexXY高表达,而是通过蛋白-蛋白的相互作用间接对抗MexZ的阻遏作用上调MexXY表达,这一过程的关键蛋白是ArmZ,由PA5471基因编码[15,17]。药物或活性氧浓度升高可提高mexZ突变率,CF患者高表达MexXY的主要原因是mexZ突变,可能是在肺部活性氧富集的特殊环境下促进mexZ趋同进化(convergent evolution)的结果[18]。
3.2 PA5471通路
PA5471又称为armZ基因,长度1140bp,编码抗阻遏蛋白ArmZ。ArmZ直接与阻遏蛋白MexZ结合,将其从mexXY启动子DNA上解离,下游mexXY基因去阻遏后大量表达。PA5471基因本身受核糖体功能调节,核糖体障碍是诱导ArmZ表达的关键因素。目前已知能引起核糖体机能障碍的因素除核糖体靶向药物外,还有参与蛋白质转录翻译的基因发生突变,如编码50S核糖体蛋白L21、L27的rplU-rpmA操纵子突变;全局调控基因suhB(PA3818)突变、参与氨基酸转运的fmt和folD突变等均可通过PA5471解除阻遏,上调MexXY表达、诱导细菌多重耐药或泛耐药[19-20]。PA5471缺失菌株MexXY表达显著降低,对绝大多数底物药物敏感。各种机制导致的核糖体结构或功能异常主要通过影响PA5471.1mRNA的二级结构调控PA5471转录和翻译,解除MexZ对mexXY的抑制,清除核糖体损伤因素。
PA5471.1位于PA5471与PA5472之间367bp的间隔序列中,在PA5472下游114~155bp处,启动子距离PA54723'端20bp,编码一个含13个氨基酸残基的前导肽(leader peptide),是PA5471的翻译弱化子[21]。细菌生活在不存在核糖体受损因素环境时,转录的PA5471.1mRNA与邻近区域形成1~2区配对、3~4区配对的两个茎-环(stem-loop)结构,配对的4区在靠近PA5471翻译起始位点形成富含尿嘧啶的转录终止子,通过转录衰减机制(transcriptional attenuation mechanism)阻止PA5471转录。当细菌处于氨基糖苷类、大环内酯类等核糖体靶向药物环境或其他损伤核糖体的环境时,由于蛋白质合成功能受损、异常多肽出现,菌体正在合成新生肽链的核糖体停止活动,前导肽翻译受阻,大量核糖体与tRNA、前导肽等结合成复合物停滞在PA5471.1的mRNA上,即通过核糖体停靠(ribosome stalling)机制,改变前导肽mRNA二级结构,阻碍1~2区配对形成茎-环结构,游离的2区与3区配对形成反终止子(antiiterminator),3~4区解离,转录终止子无法形成,对下游PA5471转录的抑制作用解除,PA5471转录翻译挽救停靠的核糖体,实质是细菌启动的核糖体保护机制(ribosome protection mechanisms)。大量翻译的ArmZ蛋白与阻遏蛋白MexZ结合,mexXY启动子暴露,RNA聚合酶进入启动子位点,下游mexXY转录、翻译,高表达MexXY外排泵。
3.3 ParRS通路
ParRS双组分系统由位于同一操纵子的parR(PA1799)和parS基因(PA1798)编码反应器蛋白ParR和传感器激酶ParS。Fernández等[22]在研究铜绿假单胞菌多黏菌素耐药机制时发现,多黏菌素可以不依赖MexZ和PA5471,通过激活双组分系统ParRS独立上调mexXY表达介导获得性耐药。虽然多黏菌素并非MexXY的特异底物,但多黏菌素耐药菌株mexXYmRNA表达水平明显上升[23]。进一步研究发现[24],ParRS变异菌株mexZ、PA5471基因序列及mRNA表达水平均未见改变;敲除ParRS变异株的PA5471、mexZ基因,mexY表达水平仅升高2倍,耐药水平也未见明显变化,mexY的表达水平和耐药性变化明显低于ParRS未变异PA5471、mexZ基因敲除菌株。上述结果说明,ParRS变异株MexXY高表达与已知的mexXY调控因子PA5471和mexZ无关,存在独立的调节通路。变异株测序结果显示,ParS蛋白L50P、A138T、R185G、A215T、A324V变异后组成性激活ParRS,上调mexXY表达,除A138T外均发现于动物菌株[25]。
研究认为[22],ParRS活化具有环境诱导性,阳离子抗菌肽是ParRS活化的强诱导剂。铜绿假单胞菌一旦在环境中检测到特定信号,如多黏菌素,ParS传递信号激活ParR,活化的ParR主要作用是激活脂多糖修饰操纵子(lipopolysaccharide, LPS)arnBCADTEF-ugd基因、下调孔蛋白OprD和上调外排泵mexXY表达,通过改变药物靶位、降低膜通透性和主动外排抵抗药效、降低胞内毒性物质累积,介导对多黏菌素、β-内酰胺类、氨基糖苷类、氟喹诺酮类等药物的多重耐药。在没有多黏菌素环境下,ParRS变异株mexXY转录水平无明显变化;敲除未接触多黏菌素野生株的parRS基因,细菌耐药性及mexY也无改变;动物来源铜绿假单胞菌耐药基因检测发现,OprD表达下调的ParS变异菌株mexYmRNA水平显著上升(升高9.44~72.57倍)[24]。根据上述结果推测,ParRS诱导mexXY高表达的目的并非针对MexXY的底物,可能只是细菌抵抗多黏菌素的伴随结果,在对靶位的修饰或下调孔蛋白的过程中碰巧影响了与mexY表达有关的某个基因或蛋白。关于ParRS激活mexXY启动子的机制尚不清楚,ParRS与众多的上下游调节基因和蛋白相关,是否通过其中的某一种或几种基因发挥作用,目前均不可知,详细机制有待进一步阐明。
3.4 AmgRS通路
AmgRS是铜绿假单胞菌中普遍存在的包膜压力应激调节双组分系统,功能类似于大肠埃希菌的CpxRA,是对氨基糖苷类等药物作用后产生异常多肽造成细胞膜损伤的一种适应性反应[14]。在amgR基因缺失菌株,庆大霉素对菌细胞膜的损伤明显加重[26]。PA5471基因缺失菌株AmgS出现错义突变(V121G)可3倍上调mexXY表达水平,说明AmgRS是不依赖ArmZ上调mexXY表达的又一通路。氨基糖苷类药物暴露和amgS变异是激活AmgRS的主要途径,活化的AmgRS通过增强MexXY表达外排药物减轻因异常多肽插入细胞膜造成的菌体损伤。RNA聚合酶抑制剂利福平存在时,氨基糖苷类药物巴龙霉素的活性明显增强(MIC下降8倍),推测可能是利福平干扰蛋白质合成的同时抑制了巴龙霉素诱导的异常多肽合成,包膜压力应激反应未启动的结果。非氨基糖苷类药物不能通过AmgRS途径诱导mexXY表达,主要依赖ArmZ蛋白的抗阻遏作用,MexXY表达不受amgS、amgR影响。
AmgRS可能通过htpX、yccA、PA55283个靶基因间接调控mexXY的表达,三者是双组分系统介导氨基糖苷类固有耐药的主要因素[27]。htpX和yccA分别编码大肠埃希菌胞浆膜相关蛋白酶和FtsH蛋白酶调节子的同源物,负责膜质量监控;PA5528编码一种功能未知的膜相关蛋白。庆大霉素诱导后,amgR 阳性菌株htpX和PA5528表达水平升高2~3倍,amgR阴性菌株未见变化,推测AmgRS介导的mexXY表达可能依靠靶基因编码的蛋白酶完成。在对amgRS、htpX、yccA和PA5528基因影响巴龙霉素耐药性的研究中发现[28],amgR敲除菌株MIC下降8倍;htpX和PA5528单独缺失菌株MIC分别上升和下降2倍,yccA单独缺失MIC不受影响;htpX-PA5528双缺失菌株MIC升高2倍,htpX-yccA或yccA-PA5528双缺失MIC均下降4倍;三者同时缺失MIC下降32倍。据此证实,amgR通过3个靶基因介导耐药,而三者在结构、作用底物或编码产物等方面必然有相同之处,能部分功能互补,完成AmgRS依赖的MexXY表达调控。另外,3个靶基因同时缺失与amgR敲除株相比,药物敏感性上升了4倍,说明可能存在amgR之外的调节因素,也可能氨基糖苷类药物本身能影响其中的某个或某几个基因表达,单独存在时介导低水平耐药。htpX敲除菌株PA5528表达上调,而PA5528敲除菌株htpX基因无明显变化,说明二者可能部分共享调节基因。
AmgRS调控MexXY表达的本质是对异常蛋白干扰膜正常结构的应激反应。氨基糖苷类药物作用核糖体后出现翻译错误,产生的异常多肽插入细胞膜,膜功能异常激活包膜应激反应AmgRS双组分系统,AmgS、AmgR依次激活,启动靶基因htpX、yccA、PA5528转录,翻译的活性蛋白酶降解插入细胞膜的异常多肽减轻菌细胞膜损伤,同时产生的降解产物可能是mexXY的底物或诱导剂,上调其高表达外排药物。不造成膜损伤的氨基糖苷类不能启动AmgRS,主要依赖PA5471途径上调MexXY。
综上所述,MexXY外排泵高表达本质上是细菌应对环境压力的一种自我保护措施。目前已知诱导MexXY高表达的因素有3个(图2):一是局部调节基因mexZ突变;二是核糖体结构或功能障碍;三是细菌胞膜受损。各种原因导致的核糖体功能障碍主要依赖PA5471途径调控,通过核糖体停靠改变前导肽mRNA二级结构,解除对下游PA5471的转录抑制。胞膜受损因机制不同启动路径亦有差异,异常多肽插入引起的膜损伤激活AmgSR通路;多黏菌素造成的胞膜破坏启动ParRS通路,但机制不清。最近有研究显示[29],钙离子浓度升高mexXYmRNA表达上调,推测可能与钙离子转运蛋白有关,具体机制有待研究。
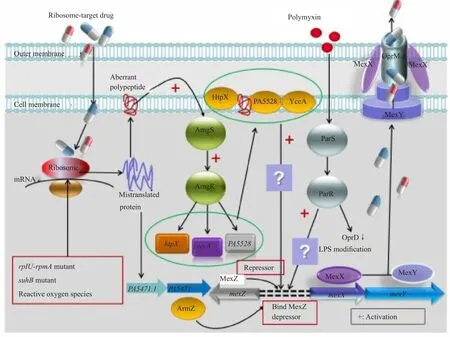
图2 铜绿假单胞菌MexXY外排泵表达调控机制Fig.2 Regulation mechanism of MexXY ef flux pump expression of Pseudomonas aeruginosa
4 问题与展望
MexXY外排泵的表达调控涉及众多基因和蛋白,共同组成了一个复杂、多水平的调控网络。在生存环境存在不利因素时,通过某些基因的激活和失活清除有害物质、维持细胞的正常结构和功能。目前关于MexXY表达调控研究得较为清楚的是PA5471通路,新发现的AmgRS和ParRS双组分系统诱导MexXY表达的具体机制尚不清楚,尤其是ParRS系统。阐明确切的调控机制是相关抑制剂研发,逆转耐药的前提和基础。ParRS和AmgRS通路的基因调控、调控网络中各调节基因对其他RND外排泵的影响以及有效外排泵抑制剂的筛选是未来研究应重点关注的问题。
