高效液相色谱法测定恩诺沙星注射液中的磺胺类药物
2019-01-29冯涛刘道中章安源李有志山东省兽药质量检验所山东省畜产品质量安全监测与风险评估重点实验室山东济南250022
冯涛 刘道中 章安源 李有志 (山东省兽药质量检验所 山东省畜产品质量安全监测与风险评估重点实验室 山东 济南 250022)
高效液相色谱法测定恩诺沙星注射液中的磺胺类药物
冯涛 刘道中 章安源 李有志*(山东省兽药质量检验所 山东省畜产品质量安全监测与风险评估重点实验室 山东 济南 250022)
为建立恩诺沙星注射液中非法添加磺胺类药物的高效液相色谱检查方法,研究使用C18色谱柱(4.6mm× 250mm,3.5μm),流动相为乙腈-0.025mol/L磷酸溶液(用三乙胺调节pH=3.0),流速1.0ml/min,进样量10μl,柱温30℃,定性采集波长范围200~400nm,定量波长为270nm。结果表明,8种磺胺类药物进样浓度在5~100μg/ml范围内与峰面积呈良好的线性关系(R2均大于0.999),平均回收率在95%~107%之间,批内批间RSD均小于5%,适用于恩诺沙星注射液中非法添加磺胺类药物的测定。
高效液相色谱法 恩诺沙星注射液 磺胺类药物
当前,某些兽药生产企业为了扩大恩诺沙星药物的临床治疗效果、隐蔽磺胺类药物的使用,在恩诺沙星注射液中添加磺胺类药物的现象时有发生。由于部分磺胺类药物的休药期比恩诺沙星长,在恩诺沙星注射液中非法添加磺胺类药物,极易造成畜产品中残留大量磺胺类药物的严重后果,对畜产品质量安全和人民群众身体健康造成危害。本研究旨在建立一种检测通量高、专属性强的高效液相色谱法,用于恩诺沙星注射液中磺胺类药物的检测。
1 材料与方法
1.1 材料
1.1.1 仪器设备 高效液相色谱仪Waters e2695(配二极管阵列检测器);电子天平(感量0.00001g、0.01g)。
1.1.2 对照品 磺胺嘧啶(含量99.5%,批号H0361504)、磺胺间甲氧嘧啶(含量99.4%,批号C0031007)、磺胺二甲嘧啶(含量99.2%,批号H0371406)、磺胺氯吡嗪钠(含量100.0%,批号H0281308)、磺胺喹噁啉钠(含量99.6%,批号H0251407)、磺胺甲噁唑(含量99.8%,批号H026110 6)、磺胺对甲氧嘧啶(含量100.0%,批号H0301107)、恩诺沙星(含量99.5%,批号H0361504),均购自中国兽医药品监察所;磺胺噻唑(含量100.0%,批号510091-201407),购自中国食品药品检定研究院。
1.1.3 阴性样品 恩诺沙星注射液批号171222,规格10%,烟台绿叶动物保健品有限公司提供。
1.1.4 试剂 乙腈为色谱纯,其余试剂均为分析纯,水符合GB/T6682一级水的规定。
1.2 试验方法
1.2.1 高效液相色谱条件 色谱柱:C18色谱柱,4.6mm× 250mm,3.5μm,或性能相当者;流动相:A 乙腈、B 0.025mol/L磷酸溶液(用三乙胺调节pH=3.0);流速:1.0ml/min;进样量:10μl;柱温:30℃。定性采集波长范围:200~400nm[1];定量波长:270nm。液相色谱梯度洗脱程序见表1。

表1 液相色谱梯度洗脱程序
1.2.2 对照品溶液制备 分别精密称取8种磺胺类药物与恩诺沙星对照品约100mg至100ml的容量瓶中,用乙腈溶解并稀释至刻度,作为标准储备液(-20℃冰箱中保存,有效期3个月);精密量取各标准储备液5ml,分别置100ml容量瓶中,加稀释液稀释至刻度,摇匀,作为对照品溶液。
1.2.3 阴性样品溶液制备 精密量取不含磺胺类药物的恩诺沙星注射液(批号171222,规格10%,烟台绿叶动物保健品有限公司提供)1ml置100ml容量瓶中,用稀释液溶解并稀释至刻度;精密量取5ml,置100ml容量瓶中,用稀释液稀释至刻度,作为阴性样品溶液。
1.2.4 阳性样品溶液制备 精密量取不含磺胺类药物的恩诺沙星注射液(批号171222,规格10%,烟台绿叶动物保健品有限公司提供)1ml置100ml容量瓶中,用稀释液溶解并稀释至刻度;精密量取上述溶液5ml、8种磺胺类药物标准储备液各5ml,置100ml容量瓶中,用稀释液稀释至刻度,作为阳性样品溶液。
1.2.5 试剂空白溶液 将稀释液作为试剂空白溶液。
1.2.6 稀释液 乙腈:0.025mol/L磷酸溶液(用三乙胺调节pH=3.0)=17:83。
2 结果
2.1 专属性试验[2]
精密吸取对照品溶液、阳性样品溶液、阴性样品溶液、试剂空白溶液各10µl,注入液相色谱仪,在上述高效液相色谱条件下进行测定,阳性样品溶液色谱中恩诺沙星和磺胺嘧啶、磺胺间甲氧嘧啶、磺胺二甲嘧啶、磺胺氯吡嗪钠、磺胺喹噁啉钠、磺胺噻唑、磺胺甲恶唑、磺胺对甲氧嘧啶峰的分离度符合要求;在与对照品色谱相应的位置出相同的峰;阴性样品无干扰。结果见图1~3。
2.2 峰纯度及光谱图匹配检查图
用磺胺嘧啶等8种磺胺类药物对照品溶液建立光谱库,对阳性样品溶液中与各磺胺类药物对照品保留时间一致的色谱峰进行峰纯度检查,纯度角小于纯度阈值,匹配角小于匹配阈值。

图1 恩诺沙星和8种磺胺类药物分离效果
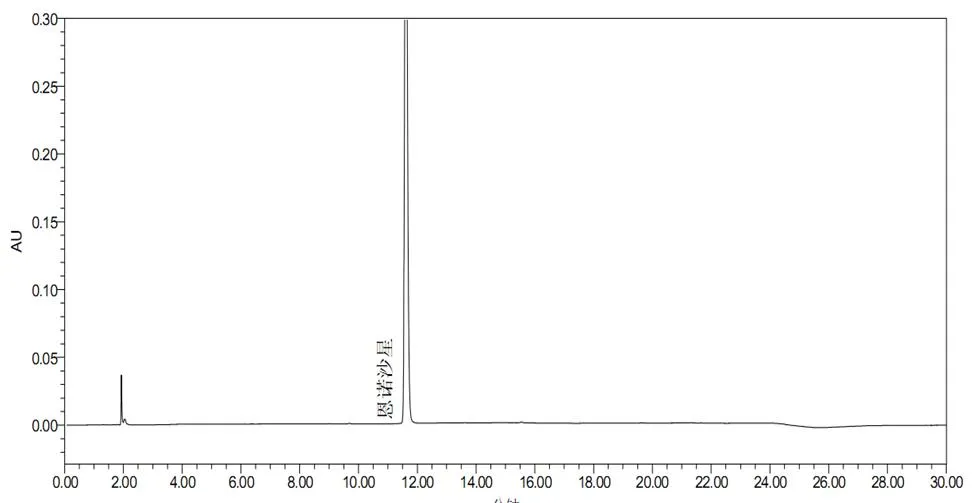
图2 阴性样品色谱图
图3 试剂空白色谱图
2.3 重复性
取不含磺胺类药物的恩诺沙星注射液阴性样品(批号171222,规格10%,烟台绿叶动物保健品有限公司提供),添加8种磺胺类药物至50μg/ml,按照上述色谱条件,连续进样6次,各组分峰面积的相对标准偏差(RSD)小于0.5%,表明重复性好。
2.4 线性
精密量取8种磺胺类药物标准储备液各5ml,置50ml容量瓶中,加稀释液稀释至刻度,摇匀;精密量取适量,用稀释液逐级稀释成100、50、25、10、5μg/ml的系列溶液,注入液相色谱仪,在上述高效液相色谱条件下进行测定,以峰面积(y)为纵坐标,浓度为横坐标(x,μg/ml),进行线性回归分析。8种磺胺类药物回归方程见表2。结果表明,8种磺胺类药物在5~100μg/ml浓度范围内呈良好的线性关系,R2均大于0.999。
2.5 回收率
取不含磺胺类药物的恩诺沙星注射液阴性样品(批号171222,规格10%,烟台绿叶动物保健品有限公司提供),添加8种磺胺类药物,分别至12.5μg/ml、25μg/ml、50μg/ml三个浓度,每个浓度平行6份。分别注入液相色谱仪,在上述高效液相色谱条件下进行测定,结果见表3。

表2 8种磺胺类药物回归方程
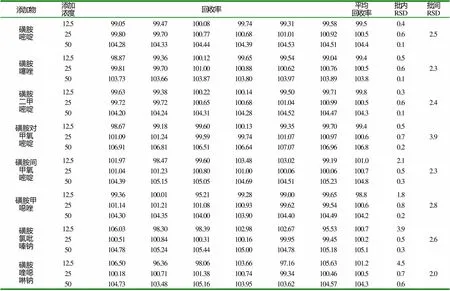
表3 恩诺沙星注射液中添加磺胺类药物回收率 (mg/g、%)
回收试验结果表明,8种磺胺类药物阳性添加样品的回收率在95%~107%之间,批内批间变异系数均小于5%。
2.6 检出限
按上述色谱条件,将对照品溶液进一步稀释,同时记录色谱图及光谱图,报告溶液光谱图失真的最大浓度,以此浓度的2倍作为方法的检出限。磺胺类药物各组分最大失真浓度及检出限见表4。

表4 磺胺类药物各组分最大失真浓度及检出限 (μg/ml)
当磺胺嘧啶、磺胺噻唑、磺胺喹噁啉钠在检出限浓度1.0μg/ml时,信噪比分别为57、80、24;当磺胺二甲嘧啶、磺胺对甲氧嘧啶在检出限浓度2.0μg/ml时,信噪比分别为110、82;磺胺甲噁唑在检出限浓度3.0μg/ml时,信噪比为124;当磺胺间甲氧嘧啶、磺胺氯吡嗪钠在检出限浓度5.0μg/ml时,信噪比分别为288、277。由于需要对被测试药物优先进行定性判断,故本研究检出限以光谱图失真为依据,与传统以信噪比1:3做为检出限有所不同。8种磺胺类药物在检出限(光谱最大失真浓度2倍)时信噪比均大于1:10[2],故未对定量限再做规定。
2.7 判定依据
2.7.1 定性测定[1]在相同条件下,在200~400nm波长范围内,供试品溶液色谱图中如出现与8种磺胺类药物对照品保留时间一致的峰(差异小于等于±5%),且为单一物质峰(纯度角小于纯度阈值);两者紫外光谱图无明显差异(匹配角小于匹配阈值),且最大吸收波长一致(差异小于等于±2nm)则可判断样品中存在该磺胺类药物。
2.7.2 定量测定 取供试品溶液和对照品溶液各10µl注入液相色谱仪,在上述色谱条件下进行测定,记录270nm波长处的色谱图,外标法定量。
3 讨论
(1)色谱洗脱程序的选择本方法检测的磺胺嘧啶等8种磺胺类药物化学结构、性质相似,等度洗脱时,各药物的分离度达不到要求。在分离度差的出峰时间段内,通过降低流动相中乙腈的比例,延长洗脱时间,提高了分离度;反之,对相邻药物之间间隔时间过长的时间段内,适当提高流动相中乙腈的比例,缩短洗脱时间,改善了后面药物的峰型。经反复优化,最终确定了液相色谱梯度洗脱程序。(2)波长选择磺胺嘧啶等8种磺胺类药物的最大紫外吸收波长不一致,将8种磺胺类药物同时添加到阴性恩诺沙星注射液中制成的阳性样品溶液注入液相色谱仪,在200~400nm波长范围内进行扫描,在三位图谱中提取不同检测波长的色谱图进行对比,结果显示在270nm波长处的色谱图中各磺胺类药物峰高均匀一致,因此选择270nm作为定量检测波长。
本研究建立的UPLC法检测恩诺沙星注射液中磺胺类药物,方法简便、专属性强、准确度高、重复性好,可为恩诺沙星注射液中非法添加磺胺类药物的测定。
[1] 中华人民共和国农业部.恩诺沙星注射液中非法添加双氯芬酸钠检查方法[s].中华人民共和国农业部公告第2398号,1-2.
[2] 中华人民共和国兽药典委员会.中华人民共和国兽药典[s].2015年版一部,315-319.
(2018–08–07)
S859.79
A
1007-1733(2019)01-0003-03
