采用RT-PCR方法诊断猪繁殖与呼吸综合征
2019-01-29吕娜娜山东畜牧兽医职业学院宠物科技系山东潍坊261061
吕娜娜 (山东畜牧兽医职业学院宠物科技系 山东 潍坊 261061)
采用RT-PCR方法诊断猪繁殖与呼吸综合征
吕娜娜 (山东畜牧兽医职业学院宠物科技系 山东 潍坊 261061)
山东某猪场发生以猪繁殖与呼吸综合征(PRRS)为主要特征的疾病。笔者对送检的病料进行了实验室诊断:剖检主要发现肺水肿,出血;组织病理学检测主要发现肺间质明显增宽,肾小管上皮肿胀;采用RT-PCR检测方法检测猪肺脏组织,结果被验样品在400bp扩增带为PRRSV阳性,阴性对照无扩增带出现。诊断结果表明:该猪场发生的病例为猪繁殖呼吸障碍综合征。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS),俗称蓝耳病,由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种有高度传染性的猪综合征。目前根据基因序列和抗原特性的不同,PRRSV可划分为I型(原欧洲型,代表毒株为Lelystad virus株)和II型(原美洲型,代表毒株为ATCCVR-2332株)。1987年最早发现于美国(Zeman等,1993),1994~1995年从美国引种传入我国。1996年我国郭宝清等第一次分离出该病毒(郭宝清等,1996)。2001~2002年发生跨省区流行;由南向北扩散、蔓延、由华东、华南、华北、东北等10个省市(县) 发病。2006年5月下旬起,以高热病为特征的蓝耳病,首先在南方省市发病,同年11月至12 月延伸到东北地区,全国共有19个省市(县)出现疫情(林荣泉,2007)。2008年,我国将高致病性蓝耳病列为一类动物疫病,并进行强制免疫。在自然流行中,PRRS仅见于猪,其他家畜和动物未见发病。不同年龄、品种、性别的猪均可被感染,生长猪和育肥猪感染后症状比较温和,母猪和仔猪的症状则较为严重。PRRS主要经呼吸道感染,也可垂直传播。将感染猪特别是隐性感染猪引入易感猪群是该病流行的重要原因。本病传染性强、传播快,发病率和死亡率高,且在猪群内持续性感染不易清除,多呈散发、点状分布的地方性流行。
1 材料与方法
1.1 发病情况
山东某猪场养的60头仔猪中,其中有30头相继发病,有6头已死亡。发病的仔猪表现为:精神沉郁,咳嗽、打喷嚏;在猪圈内扎堆;食欲减弱,有的甚至废绝,部分猪排灰色稀便;耳朵和嘴尖发绀,行走不稳;并伴有呕吐,体温升高现象。虽采用了抗生素治疗,但效果不明显,造成比较严重的经济损失。
1.2 主要的仪器和试剂
BMJ-1生物组织包埋机,AO-8250型组织切片机,OLYMPUS-BHS显微镜,PCR扩增仪,RT-PCR检测试剂盒。
1.3 病理学检测
1.3.1 大体剖检 对送检的病死仔猪进行了尸体剖检及大体病变的观察。
1.3.2 病理组织学检查 取病变明显的组织(肝脏、肾、心和肺脏)各一小块于10%的福尔马林溶液中进行固定,然后经常规石蜡切片制作、HE染色。在OLYMPUS-BHS显微镜下观察并照相。
1.4 RT-PCR的方法
1.4.1 RT-PCR检测试剂盒组成 变性液(A液),硫酸钠溶液(B液),酚/氯仿/异戊醇混合液(C液),异丙醇(D液),75%乙醇(E),处理的灭菌去离子水(F液),酶抑制剂(G液),反转录反应液(H液),反转录酶(I液),PCR反应液(J 液),TaqDNA聚合酶(K液),矿物油(L液),50倍TAE电泳缓冲液(M液),溴化乙锭溶液(N液),上样缓冲液(O液)。
1.4.2 组织样品处理 取待检组织充分研磨,加入PBS(pH7.2)研磨成匀浆,8000r/min 5min,取上清100µl 再加入A液,混匀。取血清100µl,置灭菌离心管中,加入A液,混匀。
1.4.3 病毒RNA的提取 (1)取已处理的样品,每管依次加入B液30µl,C液30µl、C液300µl(颠倒10次,混匀,冰浴15min,4℃12000r/min,离心15min。(2)取300µl上清液,置于经DEPC水处理过的1.5ml灭菌离心管中,加入300µl D液,混匀,置-70℃冰箱中30min。室温融化,4℃,15000 r/min,20min。(3)弃上清,沿管壁缓缓滴入1mlE液,轻轻旋转一周后打掉,将离心管倒扣于吸水纸上1min,氮空抽干16min(以无水乙醇为准)。(4)按9:1比例配制F:G混合液,每个样品用用10µl F:G混合液溶解,﹣20℃储存备用。
1.4.4 反转录(RT)操作 每份总体积20µl 。取16µl H液(用前混匀)、1µl G液、1µl I液、2µl 已溶解的病毒RNA。混匀并做好笔记,在PCR扩增仪上进行以下循环:42℃60min,98℃5min。
1.4.5 PCR操作 每份总体积20µl。取16µl J液(用前混匀)、2µl K液、1µl I液、2µl 1.4.4中的反转录产物。混匀,做好标记并加入L液20µl覆盖,放于PCR扩增仪上,扩增条件为94℃30s,55℃30s,72℃30s。35个循环后,72℃延伸5 min。
1.4.6 电泳 称4g琼脂糖放于500ml锥形瓶中,加入50倍稀释的M液200ml(取4mlM液,用双蒸水稀释至200ml),于微波炉中溶解,再加入20µl N液混匀。在电泳槽内放好梳子,倒入琼脂糖凝胶,待凝固后将PCR扩增物15µl混合3µlO液,点样与琼脂糖凝胶孔中,以5V/cm电压于50倍稀释的M液中电泳,紫外灯下观察结果。
2 结果
2.1 剖检病变
剖检病死仔猪,主要病变为身体皮肤散在出血点,耳尖发绀;肺脏明显出血,水肿,眼睛有分泌物;胃大弯淤血,小弯淤血;附睾淤血;肠系膜淤血。
2.2 病理组织学变化
肺间质明显增宽,肺间质疏松(图1)。肾小管上皮肿胀,肾小球毛细血管内皮肿胀(图2)。
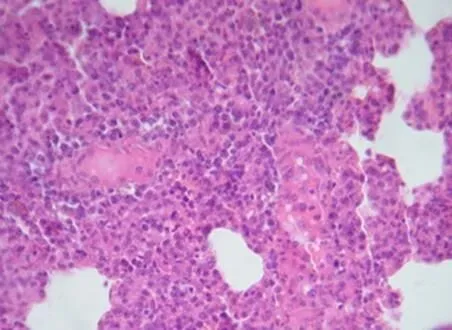
图1 肺间质明显增宽

图2 肾小管上皮肿胀, 肾小球毛细血管内皮肿胀
2.3 RT-PCR检测结果
被验样品、阳性对照出现400bp扩增带,阴性对照无扩增带出现。
3 讨论
3.1 病例的确诊
通过体表观察到猪耳尖发绀,剖检发现病死仔肺脏明显出血,水肿,符合猪繁殖呼吸障碍综合征的典型症状;组织病理学检测可见肺间质明显增宽,肾小管上皮细胞肿胀;RT-PCR扩增出猪繁殖与呼吸综合症病毒(PRRSV)400bp扩增带。因此综合以上诊断结果表明该猪场发生了猪繁殖呼吸障碍综合征。
3.2 检测技术
PRRS的诊断方法有许多种,病毒的分离鉴定、血清学诊断方法和分子生物学诊断方法等方法及技术。其中,血清学诊断方法有免疫过氧化物酶单层细胞试验(IMPA)、间接免疫荧光试验(IFA)、酶联免疫吸附试验(ELASA)和血清中和试验(SNT)等,但由于PRRSV 的抗原型差异,一种方法只有使用2种抗原亚型才能检出I型、II型的抗原或抗体,因此血清学方法只能用于评价猪群PRRSV感染状况,不能进行确诊。以分子病毒学为基础的单克隆抗体技术、核酸探针杂交技术和RT-PCR技术特异性高、准确且操作简便而被广泛应用(王兰平,2007),此外还有一些快速的PRRS检测方法,如脂质体免疫测定法(LIA )、高通量疾病基因筛查工具,纳米金标技术等。
3.3 综合防治
本病目前尚无特效药物疗法,主要采取综合防治措施及对症疗法。最根本的方法是消除病猪、带毒猪和彻底消毒,切断传播途径。此外应加强进口猪的检疫和本病的检测,以防本病扩散。因此在这种情况下需要建立有效的管理策略,严格执行消毒制度,实行全进全出制,加强生物安全措施,做好猪群饲养管理,定期对猪群中猪群PRRSV感染情况进行检测,对发病猪场要严密封锁,根据地域情况和猪场特点选择合适的疫苗种类进行免疫接种,增强猪体特异性抗病力(于洪镇,2011),同时控制好应激及其他疾病的感染。
[1] 郭宝清, 陈章水, 刘文兴等. 从疑似PRRS 流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病, 1996, 87(2): 124.
[2] 林荣泉. 探讨高致病性猪蓝耳病检疫检验与防控[J]. 肉类工业, 2007(9): 38-40.
[3] 王兰平. 猪繁殖于呼吸综合征检测技术综述[J]. 中国动物检疫, 2007, 24(8): 46-47.
[4] 于洪震. 高致病性蓝耳病的发病特点和防治[J]. 山东畜牧兽医, 2011, 32: 26.
[5] Zeman D, Neiger R, Nelson E, et a1. Mine hart M Laboratory investigation of PRRS virus infection in three swine herds. J Vet Diagn Invest.1993, 5(4):52-2528.
(2018–07–02)
S854.4+3
B
1007-1733(2019)01-0030-02
