汉黄芩素对急性肺损伤小鼠的保护作用
2019-01-28葛金林余雯文曾余丰金晨慈戴元荣
葛金林,余雯文,曾余丰,金晨慈,戴元荣
(1.温州医科大学附属第二医院 呼吸内科,浙江 温州 325027;2.温州市中西医结合医院 呼吸内科,浙江 温州 325000)
急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种由创伤、输血、感染等多种因素所导致的急性进行性呼吸功能不全或呼吸衰竭症状,有较高的发病率和病死率[1]。由于ALI确切的发病机制不明,因此临床上尚缺乏有效的针对ALI的治疗方法。目前,有研究证明包括黄芩在内的多种中药在ALI的动物模型中,对肺损伤有治疗效果,但其准确药理成分及涉及的分子机制尚不明确。汉黄芩素(wogonin,WOG)作为黄芩的主要药理成分之一,已被证明可在结肠炎及皮肤炎症等动物模型中通过抑制一氧化氮、前列腺素E2等的产生减轻炎症反应[2-4]。但缺乏足够的研究证明WOG对ALI的治疗效果。因此,本研究利用脂多糖(lipopolysaccharide,LPS)在小鼠中诱导ALI模型,并予以WOG治疗,观察小鼠肺部损伤改善程度及相关炎症指标变化,以期为WOG治疗ALI的临床应用提供实验基础。
1 材料和方法
1.1 实验动物及试剂 C57/BL6(SPF级,雄性,6~8周龄)小鼠,购于上海南方模式生物研究中心,许可证号:SYXK(沪)2017-0012。LPS和WOG购于美国Sigma公司;流式抗体anti-CD11b-APC、anti-Gr-1-FITC和anti-F4/80-FITC购于英国BD公司;TNF-α、IL-1β、IL-6和IL-10 ELISA试剂盒,购于深圳达科为生物科技有限公司;蛋白印迹相关抗体购于美国Abcam公司;BCA蛋白浓度测定试剂盒购于上海碧云天生物技术研究所。
1.2 动物分组及ALI模型建立 随机将C57/BL6小鼠分为空白对照组(Control组)、LPS诱导的ALI组(LPS组)、WOG治疗组(WOG组),每组10只。各组处理方法如下:Control组和LPS组腹腔注射0.9%氯化钠溶液50 μL;WOG组腹腔注射WOG 5 mg/kg。LPS组和WOG组腹腔给药1 h后,腹腔注射戊巴比妥钠 (50 mg/kg)麻醉小鼠,经鼻腔滴注LPS(1 μg/kg,每只50 μL),构建小鼠ALI模型,Control组麻醉鼻腔滴注相同体积0.9%氯化钠溶液。
1.3 模型构建结果及药物治疗效果评估
1.3.1 肺湿重/干重比(W/D)测定:造模24 h后,每组5只小鼠颈椎脱臼法处死,取全肺组织,用 4 ℃预冷的PBS洗去肺组织表面的残血(冲洗2次),在滤纸上吸干水分,称重,记为肺组织湿重(wet weight,W),然后将其置于80 ℃烘箱中烘烤约48 h 至恒重后称定干重(dry weight,D),计算肺W/D。 W/D代表肺含水量,可评定肺组织水肿的严重程度。
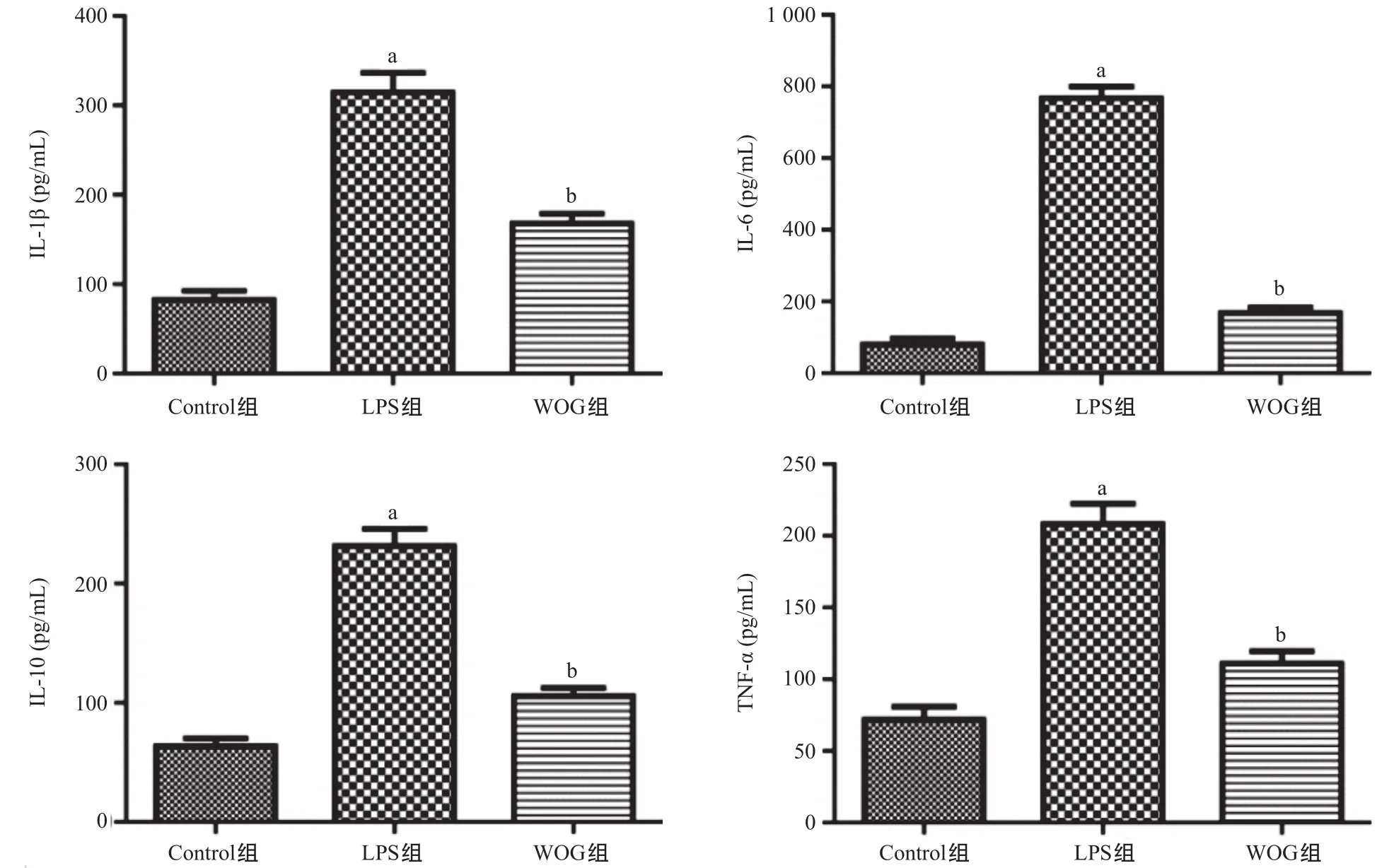
1.3.2 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)收集及细胞因子检测:造模24 h 后,每组5只小鼠颈椎脱臼法处死,剪开颈部皮肤,分离颈部肌肉,暴露气管,在气管远端剪一小口,插入导管固定。分3次灌洗,每次注射500 μL PBS,停留30 s后抽出,收集BALF,其回收率约为90%。离心BALF,收集上清用于细胞因子检测,收集底层细胞沉淀用于流式细胞术对中性粒细胞及巨噬细胞计数。用PBS洗涤以上收集的细胞并进行分组,分别加入相应的流式抗体冰上孵育1 h,所用的流式抗体包括:anti-CD11b-APC、anti-Gr-1-FITC和anti-F4/80-FITC,随后用PBS离心洗涤细胞3次,并用 300 μL PBS重悬细胞后上机流式检测。最终CD11b+Gr-1+标记为中性粒细胞,CD11b+F4/80+标记为巨噬细胞。将收集的BALF上清液,参照ELISA试剂盒操作说明书检测BALF中细胞因子IL-1β、IL-6、IL-10和TNF-α的浓度。
1.3.3 肺组织病理形态学观察及NF-κB信号通路蛋白检测:“1.3.2”项的5只小鼠打开胸腔,取出肺组织。右肺用4 ℃预冷的PBS洗去肺组织表面的残血,然后将其置于多聚甲醛溶液中固定24 h,70%乙醇脱水3次,冰冻切片、HE染色观察。左肺提取肺组织蛋白,采用BCA法进行定量,SDS-PAGE电泳后电转移至硝酸纤维素膜,5%脱脂奶粉室温封闭1 h,加入目标一抗4 ℃孵育过夜,TBST洗膜3次,加入相应HRP标记的二抗室温孵育2 h,滴加ECL发光,显影,使用Image J进行灰度分析。
1.4 统计学处理方法 采用SPSS20.0软件进行统计学分析。计量资料采用±s表示,各组间指标差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 WOG对LPS诱导的小鼠肺W/D的影响 LPS气管灌注造模24 h后,对其W/D进行测定评估肺水肿的程度。与Control组比,LPS组W/D值显著升高,WOG组W/D值显著低于LPS组,差异均有统计学意义(P< 0.05),见图1。
2.2 WOG对LPS诱导的ALI小鼠肺组织病理学变化的影响 LPS刺激24 h后,与Control组相比,LPS组小鼠肺部有大量炎性细胞浸润(中性粒细胞和巨噬细胞),肺组织间隙可见大量红细胞渗出及肺泡壁增厚。与LPS组相比,WOG组小鼠上述病理变化均有明显改善,见图2。
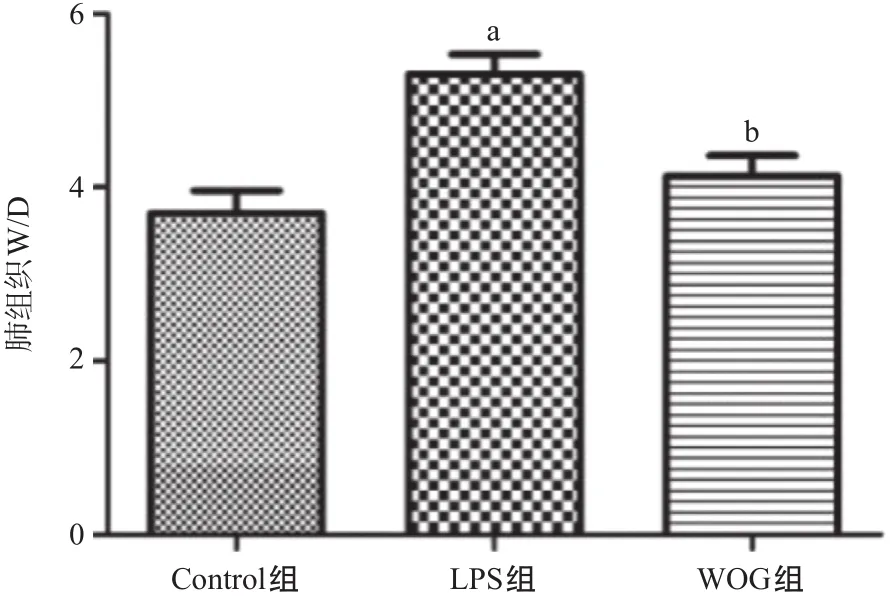
图1 3组肺组织W/D比较
2.3 WOG对ALI小鼠BALF中中性粒细胞、巨噬细胞水平的影响 LPS气管灌注造模24 h后,流式细胞仪检测小鼠BALF中炎性细胞(巨噬细胞、中性粒细胞)数量。LPS组中巨噬细胞和中性粒细胞的浓度与Control组比显著增高(P<0.01);与LPS组比,WOG组巨噬细胞、中性粒细胞的水平均显著降低(P< 0.01)。见图3。
2.4 WOG对ALI小鼠BALF中细胞因子的影响 LPS气管灌注造模24 h后,测定BALF中炎性细胞因子TNF-α、IL-1β、IL-6、IL-10的水平。与Control组比,LPS组BALF中IL-1β、IL-6、IL-10和TNF-α表 达水平明显升高,WOG组BALF中IL-1β、IL-6、IL-10和TNF-α表达水平较LPS组明显降低(P<0.01),见图4。
2.5 WOG对LPS诱导的ALI小鼠NF-κB信号通路的影响 与Control组比,LPS刺激24 h后,LPS组小鼠肺组织IκB(inhibitor of NF-κB)显著降解,导致磷酸化IκB(p-IκB)大量生成,WOG可明显地抑制IκB的降解,阻断NF-κB信号转导通路激活(P<0.05),见图5。
3 讨论
ALI是由全身炎症反应所导致的综合征,临床表现弥漫性肺泡及肺血管内皮细胞损伤、肺组织水肿及肺不张等病理特征,严重时可发展为ARDS。ALI病理改变主要体现在肺泡-毛细管屏障渗透性增加,炎症细胞的细胞因子、趋化因子和黏附分子等炎症介质过量产生[5-7]。由于ALI发病机制不明确且预后不良,因此是呼吸危重症医学界研究的难点和热点。本研究通过构建LPS诱导的小鼠ALI模型,探究传统中药黄芪的主要药理成分WOG治疗ALI的潜在作用及机制,为WOG的临床运用提供理论基础。
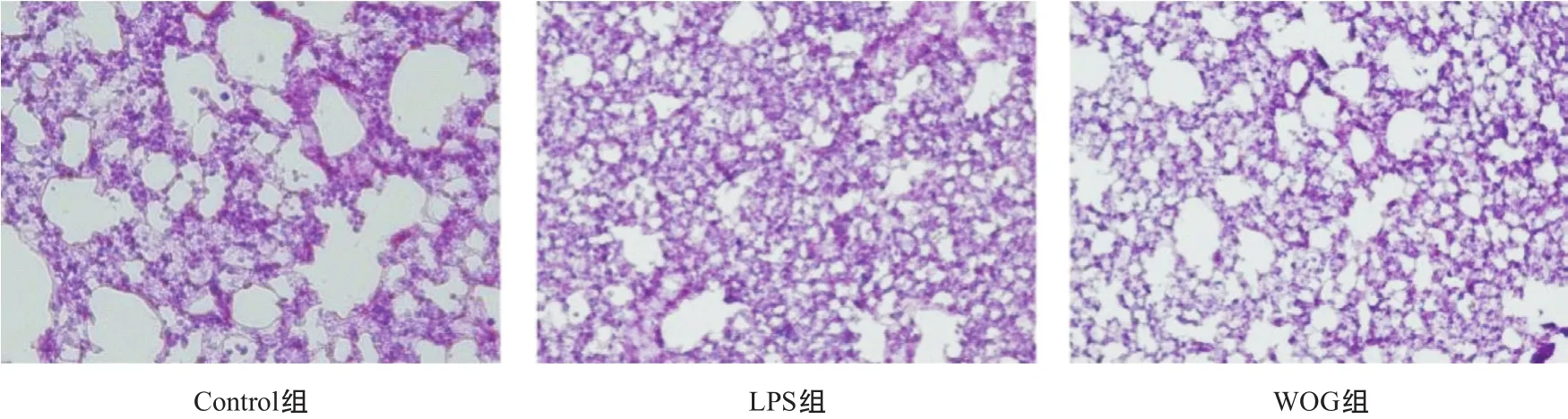
图2 小鼠肺组织病理切片(HE,×200)
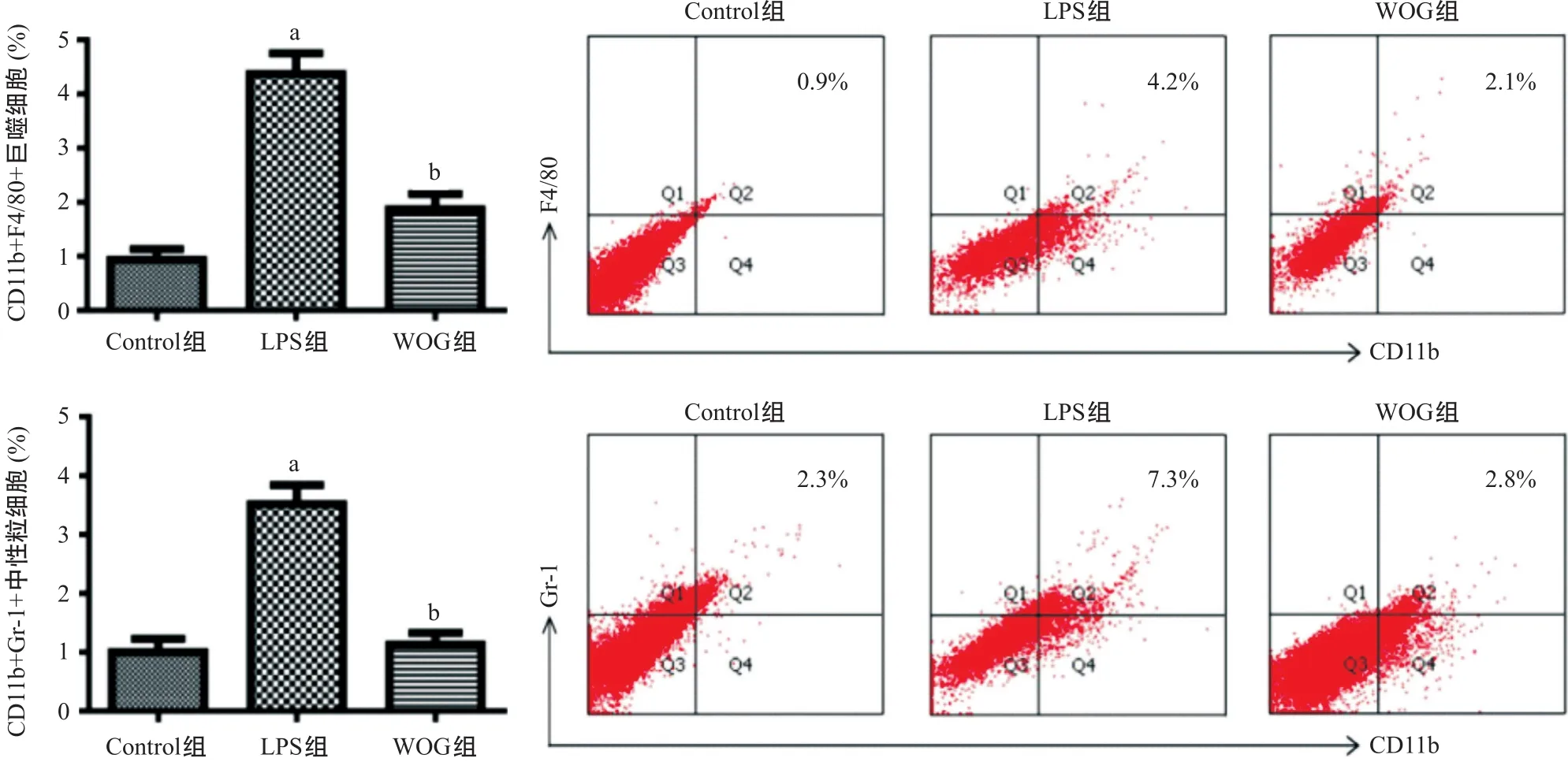
图3 流式细胞术检测小鼠BALF中巨噬细胞和中性粒细胞水平
与Control组比:aP<0.05;与LPS组比:bP<0.05。每组5只

图5 3组ALI小鼠NF-κB信号通路检测
LPS是革兰氏阴性菌细胞壁的主要成分,使用LPS进行小鼠滴鼻后可在肺组织募集包括中性粒细胞及巨噬细胞在内的多种炎症细胞,而此类炎症细胞也可释放TNF-10、IL-6等炎症细胞因子,通过旁分泌的方式诱导中性粒细胞激活引起突发性呼吸、过氧化物酶释放,最终加重肺部损伤[8]。因此,抑制免疫细胞过度活化和细胞因子的分泌是延缓ALI病程的关键。有研究表明,甘草黄酮、姜黄素等中药能够通过抑制炎症细胞、抑制细胞因子分泌来治疗ALI[9-10],同时WOG已经在皮肤炎症、脑损伤等多种炎症参与的动物疾病模型中被证明有治疗效 果[3,11]。本研究则发现WOG对ALI亦有治疗效果,动物实验结果表明预先腹腔注射5 mg/kg的WOG,可减轻肺部炎性细胞浸润(中性粒细胞和巨噬细胞)及显著降低肺组织的W/D;流式细胞术及ELISA结果也显示WOG治疗后BALF中炎性细胞含量下降,TNF-α、IL-1β、IL-6和IL-10等促炎性细胞因子的产生减少。表明WOG可通过抑制机体免疫细胞的过度活化来对ALI起治疗效果,且相较于临床上使用激素治疗ALI可能带来的不良后遗症,WOG或有更好的应用前景。
参与ALI疾病发展的信号转导过程相对复杂,至今尚未完全明确,但有文献初步报道NF-κB信号途径在其中发挥着重要的作用[12-13]。革兰氏阴性菌细胞壁的主要成分LPS可通过TLR4活化NF-κB信号通路启动下游如炎性细胞因子(TNF-α、IL-1β、IL-6和IL-10)、黏附分子、集落刺激因子等炎症信号的释放,因此细菌感染也是导致ALI的重要病因[14-16]。 本研究发现,WOG可能通过抑制NF-κB信号通路的活化来缓解ALI的病情。Western blot结果表明:LPS刺激后,p-IκB水平升高,显示NF-κB信号通路被激活;而在WOG预先处理的小鼠肺组织中p-IκB水平升高不明显。因此,WOG处理的小鼠,可以通过抑制IκB磷酸化的方式抑制NF-κB信号通路的激活,进而影响下游的炎性细胞因子的释放,并发挥相应的治疗效果。
本研究也存在一定的不足之处,例如未测定小鼠肺通气量,细胞核及细胞质中NF-κB的p65、p50两个亚基的变化水平有待进一步分析,以及炎症相关的趋化因子的变化水平也有待进一步探讨。
综上所述,WOG可通过抑制NF-κB信号通路的活化来减轻炎症反应,并发挥对LPS致小鼠ALI的保护作用。
