MLL基因重排阳性急性淋巴细胞白血病骨髓细胞形态特征和预后的相关性
2019-01-25薛天琳巩文玉刘曙光
李 蓓 薛天琳 崔 华 巩文玉 刘曙光 李 君 高 超
白血病是儿童期最常见的恶性疾病,其中约80%为急性淋巴细胞白血病 (ALL)。骨髓中原始淋巴细胞形态通常表现为细胞大小不等,形态较规则,胞浆少,呈蓝色,核染色质细腻,核仁不清晰。骨髓涂片检查是诊断ALL最基本和便捷的方法。此外,ALL不同分型的原始淋巴细胞其细胞核的粗细程度、细胞浆的多少、空泡和核仁的有无等均有不同,且常可提示患者的预后[1]。近年来,分子遗传学技术已被广泛应用于儿童ALL的诊断分型,并且可作为预后判断的标准[2]。其中,混合谱系白血病(MLL)基因重排可见于2%~6%的儿童ALL[3],且是划分高危ALL的标准之一[4,5]。临床形态学诊断工作中,发现MLL基因重排阳性ALL患儿除了具有WHO诊断标准中描述的原始和幼稚淋巴细胞形态特点,如细胞大小不一、胞浆量少、偶有空泡、核染色质浓聚、核仁不清楚或可见之外, 还同时具有急性髓细胞白血病(AML)中原始粒细胞和原始单核细胞所具有的某些特点,如胞浆中可见嗜天青颗粒或者具有伪足,而其他类型ALL的恶性原始淋巴细胞却少有这些特征。本文旨在研究MLL基因重排ALL患儿骨髓细胞形态的特点,并探讨其与临床特征和预后的相关性。
1 方法
1.1 研究方案 病例对照研究。回顾性收集首都医科大学附属北京儿童医院(我院)治疗的MLL基因重排ALL病例(MLL+组),配对纳入同期收治的非MLL基因重排的ALL患儿(MLL-)。MLL+组依据骨髓细胞中是否具有嗜天青颗粒、核仁、空泡和伪足,再分为形态学阳性和阴性亚组。考察MLL+组和MLL-组形态特征差异;比较MLL+形态学阳性和阴性亚组临床表现和无事件生存率(EFS),通过受试者工作曲线(ROC)探讨骨髓细胞不典型形态特征对患者预后的预测能力。
1.2 知情同意 本研究行骨髓细胞形态、组织化学检查、MLL基因重排检测和患儿资料收集均取得患儿监护人的知情同意。中国儿童白血病治疗协作组(CCLG)ALL-2008研究方案获得我院伦理委员会的批准。
1.3MLL+组纳入标准 2011年1月1日至2018年5月31日我院血液肿瘤中心采用CCLG ALL-2008方案收治的MLL基因重排阳性的ALL初诊患儿。
1.4MLL-配对标准MLL+组每例患儿收治时间前后1个月内、同样采用CCLG ALL-2008方案治疗、性别相同、发病年龄差距最小的MLL-初诊ALL患儿,如同一时间段符合条件的MLL-患儿不止1例,同时纳入MLL-组。
1.5 骨髓细胞的染色、检测和诊断标准 瑞氏染液、组织化学染色均采用珠海贝索生物技术有限公司所生产的试剂盒。组织化学染色包括过氧化物酶(POX)染色、糖原(PAS)染色、氯醋酸AS-D萘酚酯酶染色和非特异性醋酸AS-D萘酚酯酶染色+氟化钠抑制实验。患儿骨髓涂片标本经瑞氏染色或组织化学染色,显微镜镜检200个细胞。骨髓细胞形态学根据WHO前体B和T细胞肿瘤的标准[6]分类和计数,细胞形态多表现为核染色质浓聚,核仁不清楚,但其中大细胞的胞浆偶有空泡,核染色质弥散或者细密,可见清晰的核仁。组织化学染色的赋分原则:POX染色阳性反应为胞浆含有蓝色或蓝棕色颗粒;氯醋酸AS-D萘酚酯酶染色阳性反应为胞浆含有红色颗粒;非特异性醋酸AS-D萘酚酯酶染色+氟化钠抑制实验的阳性反应为胞浆含有棕黑色片块状沉淀。PAS染色阳性反应为胞浆含有糖原颗粒,颗粒细小呈紫红色,其含量按下述标准赋分:胞浆内无颗粒或粉红色物质赋0分;含有1~9个红色小颗粒或有1圈颗粒赋1分;含有10~20个红色颗粒或有2圈颗粒赋2分;含有许多红色颗粒,组成3个环或成块状赋3分;含有许多粗颗粒组成环或2个以上大团块赋4分[7]。
1.6MLL基因重排分析
1.6.1 RNA提取和cDNA合成 分离患儿初诊骨髓样本中的单个核细胞, 并冻存于-80℃冰箱备用。根据Trizol试剂盒 (美国Life Technology公司)说明提取总RNA, 用紫外分光光度计测定RNA的纯度和浓度。采用随机逆转录引物 (美国Invitrogen公司) , 将2 μg RNA反转录为cDNA, 冻存于-20℃冰箱, 用于后续实验。
1.6.2 多重荧光PCR方法分析MLL基因重排MLL基因重排检测采用荧光白血病/淋巴瘤43种融合基因检测试剂盒(上海源奇生物科技有限公司)。可检测到涉及MLL基因的11种染色体易位,包括MLL-AF4、MLL-AF9、MLL-AF6、MLL-AF10、MLL-ELL、MLL-ENL、MLL-AF17、MLL-AF1q、MLL-AF1p、MLL-AFX和MLL-SEPT6。
1.7 临床特征及预后相关性因素采集 初诊外周血WBC(×109·L-1):分为<50和≥50;发病年龄(岁):分为1~10、<1或>10;MLL亚型:归纳为MLL-AF4、MLL-AF9、MLL-ENL和其他类型;泼尼松治疗反应:第8 d外周血幼稚淋巴细胞数<1 000·μL-1为良好、≥1 000·μL-1为不良;第33 d微小残留病变(MRD):分为<10-4、~10-2和≥10-2;第78 d MRD:分为<10-3、>10-3。CR:患儿未发生任何事件,骨髓检测幼稚淋巴细胞<5%。复发:治疗过程中或结束后,骨髓幼稚淋巴细胞≥5%或者发生髓外白血病浸润。3年无事件生存率(EFS):从治疗开始后连续3年未发生复发或第二肿瘤的概率。
1.8 随访 根据病历记录随访是否发生复发和死亡,如无上述不良事件发生,则通过电话随访其预后,随访截止日期为2018年11月31日。随访时间:自诊断至发生事件或研究随访截止日期。事件定义为死亡、复发或发生第二肿瘤。
1.9 统计学方法 采用SPSS 16.0软件进行统计学处理。利用精确概率法χ2检验比较MLL+组和MLL-组形态学差异;采用非参数检验比较MLL+组和MLL-组PAS染色阳性率和赋分值的差异;生存率分析采用Kaplan-Meier法;MLL+组形态学阳性亚组和阴性亚组EFS比较采用Log-Rank检验。通过ROC分析骨髓细胞不典型形态特征对患儿预后的识别能力。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 26例符合MLL+组的纳入标准, 男12例, 女14例;年龄0.4~13岁, 中位年龄1.0岁。MLL-AF4+6例、MLL-AF9+5例、MLL-ENL+6例、其他类型9例(MLL-AF10+3例、MLL-MLL+2例,MLL-AF6+、MLL-ELL+、MLL-SEPT6+和MLL-AF1p+各1例)。18例处于完全长期缓解状态,5例骨髓复发,3例确诊后放弃治疗。30例符合MLL-组的配对标准,男16例, 女14例;年龄0.8~14岁, 中位年龄2.0岁。
2.2 骨髓细胞形态和组织化学染色特征MLL+组和MLL-组分别有23.1%(6/26)和36.7%(11/30)原始、幼稚淋巴细胞未见空泡、伪足、颗粒和核仁;余分别具有1~4个上述形态特征。表1显示,MLL+组与MLL-组的核仁、嗜天青颗粒、空泡和伪足的检出率差异均无统计学意义。
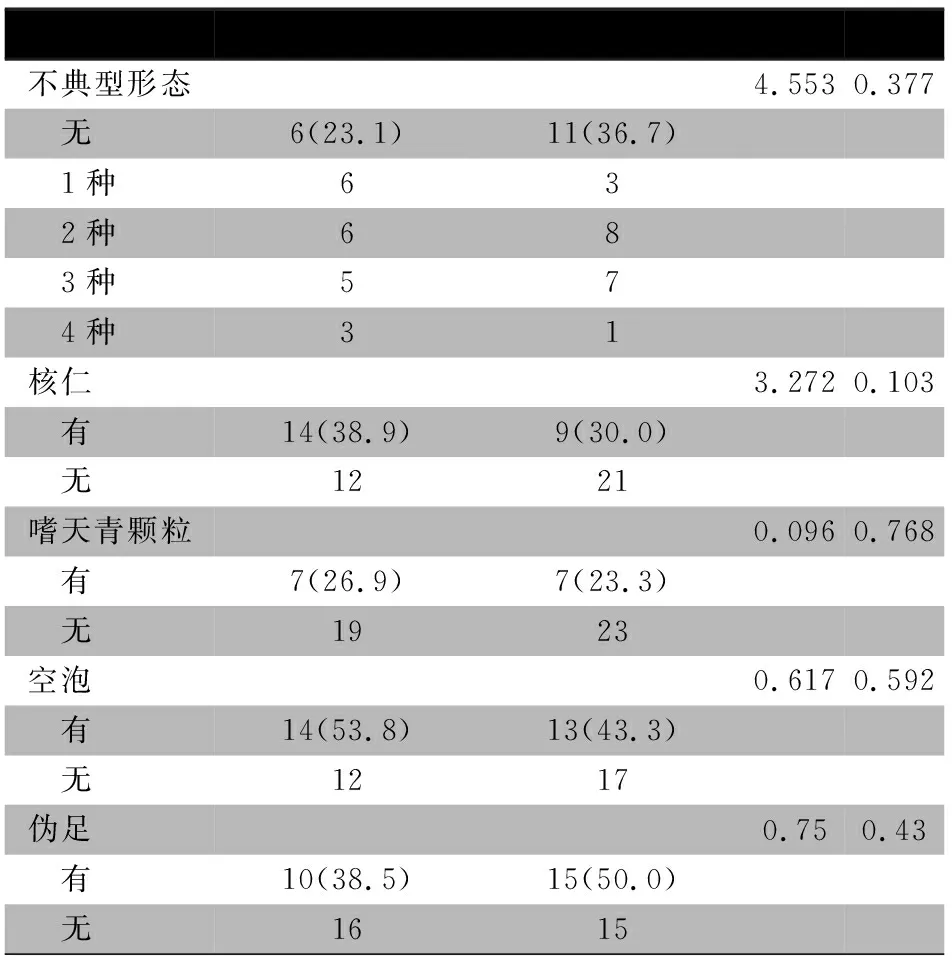
表1 MLL+组和MLL-组骨髓细胞形态特征的比较[n(%)]
MLL+组和MLL-组患儿的POX染色、氯醋酸AS-D萘酚染色、非特异性醋酸AS-D萘酚酯酶染色+氟化钠均为阴性。MLL+组PAS染色阳性率为0~71%(中位数为4.0%),赋分为0~129(中位数为4.0)分;MLL-组PAS染色阳性率为0~92%(中位数为26.0%),赋分为0~282(中位数为38.0)分。MLL+组PAS染色阳性率与赋分值均显著低于MLL-组,P分别为0.007和0.012,Z分别为-2.706和-2.529。
2.3MLL+组临床和生物学特征与骨髓原始、幼稚淋巴细胞形态特点相关性分析 表2显示,骨髓原始、幼稚淋巴细胞核仁、嗜天青颗粒、空泡和伪足的形态特征与初诊时外周血WBC、性别、年龄不相关;6例MLL-AF4融合基因阳性者均有核仁,其他MLL重排者具有核仁的比例显著低于MLL-AF4+者,差异有统计学意义(P=0.028)。无伪足患儿第33 d MRD≥10-4的比例高于有伪足的患儿,差异有统计学意义(P=0.025)。其他形态特征与患儿早期治疗反应,包括第8 d泼尼松反应和第78 d MRD均不相关。
2.4MLL+组预后的预测 26例MLL+组患儿随访时间为1~54(中位时间为40)个月,3年EFS(72.2±10.6)%。表2显示,骨髓原始、幼稚淋巴细胞具有核仁、嗜天青颗粒、空泡和伪足形态患儿的预后均差于无这些形态表现者;图1A显示,有、无核仁的患儿3年EFS[(55.0±15.0)%vs. 100%]差异具有统计学意义(P=0.049);有、无嗜天青颗粒的患儿3年EFS[(41.7±22.2)%vs. (83.9±10.4)%],差异无统计学意义(P=0.052); 图1C显示,比较同时具有核仁和颗粒者、具有核仁或者颗粒表现之一者、无核仁和颗粒者3年EFS分别为(26.7±22.6)%、(75.0±15.3)%和100%,差异有统计学意义(P=0.026)。联合核仁和颗粒对MLL+组患儿预后的ROC曲线分析结果显示,联合预测能力优于分别预测(0.833、0.786和0.705),P值分别为0.023、0.051和0.162(图1D)。
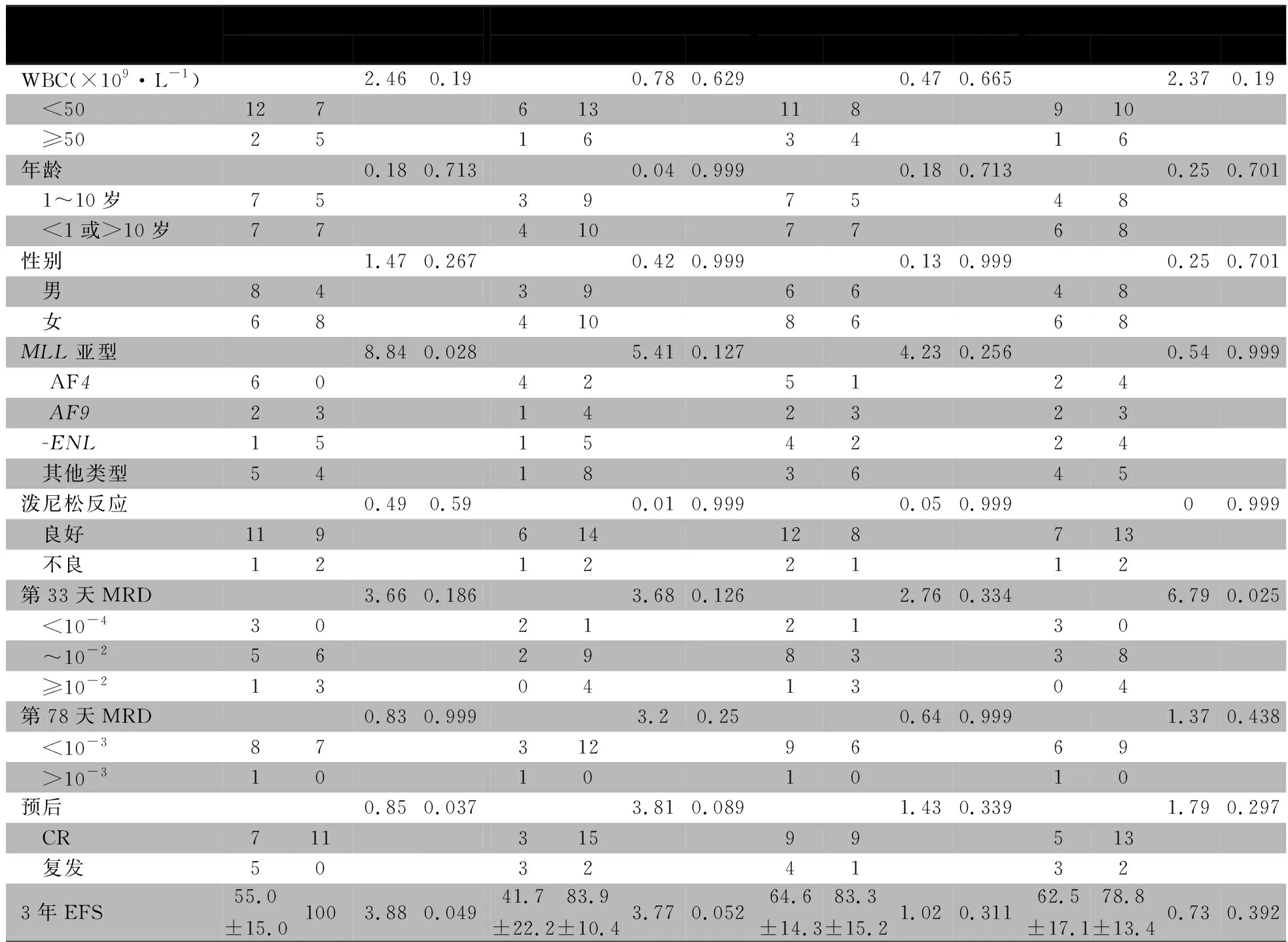
表2 骨髓形态特征与MLL基因重排阳性患者临床特征及预后的相关性[n(%)]
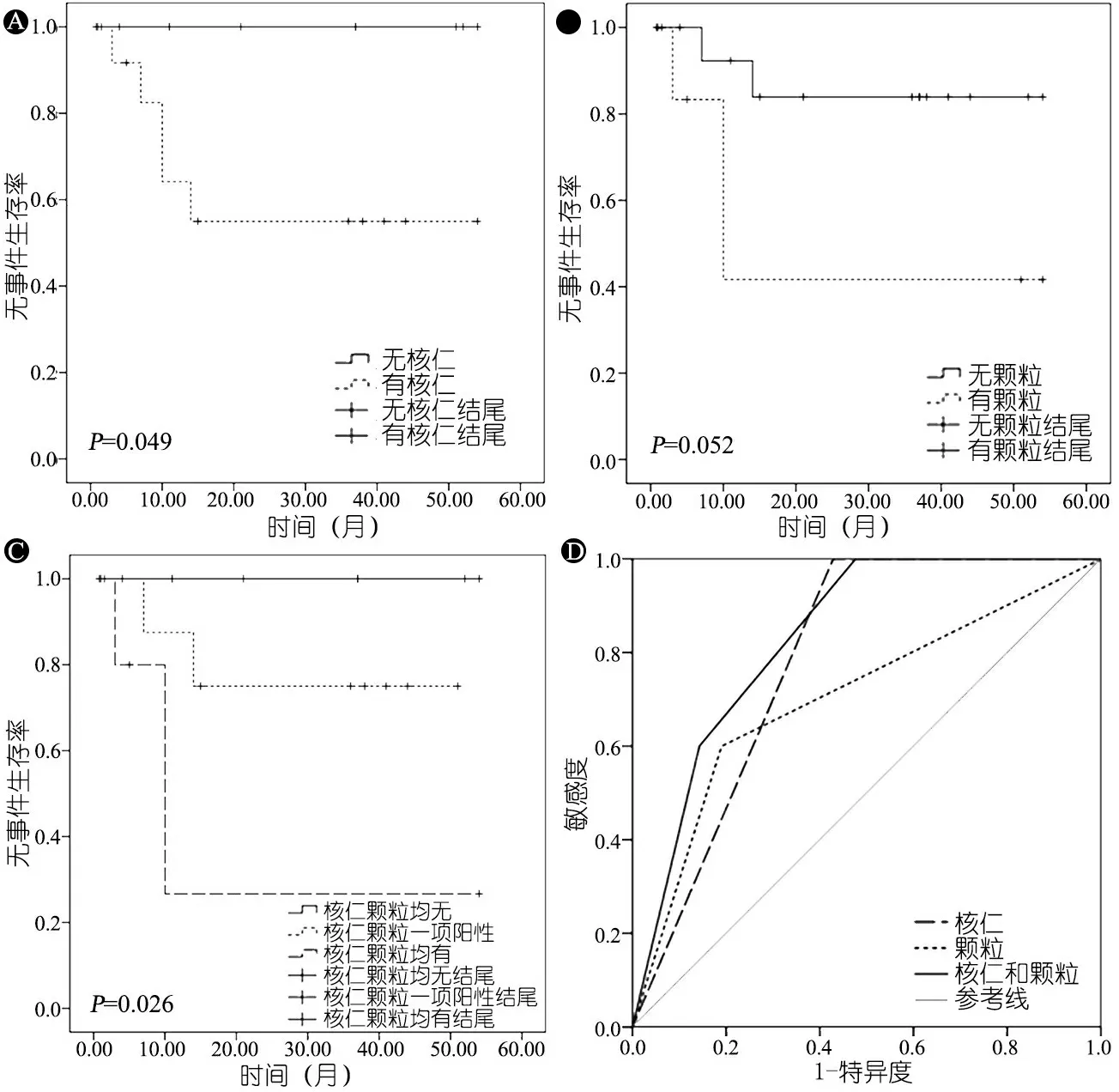
图1骨髓原始、幼稚淋巴细胞形态学特点3年生存率
3 讨论
骨髓细胞形态学检查是白血病诊断和分型的基本方法,通过对骨髓涂片中原始及幼稚粒细胞、单核细胞和淋巴细胞等进行分类和计数,可初步区分白血病类型。在临床工作中,有些ALL患者的骨髓细胞除了原始和幼稚淋巴细胞的形态特征外,常具有AML原始粒细胞和单核细胞的表现,如细胞可见伪足,胞浆中具有嗜天青颗粒。这些跨系的形态特征是否与患者的亚型相关,其存在是否与患者预后相关?MLL
基因重排是造血系统恶性肿瘤中常见的遗传学改变,在ALL和AML中均可检出,且在AML中常与原始和幼稚单核细胞形态相关[8],在ALL中其形态特征却未见相关研究和报道。本文分析了MLL+组和MLL-组ALL的骨髓细胞形态特征,虽然MLL+组ALL患儿具有空泡、伪足、颗粒和核仁的形态特征发生率比MLL-组更高,但差异无统计学意义,提示ALL上述形态特征与MLL基因重排不相关。
组织细胞内的糖原、糖蛋白或黏多糖等糖类成分,可被过碘酸氧化暴露醛基,并与无色碱性品红发生结合反应,生成紫红色复合物。通过显微镜观察PAS染色细胞,可定位、定性和定量这些糖类物质,用以判断细胞类型[9]。ALL的原幼淋细胞PAS染色多为红色颗粒或块状阳性反应,有较高的阳性率,可能与细胞糖原含量较多有密切关系[10]。而AML的原粒细胞呈阴性或胞质呈弥漫淡色阳性反应[11]。本文发现,MLL+组PAS的阳性率和赋分值均显著低于MLL-组,提示MLL+组患儿的白血病细胞发生分化阻滞的时间较早,可能阻滞于造血早期的干祖细胞,因此呈现出原粒或者原单的染色特征,这也反映了MLL基因重排白血病细胞常常具有双表型的原因。
此外, 本文结果还显示,MLL+组6例MLL-AF4+的患儿均可见到清晰的核仁,而其他类型仅有部分可见,提示MLL-AF4易位和核仁的形成有关。核仁的主要功能是进行核糖体组装与rRNA的合成,其随细胞的代谢状态和细胞周期而改变,蛋白质合成旺盛的细胞核仁大,反之核仁很小。在肿瘤细胞中核仁深染,其形态反映了肿瘤细胞活跃的 RNA 代谢和蛋白质合成[12]。提示MLL-AF4易位的白血病细胞,其肿瘤细胞的蛋白质合成和增殖比其他亚型更加旺盛。
有研究表明,细胞伪足是肿瘤细胞转移的重要结构。细胞伪足包括丝状伪足、片状伪足、侵入性伪足和足体等。 丝状伪足和片状伪足在肿瘤侵袭起始阶段起粘附作用。侵入性伪足和足体形成的关键分子是 WASP和 N-WASP,可诱导快速的肌动蛋白重组,形成细胞突起,对肿瘤细胞突破血管壁的基底膜至关重要[13]。本文结果显示,有伪足的患儿第33 d骨髓MRD≥10-4的比例显著低于无伪足的患儿, 3年EFS仅为(62.5±17.1)%,低于无伪足患儿的(78.8±13.4)%,可能与白血病细胞转移出骨髓,从而导致MRD检测数值减低。因此,尚需扩大样本例数以明确伪足和MRD、患儿预后及髓外浸润与转移等临床特征的关系。
本文结果还显示,具有核仁、嗜天青颗粒、空泡、伪足形态特征的患儿预后均差于无这些表现的患儿,且这一差异在具有核仁或嗜天青颗粒的患儿中有统计学意义。同时具有上述两个不典型形态特征的MLL+患儿预后更差,3年EFS仅为(26.7±22.6)%,对患儿预后的预测能力更强,ROC曲线下面积可达0.833。胞浆颗粒大多为营养贮藏物,贮藏高能磷酸盐,嗜碱性较强,而核仁反映细胞蛋白质合成旺盛。因此,提示具有颗粒和核仁的MLL基因重排阳性ALL患儿,其白血病细胞代谢更加旺盛,增殖更加迅速,其预后不良。
综上所述,MLL基因重排阳性ALL患儿骨髓细胞形态常见AML原始和幼稚细胞的形态特征。虽然该型患者具有相同的基因异常,但仍可通过患者细胞形态中核仁和嗜天青颗粒等特征,区分患者预后。分子遗传学诊断技术和评估方法的飞速发展,传统的形态学结合组化染色检查不仅是ALL诊断最直接和经济的重要手段,还可为临床医生提供患者重要的预后信息,故其在临床诊断和评估中仍具有重要意义和价值。
