HeLa细胞S期核仁DNA的动态分布变化和衍生过程
2022-05-31陈立梅初晓丹张德刚
关 欣,陈立梅,初晓丹,张德刚
(北华大学基础医学院,吉林 吉林 132013)
核仁是核糖体RNA基因(rDNA)和核糖体亚基装配的场所,核仁增大和数量增多通常被作为鉴别恶性肿瘤的病理标志.在电镜下观察核仁主要由纤维中心(FC)、致密纤维组分(DFC)和颗粒组分(GC)3种结构组成[1-3].研究[4-6]表明:核仁中rDNA转录是肿瘤细胞特有的、在细胞周期中以高度动态变化的特异性作用于核仁结构空间分离区域,调控核仁组装、拆卸及相应功能.核仁蛋白NPM1(Nucleophosmin)是典型的多功能的核仁蛋白,主要存在于核仁中,作为肿瘤抑制因子发挥作用,可引起核仁形态大小和数量的变化[7-8].我们前期研究[9-10]发现,核仁结构在间期以两个动态时段存在:G1期的FC/DFC是有丝分裂后以核仁组织者区(NOR)为中心构建的结构;G2期的FC/DFC是S期改构后重新构建的结构.本研究将建立细胞同步化培养体系,结合电镜DNA特异性染色方法对HeLa细胞进行观察,使用免疫荧光抗体标记NPM1蛋白,进一步探讨肿瘤细胞周期进程中S期时段核仁DNA组分及调节其表达核仁蛋白的形态学构效关系,为临床肿瘤诊疗提供新的靶点.
1 材料与方法
1.1 实验材料
实验细胞:人宫颈癌HeLa 细胞(中国医学科学院肿瘤细胞库).
主要试剂:1640培养基、胎牛血清(GIBCO公司,美国);胸腺嘧啶、 吖啶橙染色液(Sigma Aldrich公司,美国);25%的戊二醛溶液、多聚甲醛溶液和醋酸双氧铀(北京新兴百瑞技术有限公司);Epon812环氧树脂包埋剂套装(SPI公司,美国);NPM1和FITC标记IgG二抗(Cell Signaling Technology公司,美国).
1.2 HeLa细胞培养和细胞周期同步化
将HeLa细胞接种于1640新鲜培养基中,加入10%小牛血清在37 ℃含5%的CO2培养箱中孵育.当单层细胞大约生长到40%时,将2 mmol/L浓度胸腺嘧啶加入培养基中.37 ℃ 孵育18 h后,PBS(pH 7.0)冲洗细胞,加入新的1640培养基继续培养9 h,再次冲洗细胞加入胸腺嘧啶继续培养16 h,冲洗同步化细胞,继续孵育并开始释放.
1.3 核仁中DNA特异性染色和电镜超薄切片制备
为了更直接地对核仁中DNA的排布进行原位观察,采用改良的NAMA-Ur方法[11].胸腺嘧啶阻断后获取HeLa细胞,用2.5%戊二醛和4%多聚甲醛室温固定1 h,离心除去固定液,用PBS充分洗涤.将固定的HeLa细胞浸泡在NA溶液(NaOH,0.5 mol/L)4 ℃ 过夜处理,双蒸水充分洗涤后再加入1%冰醋酸洗涤3次,再用双蒸水充分洗涤.将细胞团浸入MA溶液(V(甲醇)∶V(醋酸酐)=1∶5)中,室温条件下处理24 h,直到样品适度漂白.细胞团用2.5%琼脂糖包裹离心后取前端样品,再将细胞样品团块经乙醇-甲醇系列脱水后,由甲醇和Epon812包埋剂混合液室温浸透、包埋和聚合.在Reicher Jung切片机上切成厚度为60~80 nm的超薄切片,然后用5%水溶醋酸铀60 ℃ 染色70 min.室温冷却,应用双蒸水洗涤后再烘干,在Hitachi-7500型透射电子显微镜下进行观察.
1.4 核仁DNA和RNA吖啶橙特异性染色
HeLa细胞经细胞周期同步化培养,分别收取0~16 h的细胞样品.加入95%乙醇4 ℃ 固定1 h,PBS(pH 7.0)清洗3次,再加入浓度1%的吖啶橙染色液染色15 min,PBS漂洗3次.细胞样品用90%甘油封片.激光共聚焦显微镜下观察细胞周期中核仁DNA和RNA的表达情况.为保证实验的准确性和真实性,每个样品取5个视野观察.
1.5 免疫荧光染色检测NPM1蛋白表达
将HeLa细胞经细胞周期同步化培养后分别取0~16 h的细胞样品,加入95%乙醇4 ℃ 固定1 h,PBS漂洗3次,加入0.5% TritonX-100穿孔.细胞经5% BSA封闭30 min,加入1%BSA稀释的NPM1抗体4 ℃ 过夜.加入1%BSA稀释的FITC标记的二抗,37 ℃ 杂交1 h,DAPI染色5 min,细胞样品用90%甘油封片,激光共聚焦显微镜下观察细胞周期中NPM1蛋白的表达情况.
2 结果与分析
2.1 建立HeLa细胞周期不同阶段同步化培养体系
采用胸腺嘧啶双阻断法将HeLa细胞阻断在G1/S期的临界点,以此为起始点释放,以起始点为0 h开始取样,将各时段采获的细胞样品分别定义为[9]:0~7 h 为S期(改组重构时段),8~12 h 为G2期(重构后时段),13~18 h为G1期(改组前时段),并根据核仁FC和DFC超微结构在S期发生的改组与重构前后不同时段的形态变化特征,构建了HeLa细胞核仁结构在细胞周期进程中的模式图.见图1.
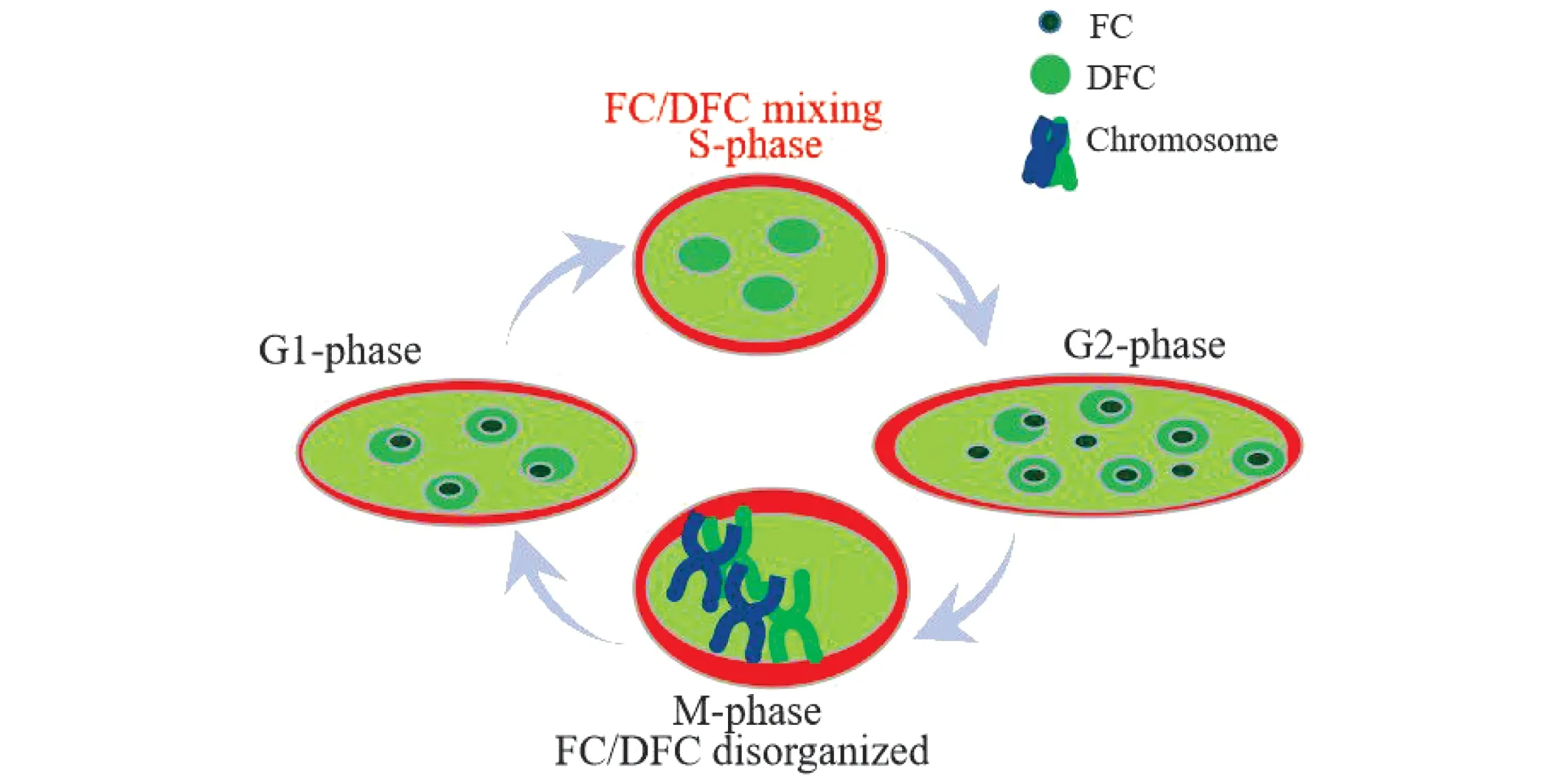
图1 HeLa细胞核仁结构在细胞周期进程中的模式Fig.1 Model diagram of nucleolar structureduring the cell cycle of HeLa cells
2.2 HeLa细胞核仁DNA组分在细胞周期不同时段的衍生过程
G1期改组前时段,核仁中较大的FC出现在核仁中央,且FC区域内部或者边缘出现染色较浅的染色质纤维,依稀可见从外向内伸入的DNA纤维.核内染色质开始解集缩成少量的条索状纤维分散在核仁,位于DFC区域的DNA组分纤维有明显的连接(见图2 a白箭头),此时DFC的密度明显高于核仁内的其他区域,变得更加的松散、宽厚,形成“云状DNA”,DFC区域的密度明显高于核仁内的其他区域,且FC与DFC的界线变得明显(见图2 a黑箭头和白箭头所示).
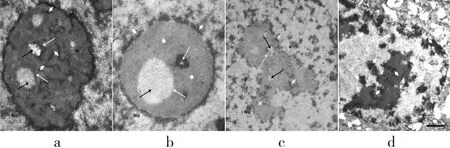
图2 HeLa细胞周期中核仁DNA结构和分布的动态衍生变化 (Bar,0.5 μm)Fig.2 Dynamic derivation change of nucleolar DNA configuration and distributionduring the cell cycle of HeLa cells (Bar,0.5μm)
在S期改组重构时段,核仁DNA组分存在两种形态:一种是在FC区域染色较浅的团块状DNA组分,一种是在匀质的结构中致密的颗粒状DNA组分(见图2 b星号).细胞核仁内FC区域有染色较浅的团块状DNA组分(见图2 b黑箭头).随着DNA快速的集缩和解集缩的形态转化,使FC和DFC结构区域从分界清晰逐渐变得模糊(见图2 b白箭头).值得注意的是,这个时段核膜周边团块状染色质开始发生集缩,连续分布于核仁周边形成一个连续的“环状”DNA组分围绕在核仁周围(见图2 b白箭头).
G2期重构后时段,核仁周围的“环状”DNA染色质纤维开始变得松散伸入核仁内部.FC区域出现染色较浅的块状DNA组分,DFC区域的DNA组分逐渐变浅,FC边缘与DFC交界处区域含有致密的颗粒状DNA组分(见图2 c黑箭头和白箭头).核仁内DNA组分的密度变得极不均匀,以较浅极细的染色质纤维的形态交联在一起与核仁周边染色质纤维相互连接的更加密集(见图2 c白箭头).随后染色质在核膜处大面积高度的集缩,呈大块染色质团块,此时核仁周边染色质延伸到核膜处,伴随这一过程核仁逐渐解体(见图2 d白箭头).结果显示:核仁周边染色质不仅是核仁结构组分FC和DFC中DNA组分的重要来源,也是维持核仁正常形态的重要物质.
2.3 吖啶橙特异性荧光染色检测DNA和RNA表达
将HeLa细胞在含2 mmol/L的胸腺嘧啶1640培养基中进行同步化培养,选取4、8、16 h的细胞,采用吖啶橙特异性荧光染色,检测细胞核内DNA和RNA表达变化情况.DNA绿色荧光分布在细胞核内和核仁周边,RNA橙色荧光在核仁中有很强的荧光信号,细胞核内荧光信号弱.观察结果显示:S期核仁体积最小,数量最少,在G2期核仁体积最大,数量最多.在G1期较强的DNA绿色荧光分布核膜处核仁周边,RNA橙色荧光主要分布在核仁内.在G2期,RNA 橙色荧光信号最强,提示RNA转录活跃程度在G2期最强.见图3.

图3 HeLa细胞间期不同时段的核内DNA和RNA表达情况 (Bar,0.5 μm)Fig.3 Nucleolar DNA and RNA expression at various time points of interphase in HeLa cells (Bar,0.5 μm)
2.4 免疫荧光染色检测NPM1蛋白表达
将HeLa细胞在含2 mmol/L的胸腺嘧啶1640培养基中进行同步化培养,选取4、8、12、16 h 的细胞.前期研究发现,通过同步化培养细胞,观察到核仁结构在细胞周期进程中是高度动态变化的.见图1.通过荧光标记检测绿色荧光的NPM1蛋白在细胞周期进程中的表达情况,结果显示:NPM1蛋白在细胞周期各时期中荧光表达水平变化较大,在G1期和S期均定位于核仁,但在核仁结构重构后的G2期表达显著增加,不仅位于核仁中,也位于核质和核膜表面.见图4.
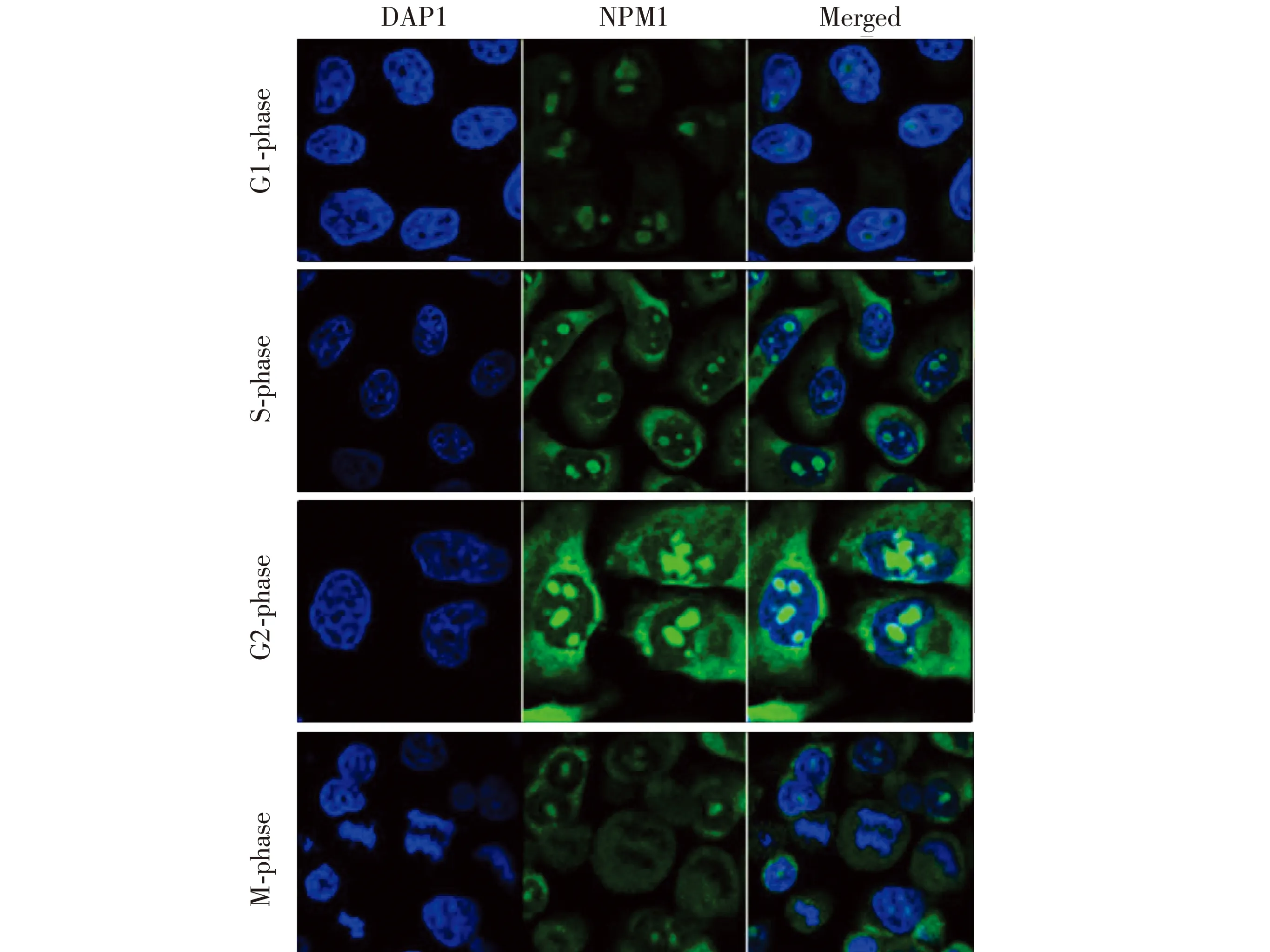
图4 HeLa细胞间期不同时段的NPMI蛋白表达情况Fig.4 NPM1 expression at various time points of interphase in HeLa cells
3 讨 论
核仁是核糖体基因(rDNA)转录和转录产物进一步加工成熟的形态学表现.最新研究发现:肿瘤细胞核仁在核糖体生物发生和调控细胞增殖中发挥着驱动中心的作用,提示核仁大小和形态变化与肿瘤的恶性程度相关,其特性可为抗肿瘤策略提供新的可行性靶点[12].而且肿瘤细胞在细胞周期多个时段存在 DNA 复制行为,这可能与 DNA 复制异常引起DNA 损伤导致肿瘤的发生有关,可见保持 DNA 的稳定性对于核仁的正常结构和功能是至关重要的[13].因此,研究肿瘤细胞核仁DNA组分及其核仁蛋白在细胞周期进程中的动态转化特点,使细胞核仁更有希望成为抗癌策略的目标靶点.
核仁结构决定其功能,核仁中DNA转录区域是肿瘤细胞特有的RNA polI唯一高效转录的靶点[3,5,12-13].我们的前期研究发现:HeLa细胞核仁结构在细胞间期的S期时段FC/DFC发生了改构与重构,核仁大小和数量随之发生改变.本研究结果显示:核仁内DNA组分动态分布是随着HeLa细胞周期进程中 FC/DFC结构高度动态变化的,共经历了3个时段:1)G1期核仁内DNA组分解集缩时形成云状DNA;2)S期核仁内DNA组分有两种分布形态:一种是在FC区域染色较浅的团块状DNA组分,一种是在匀质的结构中致密的颗粒状DNA组分;3)G2期核仁内染色较浅极细的纤维形式交联在一起.提示S期时段可能是调控核仁结构和功能的关键节点.
核仁功能的改变与核仁蛋白在核仁中的定位和易位密切相关.越来越多的研究[3,8,14]提示:核仁蛋白易位的发生是核仁结构转化的关键问题.当细胞处于有丝分裂期时核仁解体,核仁蛋白重新定位.我们前期通过对核仁结构的研究发现[9-10]:核仁在细胞周期进程中不是简单的形成和解体,而是在细胞周期进程中S期时段内其结构组分发生改构与重构;FC和DFC的数量、大小和形态变化是由核仁结构的改构与重建产生的.NPM1是典型的易位蛋白,对于维持核仁的结构和功能起着重要作用,亦可作为肿瘤抑制因子发挥作用[10].本研究结果显示:NPM1蛋白在G1期(改组前时段)和S期(改组重构时段)均位于核仁中,在G2期(重构后时段)表达显著增加,不仅存在于核仁中,也位于核质和核膜表面,提示NPM1蛋白不仅在核仁解体后重新定位,在S期时段随着核仁的改组重构也发生了易位,从而诱导核仁解聚转化,表现为核仁形态大小、数量以及DNA组分的高度动态变化.
核仁的主要功能是调控核糖体的生物合成与成熟,在调控肿瘤细胞增殖中发挥着驱动中心的作用.本研究发现:以S期改组重构时段为形态转换交界点,核仁DNA以两种形式存在:松散的“云状”DNA纤维(G1期为改组前时段和 G2期为重构后时段)和致密的染色质颗粒(S期改组重构时段)呈匀质状态均匀的分散在核仁内.根据核仁功能在其结构上区间隔离化的作用原理,我们推测核仁中DNA组分发生集缩和解集缩的高度动态变化以及NPM1蛋白从核仁到核质的易位事件,提示S期的变化可能是调控肿瘤发生的关键拐点.
