超声引导下腹横筋膜平面阻滞应用于肾移植围术期的镇痛效果评价
2019-01-24黄以庭冯雅薇高婉菱
黄以庭 冯雅薇 沈 宁 高婉菱
腹横筋膜平面的概念(Transversus Abdominis Plane,TAP)是2001年由Rafi首先提出:通过腹内斜肌和腹横筋膜层注射局麻药,阻滞疼痛刺激通过腹壁前侧感觉神经的传入,提供良好的腹壁镇痛[1]。 Mc Donnell等[2]人进一步改进、完善并拓展。长期以来,腹横筋膜平面阻滞一直没有引起重视,临床应用亦非常有限,原因主要是TAP操作均在盲探下进行,效果并不确切,更严重者可能引起神经血管损伤等,极大地阻碍了这项技术的发展。近年来,随着超声设备的普及以及可视化神经阻滞技术的发展,超声引导下TAP被广泛使用[3-5],并取得了较丰富的经验。在剖宫产术、妇科腹腔镜手术、经腹前列腺切除术以及经腹子宫全切术等手术,TAP的应用可以满足术后镇痛的要求,同时减少了围术期阿片类镇痛药的用量[6-9]。本研究旨在探讨TAP阻滞用于同种异体肾移植术,是否可以达到完善镇痛效果和减少术后镇痛的药物的要求。
1 资料与方法
1.1 一般资料
选取2015年3月—2017年12月40例行同种异体肾移植手术患者,根据随机数字表分为两组:TAP阻滞组 (TAP组,n=20)和对照组(N组,n=20);所有患者均>18岁,<60岁并签署麻醉知情同意书。排除标准为:年龄≤18岁或≥60岁;BMI≥40 kg/m2; 穿刺点皮肤感染患者;凝血异常者; 对罗哌卡因、阿片类药物或非甾体类抗炎药过敏者;二次肾移植患者;合并糖尿病、冠心病、肝功能异常的患者。
1.2 麻醉方法
1.2.1 麻醉准备 2组患者均未使用术前药,且术前均进行了血液透析,生命体征平稳。入手术室后常规开放外周静脉,滴注乳酸林格氏液500 mL。按照常规,监测患者无创血压(NIBP),血氧饱和度(SPO2),心电图(ECG)。
1.2.2 麻醉诱导 患者静脉注射异丙酚1.5 mg·kg-1、咪达唑仑0.04 mg·kg-1、顺式阿曲库铵0.2 mg·kg-1、芬太尼2 μg·kg-1后行气管导管,听诊双肺呼吸音对称后接麻醉机辅助通气,术中维持呼气末二氧化碳分压(PetCO2)为35~45 mmHg。所有患者均行颈内静脉和桡动脉穿刺置管。
1.2.3 TAP阻滞 麻醉诱导结束后,TAP组患者使用0.375% 罗哌卡因40 mL行超声引导下双侧TAP阻滞,对照组不进行操作,所有阻滞由3名熟练操作区域麻醉的医生完成。患者处于平卧位,暴露肋缘至髂嵴之间的腹部区域。常规安尔碘消毒后铺无菌巾,无菌腔镜套覆盖B超探头。将超声探头横向置于肋缘与髂嵴之间、腋前线或腋中线附近,辨认腹部 3 层肌肉:腹外斜肌、腹内斜肌、腹横肌。调整探头位置,获得最为清楚的 TAP阻滞图像。固定探头位置后,在探头上方采用平面内进针的方法,在超声可视状态下,进针至腹内斜肌与腹横肌之间,确认针尖位置,回抽无血后每侧给予0.375 %罗哌卡因20 mL。在两层肌肉之间产生一个低回声的梭形的影像表明TAP操作成功。
1.2.4 麻醉维持 持续吸入七氟烷,维持麻醉深度达到1.0 MAC,同时微量泵持续输注顺式阿曲库铵维持足够肌松。手术于TAP阻滞完成30 min后开始。术中维持血流动力学稳定,若BP和HR波动大于基础值20%,对应的给予芬太尼或多巴胺处理。手术结束前30 min静脉注射吗啡3 mg作为首剂镇痛。
1.2.5 术后镇痛 术毕采用低背景剂量静脉镇痛,泵内药物配方:舒芬太尼120 μg+阿扎司琼30 mg用生理盐水稀释到120 mL。背景输注剂量0.5 mL·h-1,单次剂量4 mL,锁定时间15 min,镇痛时间48 h。
1.3 观察指标
记录切皮前后的HR、SBP和DBP差值(ΔHR、ΔSBP、ΔDBP)、术中芬太尼、顺式阿曲库铵用量、手术时间,术毕拔管时间(手术结束至拔出气管导管)。评价指标及标准:①术后12 h、24 h、48 hVAS评分 (0分为不痛,10分为极度不可忍受的疼痛);②记录术后48 h镇痛满意程度 (0分为不满意,10分为最满意);③术后自控静脉镇痛(Patient Controlled Intraveous Analgesia,PCIA)舒芬太尼的使用量;④拔管时间、术后躁动发生率。
1.4 统计学分析
2 结果
2.1 两组患者一般情况比较
两组患者一般情况比较差异无统计学意义(P>0.05),见表1。
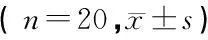
表1 两组患者的基本情况
2.2 两组患者切皮前后生命体征变化
TAP组切皮前后ΔHR、ΔSBP和ΔDBP明显小于N组(P<0.05),见表2。
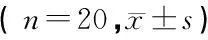
表2 两组切皮前后生命体征变化
注:与TAP组相比,1)P<0.05
2.3 两组患者术中芬太尼、顺式阿曲库铵及PCIA舒芬太尼用量比较
TAP组术中芬太尼及术后24 h PCIA药物用量明显少于N组(P<0.05),但顺式阿曲库铵用量无显著差异,见表3。
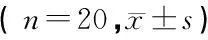
表3 两组术中芬太尼、顺式阿曲库铵及PCIA舒芬太尼用量比较
注:与TAP组相比,1)P<0.05
2.4 两组患者拔管时间、术后躁动及苏醒延迟发生率比较
TAP组拔管时间、术后躁动及苏醒延迟发生率明显少于N组(P<0.05),见表4。
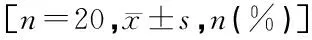
表4 两组拔管时间、术后躁动及苏醒延迟发生率比较
注:与TAP组相比,1)P<0.05
2.5 两组患者各时间点VAS评分及满意度比较
TAP组各时间点VAS评分明显少于N组,满意度高于N组(P<0.05),见表5。
表5 两组患者的各时间点VAS评分及满意度比较
注:与TAP组相比,1)P<0.05
3 讨论
肾移植手术是延长终末期肾病患者存活时间的有效手段。由于肾移植患者的术后疼痛可诱发交感神经兴奋,增加血管活性物质释放和血管收缩,减少移植肾血液灌注继而影响肾功能,因此完善的术后镇痛对于肾移植患者是有益的。有研究表明:同种异体肾移植术后应用硬膜外自腔镇痛(Patient Controlled Epidural Analgesia,PCEA)能有效消除术后切口疼痛引起的焦虑,减轻交感神经的兴奋导致的肾功能的损害,从而加速肾功能的恢复[10],但镇痛方式以及配方仍然存有争议[11]。目前常用的镇痛药物多为阿片类药物,虽然有研究表明用吗啡进行病人自控镇痛(Patient Controlled Analgesia,PCA)能有效缓解术后疼痛,促进移植肾复苏12-13],但是这类药物却有可能加重肾脏负担,有的药物剂量稍大则易引起呼吸抑制,因此,安全且高效的镇痛成为目前肾移植术后患者面临的重要课题。
许多研究表明,TAP显著减少阿片类药物的用量和相关副作用,使患者满意度和舒适度增加,同时也使术后镇痛更加安全。以前曾于盲探下行TAP阻滞,但容易引起诸如镇痛不全及穿刺损伤血管 、脏器等[14]。随着超声技术和设备的进步,在B超引导下进行TAP,可以实时观察到穿刺针影像的位置、路径以及与周围血管神经的关系,最后注药时亦能实时看到局麻药液的扩散位置和速度,极大地提高了TAP操作的安全性及有效性[15-16]。
本研究中发现:切皮前后ΔHR、ΔSBP和ΔDBP比较TAP组明显小于N组(P<0.05),差异有统计学意义,说明TAP有着良好的镇痛效应,抑制了切皮导致的心血管应激反应,而术中TAP组芬太尼用量明显少于N组也证实了这个结论,同样,TAP组术后24 h PCIA舒芬太尼用量明显少于N组,差异有统计学意义,也说明TAP能在较长时间维持对心血管应激反应的抑制作用。另外,术毕拔管时间TAP组明显短于N组(P<0.05),术后躁动及苏醒延迟发生率亦显著低于N组,反应了TAP不仅可以加快患者苏醒,而且还有更高的苏醒质量;同时,TAP组患者术后VAS评分低于N组(P<0.05),而满意度高于N组(P<0.05),说明TAP会让患者有更好和更舒适的术后镇痛体验。这些结果表明TAP的应用既可以减少术中阿片类药物的应用,又可以提供良好的术后镇痛,减轻患者疼痛应激反应,同时有着较好的苏醒质量,患者对于术后镇痛效果的满意度也较高,这与以前的类似研究有相似的结论。
综上所述,对于肾移植患者,提供良好的术后镇痛是有必要的,TAP的合理应用可以达到既满足镇痛要求,又减少阿片类药物使用,减少术后疼痛评分,值得在肾移植患者中推广应用。
