幽门螺旋杆菌根除后胃癌:1例报道
2019-01-24钱爱华李为光张本炎王华枫芮玮玮孙蕴伟
钱爱华,陈 希,李为光,吴 巍,张本炎,王华枫,芮玮玮,袁 菲,孙蕴伟
上海交通大学医学院附属瑞金医院 1.消化科; 2.病理科, 上海 201801
虽然根除幽门螺旋杆菌(Helicobacter pylori,H.pylori)可以减少胃癌,即使接受除菌治疗的病例正在增加,但除菌后胃癌病例也不少见。TAKE等[1]报道根除后胃癌的发病率为每年0.3%,即使成功根除后仍需进行仔细的内镜检查。胃癌通常具有较长的自然过程,相对较长的倍增时间为1.4年。根据先前的内镜筛查,在根除后1年内发现的大多数胃癌可能是被漏诊的病例。那么除菌后胃癌有哪些特点,如何早期发现该型胃癌有利于极大程度改善患者的预后。现报道1例H.pylori根除后胃癌的诊治经过。
病例患者,男,55岁。主因“间断上腹部不适9年,发现胃窦黏膜上皮内瘤变1月余”入院。患者9年前无明显诱因出现午后上腹不适,不伴恶心、呕吐、心慌、头晕等,当地医院行胃镜检查示(2010年6月24日)慢性浅表性胃炎伴糜烂,胃多发性溃疡,H.pylori(++)。给予抑酸+抗H.pylori治疗后症状好转。此后定期复查胃镜,显示慢性浅表性胃炎伴糜烂,予口服抑酸剂(PPI)及胃黏膜保护剂治疗。2015年4月6日呼气试验阴性。1个月余前当地医院复查胃镜示(2018年9月22日)慢性萎缩性胃炎(O1型)伴糜烂、胆汁反流。胃窦活检病理(2018年9月28日)黏膜急、慢性炎伴肠化,小灶腺体轻-中度不典型增生,H.pylori(-)。患者平素有间断服用PPI药物史。起病以来,患者饮食、精神、睡眠可,小便外观正常,大便如前述。体质量无明显变化。既往史:体健。否认高血压、糖尿病、冠心病病史,否认乙肝、伤寒结核等传染病病史,否认食物、药物过敏史,否认输血史。无吸烟、饮酒史。否认家族相关疾病史。有高血脂、脂肪肝、肝囊肿病史。入院后体格检查无明显阳性体征。入院后血、尿、粪常规未见明显异常。肝肾功能正常。消化道肿瘤指标正常范围。入院后行蓝激光放大胃镜精查。胃窦可见散在肠化样改变,前壁见一处发红样平坦略凹陷型病灶大小约1.0 cm,边界欠清(见图1A),胃体小弯侧黏膜萎缩(O1型),延伸至贲门,较多肠化样改变。白光下接近观察可见病变处腺管结构粗大,边界不清,较多肠化外观(见图1B)。白光放大提示局部腺管粗大,拉长,排列尚规则,边界不清,周边黏膜肠化改变(见图1C)。联动成像(linked color imaging,LCI)模式显示病变处呈紫红色调,周边黏膜呈斑片状粉红色,边界不清(见图1D~E)。LCI下放大观察与白光下放大类似(见图1F)。靛胭紫染色显示边界不清,呈平坦型,中央略凹陷(见图1G)。靛胭紫染色白光放大中央略凹陷处显示可见乳头状结构(见图1H),进一步LCI模式下放大观察乳头样结构大小不一(见图1I),局部有发白处在LCI及蓝激光成像(blue laser imaging,BLI)模式下腺管显示不清,周边腺管结构规则,微血管未见明显异常(图1J~K)。BLI放大显示部分表面腺管粗大,拉长,大小不一,排列尚规则,微血管规则(见图1L)。局部活检病理提示浅表黏膜慢性炎,肠化(+),小灶腺体呈高级别上皮内瘤变,H.pylori(-)。
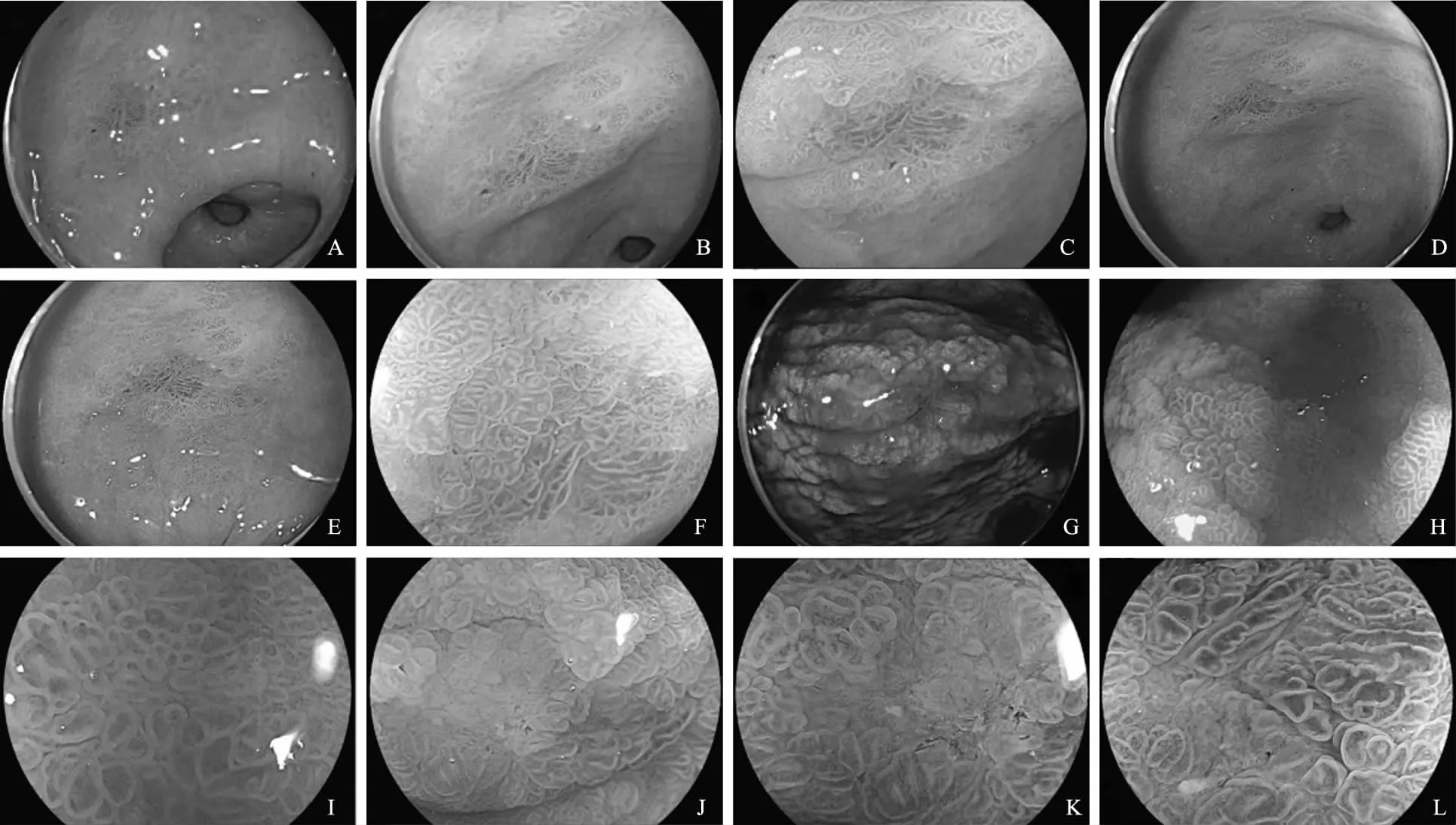
图1胃内病变内镜下表现A~C:白光远景、近景、放大;D~F:LCI模式远景、近景、放大;G~I:靛胭紫染色近景、弱放大、强放大;J:靛胭紫染色LCI模式下放大;K~L:BLI放大
Fig1EndoscopicimagesofgastriclesionsA-C: vision, close-up, magnification in white light; D-F: vision, close-up, magnification in LCI mode; G-I: close-up, weak magnification, strong magnification with indigo staining; J: magnification in LCI mode withindigo staining; K-L: magnification in BLI model
排除禁忌证后行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),术中见胃窦小弯侧一处黏膜发红(见图2A),窄带成像(narrow band image,NBI)模式下显示发红处呈茶褐色,边界欠清(见图2B),于病变周边进行环周标记(见图2C),黏膜下注射后病变周边环周切开(见图2D~E),沿着黏膜下层逐步切开,完整切除病灶(见图2F)。
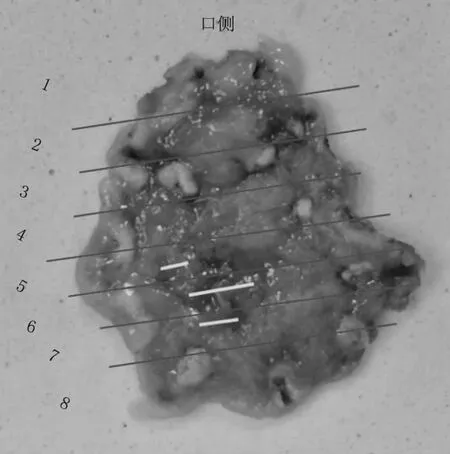
术后病理标本中央黄色虚线内为内镜下黏膜发红处(见图3A),标本连续切条,共切8条组织(见图3B)。术后病理显示其中第5条组织显示局灶高级别上皮内瘤变(红框内)(见图4A),高倍视野内显示高级别上皮内瘤变组织位于正常腺管下方(见图4B~D,红色箭头显示)。第6条组织条同样有类似表现(见图5A),高倍视野内显示高级别上皮内瘤变组织上方腺管明显增宽(见图5B~C,红色箭头显示),表面部分上皮组织可见下方高级别上皮内瘤变上皮的延伸(见图5D,黄色箭头显示)。第7条组织条可见类似表现(见图6)。病理复原后如图7所示,黄色线条部分为高级别上皮内瘤变部分。术后病理显示标本大小2.2 cm×2.0 cm×0.3 cm,病变范围镜下最大径约0.2 cm×0.05 cm,组织类型为高级别上皮内瘤变,脉管内癌栓阴性,神经侵犯阴性,侧切缘阴性,基底切缘阴性。
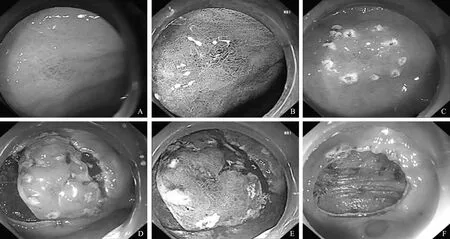
图2内镜下完整切除病灶A:白光内镜照片;B:NBI下内镜照片;C:病灶环周标记;D:病灶环周切开(白光);E:病灶环周切开(NBI);F:内镜切除后创面
Fig2CompleteresectionofthelesionunderendoscopyA: white endoscopy image; B: endoscopic image under the NBI; C: peripheral markers of the lesion; D: the lesion was circumferentially incision (white light); E: peripheral incision of the lesion (NBI); F: wound after endoscopic resection
讨论本例患者为中年男性,慢性病程,临床表现为间断上腹部不适9年,第一次胃镜提示胃多发溃疡糜烂伴H.pylori感染,给予除菌治疗后,仍有反复间断中上腹不适。3年前呼气试验显示H.pylori阴性。该患者有长期间断服用PPI药物史。近期复查胃镜显示胃重度萎缩伴肠化表现。此次胃镜病理活检发现有高级别上皮内瘤变,术后ESD提示胃窦局灶高级别上皮内瘤变。该患者为H.pylori根除后8年发现的胃癌。
虽然根除H.pylori可以减少胃癌[2-4],然而,即使接受除菌治疗的病例正在增加,但除菌后胃癌病例也不少见[1,5]。KAMADA等[6]研究发现,在H.pylori根除后胃癌特征主要有大小<20 mm,位于胃中下部,表现为凹陷型外观和分化型组织学特点。近期SAKA等[7]研究发现了相似的结果。该患者常规内镜下表现符合上述特征。因此根除H.pylori后仍应仔细进行随访内镜检查,特别注意凹陷型胃癌。
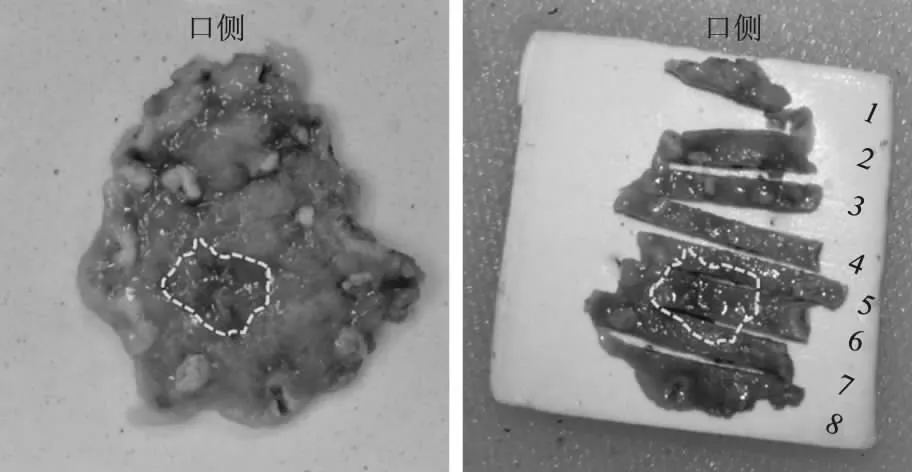
图3 ESD术后标本及组织切条 A:ESD术后完整标本(黄色虚线框内内镜下发红区域);B:ESD术后标本组织切条Fig 3 Specimen and tissue cuts after ESD A: complete specimens after ESD (yellow dashed box: red areas in endoscopy); B: specimen tissue cutting after ESD
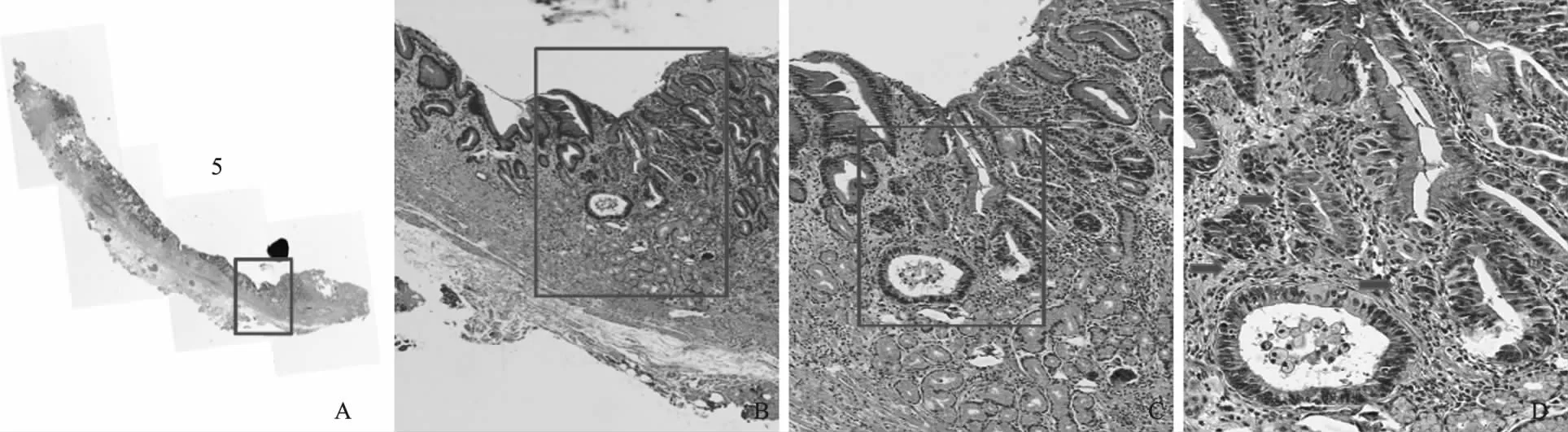
图4 ESD标本第5条组织条的病理 A:第5条组织条全景(红色框内为病变处);B:A图红色框内进一步放大(5×);C:B图红 色框内进一步放大(10×);D:C图红色框内进一步放大(20×),红色箭头显示局部高级别上皮内瘤变
Fig4Thepathologyofthetissuestrip5A: organizational panorama (in the red box was the lesion); B: the red box in A image was further enlarged (5×); C: the red box in B image was further enlarged (10×); D: the red box in C image was further enlarged (20×),
and the red arrow showed local high-grade intraepithelial neoplasia
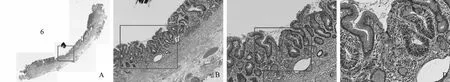
图5ESD标本第6条组织条的病理A:第6条组织条全景(红色框内为病变处);B:A图红色框内进一步放大(5×);C:B图红色框内进一步放大(10×);D:C图红色框内进一步放大(20×),红色箭头显示局部高级别上皮内瘤变,黄色箭头显示高级别上皮内瘤变细胞蔓延至胃黏膜正常上皮
Fig5Thepathologyofthetissuestrip6A: organizational panorama (in the red box was the lesion); B: the red box in A image was further enlarged (5×); C: the red box in B image was further enlarged (10×); D: the red box in C image was further enlarged (20×).
The red arrow showed local high-grade intraepithelial neoplasia and the yellow arrow showed the high-grade intraepithelial neoplasia cells extend along the normal gastric mucosal epithelium
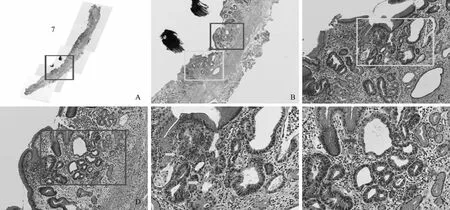
图6ESD标本第7条组织条的病理A:第7条组织条全景(红色框内为病变处);B: A图红色框内进一步放大(5×);C:B图黄
色框内进一步放大(10×);D: B图红色框内进一步放大(10×);E:C图黄色框内进一步放大(20×),黄色箭头显示局部高级别上皮内瘤变;F:D图红色框内进一步放大(20×),红色箭头显示局部高级别上皮内瘤变
Fig6Thepathologyofthetissuestrip7A: organizational panorama (in the red box was the lesion); B: the red box in A image was further enlarged (5×); C: the yellow box in B image was further enlarged (10×); D: the red box in B image was further enlarged (10×); E: the yellow box in C image was further enlarged (20×). The yellow arrow showed local high-grade intraepithelial neoplasia; F: the red box in D image was further enlarged (20×). The red arrow showed local high-grade intraepithelial neoplasia
注:黄色线条代表局部高级别上皮内瘤变。图7 ESD术后标本病理复原图Fig 7 TheFigure of ESD postoperative specimen pathological recovery
除了上述常规内镜下特点外,H.pylori根除后胃癌在放大内镜下会出现胃炎样外观。这最初是由KOBAYASHI等[8]报道的。研究发现H.pylori根除后胃癌在放大NBI成像下的“胃炎样”外观的特征是均匀的乳头和/或管状凹陷,边缘发白,有规则或模糊的微血管,分界不清晰,类似于邻近的非癌黏膜。这些表型特征或变化使得根除H.pylori后胃癌的内镜下诊断变得困难。事实上,据报道,使用染色内镜检查并未提高根除H.pylori后胃癌的诊断可靠性。该患者放大内镜检查也表现为“胃炎样”外观,因此出现放大内镜诊断的不确定性。
除菌后胃癌的这些内镜特征与被称为“非肿瘤上皮”的组织学特征相关。H.pylori除菌后胃癌病理学特点主要表现为分化型肿瘤和出现非肿瘤上皮覆盖癌组织的特点,导致除菌后胃癌难以发现。KITAMURA等[9]研究发现,在H.pylori成功根除后的27例胃癌病例中,有22例观察到有非肿瘤性上皮命名为根除后低度异型性上皮后经常出现在胃癌表面。SAKA等[7]研究发现,在H.pylori除菌后胃癌频繁地观察到非肿瘤性上皮覆盖,而且在超过90%这类病变中非肿瘤上皮覆盖超过10%的癌性区域。该研究进一步证实,胃炎样外观可归因于覆盖癌组织的非肿瘤上皮。该患者ESD术后病理亦提示存在非肿瘤上皮覆盖癌组织。
H.pylori根除后仍然发生胃癌的危险因素有哪些?研究发现严重的萎缩提示除菌后胃癌发生风险较高。UEMURA等[10]报道H.pylori在胃癌发生过程中的重要作用,严重的内镜萎缩是H.pylori感染病例中胃癌发展的危险因素。对于根除H.pylori的患者,TAKE等[1]研究了1 674例H.pylori根除消化性溃疡患者胃癌发生相关的危险因素。在H.pylori根除术后的平均5.6年的随访期间,他们发现28例胃癌,平均年龄为51岁。除菌前轻度(C1和C2)、中度(C3和O1)和重度萎缩(O2和O3)患胃癌的风险分别为每年0.04%、0.28%、0.62%。在上述研究中多变量分析显示,组织学上的肠上皮化生和严重的内镜萎缩是胃癌发展的独立风险。除菌后重度萎缩发生胃癌的风险是无萎缩或轻度萎缩的9.3倍。SHICHIJO等[11]研究也发现组织学肠化及内镜下萎缩是除菌后胃癌发生的预测因素。除此以外,CHEUNG等[12]最近报道,根据香港的全港健康数据库,长期使用PPI与H.pylori根除治疗后受试者的胃癌风险增加有关。该患者存在严重的萎缩(O1)及组织学肠化表现,同时有长期间断服用PPI病史,这些均表明其存在除菌后胃癌发生的高风险性。
因此,H.pylori感染需在造成胃内严重萎缩及肠化前尽早除菌,除菌时如果内镜下已经出现重度萎缩及肠化,除菌后仍需要密切随访内镜。对于这些高危人群内镜检查需要更为仔细且需要注意H.pylori除菌后胃癌的内镜下特点。
