肿瘤相关巨噬细胞不同表型对胃癌MGC-803细胞侵袭与迁移的影响
2019-01-24岳文莉田同德田同良
岳文莉, 田同德, 田同良, 杨 督
郑州大学附属肿瘤医院中西医结合科,河南 郑州 450008
胃癌是最常见的消化道肿瘤,死亡率居于所有恶性肿瘤的第2位,我国是胃癌高发国家,发病和死亡例数远高于其他国家,是我国癌症防治的重点[1]。尽管过去几十年中治疗手段不断丰富,但对于胃癌的复发和转移仍无很好的解决办法,治疗预后较差。肿瘤细胞通常处于一个复杂的微环境中,肿瘤微环境由免疫细胞、基质细胞、内皮细胞以及多种细胞因子和趋化因子等组成,在肿瘤组织微环境中有许多巨噬细胞的浸润,这些细胞被称为肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)[2]。TAMs参与肿瘤的侵袭和迁移,在肿瘤微环境中存在两种不同的分化类型,分别是经典活化的巨噬细胞M1型(classically activated macrophage,caMphi)和替代性活化的巨噬细胞M2型(alternatively activated maemphage,aaMphi)。M1型巨噬细胞活化需要干扰素-γ(IFN-γ)和细菌及其产物脂多糖(LPS)等细胞因子相互作用进一步表现出较高的抗原提呈能力。可分泌多种炎症因子,如IL-1、IL-6、IL-12、肿瘤坏死因子(TNF)和趋化因子CCL2、CCL5、CCL22等,对细菌病原体和肿瘤细胞有杀伤作用。M2型巨噬细胞的活化不像M1型巨噬细胞需要多种细胞因子相互作用,但需要有合适的诱导剂,如IL-4、IL-10、转化生长因子-β(TGF-β)等。可高分泌IL-1受体拮抗剂和趋化因子CCL17、CCL22及巨噬细胞替代激活相关化学因子(AMAC-1)等,具有抑制免疫应答和促进伤口愈合的能力[3]。巨噬细胞极化的信号通路特别复杂,在已有的研究中TAMs表型对肿瘤细胞影响具有双重性。本研究希望通过建立胃癌MGC-803细胞与M1、M2型巨噬细胞共培养体系,模拟胃癌细胞侵袭、迁移的体外实验,更加深入地了解胃癌细胞在巨噬细胞影响下自我复制、分化的能力,拟于通过研究了解不同细胞因子对胃癌的作用,改变肿瘤的免疫微环境以找到新的治疗胃癌的方法。
1 材料与方法
1.1材料与试剂人胃癌细胞MGC-803人单核样淋巴瘤细胞U937均购自中国医学科学院基础医学研究所基础医学细胞中心。DMEM高糖培养基、RPMI 1640培养基、胎牛血清、质量浓度为25 g/L的胰酶细胞消化液购自以色列BI公司,PBS磷酸盐缓冲液粉末、DAPI溶液(1 g/L)、细菌LPS、人IL-4、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒购自北京Solarbio公司,佛波酯(PMA)购自美国Sigma公司,人IL-10、IL-12 P70 ELISA试剂盒购自江苏ExCell Bio公司,6孔板、6 cm细胞培养皿、10 cm细胞培养皿购自无锡NEST公司,15 ml离心管、50 ml离心管、1.5 ml EP管、0.5 ml EP管、枪头购自美国Biologix公司,Transwell 24孔板购自美国Corning公司,TNF-α、IFN-γ、TGF-β、NF-κB P65抗体购自美国Abcam公司,PVDF膜购自美国MILLIPORE公司,超敏ECL化学发光试剂盒购自江苏碧云天公司。GE Healthcare ImageQuant LAS 4000mini凝胶成像仪购自美国,Thermo Fisher SCENTIFIC Multiskan-1510型全波长酶标仪购自美国。
1.2实验方法
1.2.1 U937细胞培养诱导分化:U937细胞于RPMI 1640完全培养基中(含质量浓度为100 g/L的FBS),置于37 ℃、体积分数为5%的CO2细胞培养箱中培养,2~3 d传代。取对数生长期U937细胞,经预实验结果选取PMA 40 ng/ml诱导单核细胞分化,且连续培养72 h分化效果最佳,用10 cm细胞培养皿加入1×106ml-1细胞悬液6 ml/皿培养。观察细胞贴壁情况,>80%细胞贴壁即可开始实验,此时细胞为未极化的巨噬细胞Mφ。PBS洗涤3遍,去除不贴壁细胞及死亡细胞,且经预实验可以得出,M1及M2细胞分别经25 μg/ml LPS及15 ng/ml IL-4诱导48 h的诱导效果最佳,取3个离心管中,分别加入6 ml RPMI 1640完全培养基,并依次加入0.24 μl PMA贮存液、15 μl LPS贮存液和18 μl IL-4贮存液,充分混匀,配制成40 ng/ml的PMA工作液、25 μg/ml的LPS工作液和15 ng/ml的IL-4工作液,分别加入诱导后未分化的巨噬细胞Mφ中,置于37 ℃、体积分数为5%的CO2细胞培养箱中培养48 h的诱导效果最佳。
1.2.2 通过ELISA鉴定U937细胞表型:从培养箱中取出3种细胞的培养皿,分别收集3种细胞上清液至3个新的1.5 ml EP管中,在试剂盒配备的板条中以100 μl/孔,分别加入稀释好的标准品及样本,同时留取空白孔,每孔准备2个副孔。除空白孔外,50 μl/孔加入生物素化抗体,室温孵育120 min。甩板,每孔加入200 μl的洗涤液,静置30 s后甩板,重复洗涤5次。除空白孔外,每孔加入100 μl的酶结合物工作液,之后室温孵育60 min。重复洗涤5次,包括空白孔,每孔加入100 μl显色剂,室温避光孵育15 min。包括空白孔,每孔加入100 μl/终止液,混匀后用全波长酶标仪测量OD450的值;导出Excel表格,计算各浓度平均值,绘制浓度-OD450值的曲线,计算样本含量。
1.2.3 Western blotting检测:提取细胞总蛋白,BCA法测定蛋白质浓度。制备SDS聚丙烯酰胺凝胶,按4∶1比例加入5倍蛋白上样缓冲液后,100 ℃煮沸5 min,上样,电压设定为60 V,恒压电泳,质量浓度为150 g/L的分离胶,待溴酚蓝即将跑出凝胶范围即可停止,制备“三明治”,顺序依次为负极、3层滤纸、SDS凝胶、PVDF膜、3层滤纸、正极,整个操作过程完全浸泡在1×Trans工作液中进行,务必排尽气泡,将制备好的“三明治”放入转移槽中,按正负极连接电泳仪,200 mA恒流转膜1.5 h,丽春红染色,在TBST工作液中漂洗2~3遍后移入封闭液中,置于摇床上,15 r/min室温摇荡1 h封闭,根据蛋白分子量加入对应的一抗抗体4 ℃,10 r/min摇荡12 h,TBST洗膜后加入二抗,15 r/min室温摇荡2 h,经TBST洗膜后加入超敏ECL发光液,应用化学发光凝胶成像系统分析目的蛋白的表达。
1.2.4 胃癌MGC-803细胞的培养:从-80 ℃冰箱或液氮罐中取出1支冻存的人胃癌MGC-803细胞,37 ℃水浴3~5 min,待充分融化后通过传递仓拿入细胞间,反复洗涤3~4遍,将冻存液洗掉,取10 cm细胞培养皿,加入7 ml DMEM完全培养基,皿盖上标明细胞种类、培养基种类、培养人姓名及日期,洗涤后的细胞内加入1 ml DMEM完全培养基,充分吹打混匀,加至培养皿内,放培养箱培养,传代3次后,待细胞成对数期生长时可使用细胞进行实验。
1.2.5 胃癌MGC-803划痕实验:将对数生长期MGC-803细胞接种于预先底部标记的6孔板内,待细胞贴壁生长100%,用20 μl无菌枪头于底部划痕,PBS漂洗去除脱落坏死细胞,再用无血清培养液培养,继续培养。划痕后0、24、48、72、96 h选择划痕区固定3个视野拍照,比较各时间段划痕愈合的情况,计算MGC-803细胞的划痕愈合率,划痕愈合率(%)=(0 h划痕平均宽度-每24 h后划痕平均宽度)/0 h划痕平均宽度×100%,通过划痕愈合率观察MGC-803的迁移能力。
1.2.6 Transwell实验:侵袭实验选用孔径为8 μm的Transwell小室为上室,以1∶4的比例稀释Matrigel基质胶,吸取稀释好的基质胶70 μl到小室上室中,待胶凝固后,上室加2×105ml-1无血清培养基的Mφ、M1、M2细胞混悬液250 μl,下室加入完全培养基MGC-803细胞混悬液750 μl,37 ℃细胞培养箱中孵育24 h,取出小室用质量浓度为100 g/L的TCA(三氯乙酸)4 ℃、1 h固定细胞,PBS清洗3遍,用质量浓度为5 g/L 结晶紫常温孵育2 h,用PBS洗2遍尽量洗净小室内结晶紫,用棉棒轻轻擦拭小室里面无侵袭的细胞,随机选取10个视野,显微镜200倍下计数侵袭至上室外的细胞并拍照。
1.3统计学方法所有实验重复3次以上,采用SPSS 20.0统计软件进行统计分析,计数资料对比采用卡方检验;计量资料,对多组数据间比较符合正态分布进行单因素方差分析,不符合正态分布进行非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1人巨噬细胞的诱导分化及表现鉴定未经PMA诱导的人单核细胞淋巴瘤细胞U937成悬浮生长的圆球形(见图1),经PMA诱导48 h后大部分细胞由悬浮逐渐形成贴壁状态伸出伪足,呈长梭形,具备巨噬细胞形态,为TAMs诱导分化成功状态(见图2)。U937细胞诱导的M1型巨噬细胞较同细胞来源的Mφ细胞分泌的IL-10偏低、IL-12p70偏高,且IL-10的差异有统计学意义(P<0.05)。U937细胞诱导的M2型巨噬细胞较同细胞来源的Mφ细胞分泌的IL-10偏高、IL-12p70偏低,且IL-10的差异有统计学意义(P<0.05)。U937来源的M1、M2型巨噬细胞分泌的IL-10和IL-12p70间的差异均有统计学意义(P<0.05)(见
表1、图3~4)。诱导后肿瘤相关巨噬细胞M1型可分泌IL-6、TNF-α等促炎因子,对肿瘤细胞起抑制作用,在Western blotting中与β-actin相比为高表达,在NF-κB P65、HIF-1α等抗炎因子中为低表达,M2型肿瘤相关巨噬细胞可分泌NF-κB p65、HIF-1α等抗炎因子,对肿瘤细胞起促进作用,在Western blotting中与β-actin相比为高表达,在IL-6、TNF-α等促炎因子中为低表达,Mφ巨噬细胞介于M1、M2型巨噬细胞之间,更倾向于M2型巨噬细胞,对MGC-803细胞的增殖有一定的促进作用(见图5~6)。

图1未经PMA诱导的人单核细胞淋巴瘤U937;图2经PMA诱导48h后未分化的巨噬细胞Mφ
Fig1HumanmononuclearlymphomacellU937notinducedbyPMA;Fig2Undiffe-rentiatedmacrophageMφafter48h
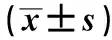
induced by PMA
注:与同细胞来源Mφ相比,*P<0.05;▲P<0.01;与同细胞来源M1相比,■P<0.05;●P<0.01。
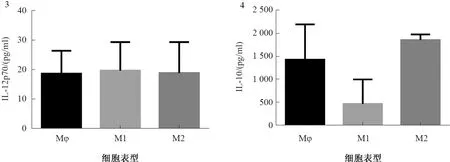
图3 U937细胞来源不同表型细胞分泌IL-12p70;图4 U937细胞来源不同表型细胞分泌IL-10Fig 3 Different phenotypic cells secreted IL-12p70 from U937 cells;Fig 4 Different phenotypic cells secreted IL-10 from U937 cells
2.2MGC-803的侵袭、迁移作用待细胞在培养皿内覆盖率达95%时开始划痕实验,通过划痕实验计算出细胞愈合率,划痕后0、24、48、72、96 h,胃癌MGC-803愈合率逐渐增加,24、48、72、96 h愈合率分别为8%、32%、49%、59%。通过细胞愈合率可以观察到MGC-803具有自主迁移能力,具有验证肿瘤相关巨噬细胞侵袭和迁移能力,与预期实验结果一致,可继续进行后续实验(见图7~8)。
2.3TAMs对MGC-803细胞的侵袭、迁移能力的影响Transwell实验结果提示:对比纯培养基,U937来源的Mφ对MGC-803细胞的迁移无明显影响,M1型巨噬细胞对MGC-803细胞的迁移有抑制作用(P<0.01),M2型巨噬细胞对MGC-803细胞的迁移有促进作用(P<0.05)(见图9)。对比纯培养基,U937来源的Mφ对MGC-803细胞的侵袭无明显影响,M1型巨噬细胞对MGC-803细胞的侵袭有抑制作用(P<0.01),M2型巨噬细胞对MGC-803细胞的侵袭有促进作用(P<0.05)(见图10)。

图5~6 U937细胞诱导后来源不同表型细胞在Western blotting上表达IL-6、TNF-α、HIF-1α、NF-κB p65Fig 5-6 U937 cells expressed IL-6, TNF-α, HIF-1α, NF-κB p65 on Western blotting from different phenotypic cells
图7 划痕实验后在显微镜下细胞自主迁移能力(100×)Fig 7 The ability of cells to migrate autonomously under microscope determined by scratch test (100×)
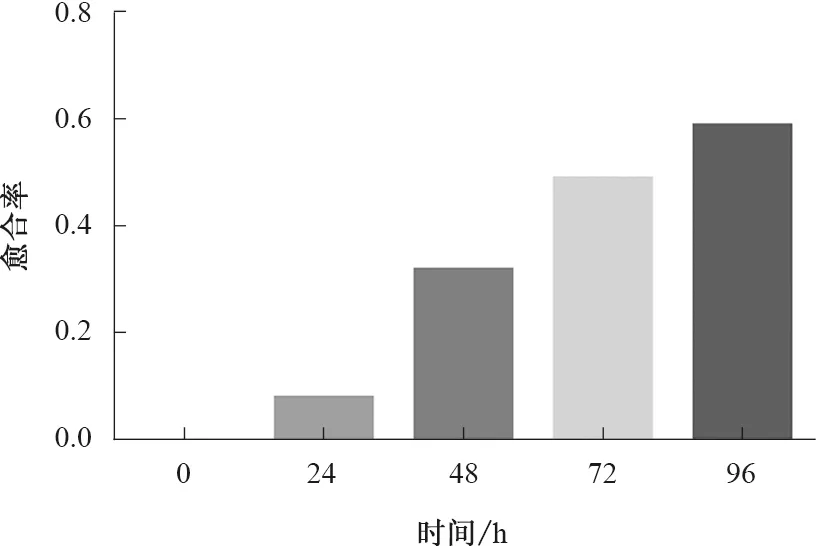
图8 划痕实验细胞愈合率Fig 8 Cell healing rate by scratch test
3 讨论
胃癌在中国恶性肿瘤的发病率和死亡率一直居高不下,胃癌细胞的高侵袭性是导致胃癌患者死亡的主要原因,因此,研究胃癌细胞侵袭作用的分子机制并探索有效的免疫治疗成为目前胃癌研究的主要方向[4]。近年来,肿瘤免疫治疗的飞速发展使现代医学对肿瘤生物和免疫学有了更好的了解。而肿瘤微环境作为肿瘤细胞免疫逃逸和免疫抵抗的主要场所,存在诸多复杂因素参与肿瘤细胞和免疫系统的相互作用,相同的细胞因子在不同的肿瘤微环境中可以发挥两种截然不同的作用,具有一定的双重性,因此通过改变肿瘤的免疫微环境让相应的免疫细胞因子发挥抗肿瘤的作用是目前的研究方向[5]。本研究中,成功通过体外实验将人单核样淋巴瘤U937细胞诱导成未分化的巨噬细胞;并运用不同细胞因子诱导不同表型的TAMs。不同表型的巨噬细胞通过ELISA检测显示出截然不同的两种极端。这说明机体在肿瘤微环境中存在不同类型的巨噬细胞,且这些不同类型的巨噬细胞发挥着不同的功能,对肿瘤细胞的侵袭和迁移起着不同的调节作用。此外,PMA诱导的Mφ巨噬细胞的细胞因子分泌水平与M2型巨噬细胞更为接近,提示未激活的巨噬细胞对肿瘤所产生的作用可能与M2巨噬细胞相类似。后续实验证明不同表型巨噬细胞与MGC-803细胞共培养后,M2型巨噬细胞促进胃癌细胞的侵袭和转移,M1型巨噬细胞抑制胃癌细胞的侵袭和转移;未激活的巨噬细胞Mφ更倾向于M2型巨噬细胞,对MGC-803细胞的侵袭和转移有一定促进作用。因此,我们是否可以通过一定手段干预未激活的巨噬细胞向M1型巨噬细胞分化成为我们下一步实验的主要研究目的。并且有研究表明在肿瘤发病的开始阶段主要是M1型巨噬细胞被激活,大量的巨噬细胞对肿瘤细胞发生攻击和杀伤作用,有效地抑制肿瘤细胞的转移和扩散,但随后因为巨噬细胞在肿瘤微环境所接触到的细胞因子的不同(Th1或Th2细胞因子)及肿瘤细胞异质性和可塑性促使M1型巨噬细胞向M2型巨噬细胞即TAMs转化,巨噬细胞不仅失去了杀伤肿瘤细胞的作用且帮助肿瘤细胞发生免疫逃逸及免疫抑制作用,促进肿瘤的发生、发展、侵袭和转移[6]。因此推测:TAMs在晚期胃癌细胞微环境中主要是以替代激活的M2型巨噬细胞表型存在,对胃癌的侵袭转移和扩散起促进作用,是导致其预后不佳的重要因素。
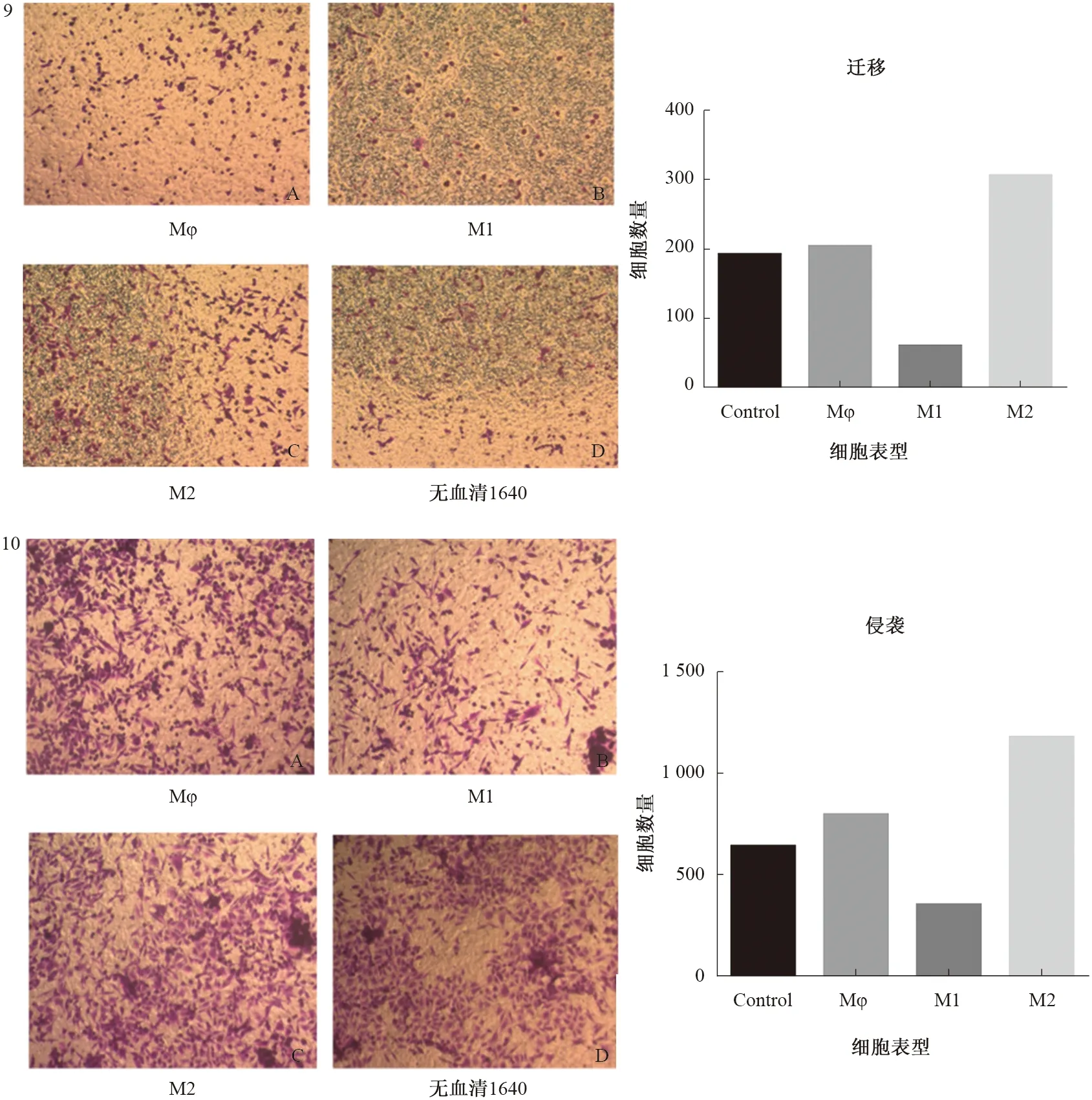
图9~10 显微镜200倍镜下观察肿瘤相关巨噬细胞不同表型通过transwell实验后迁移、侵袭至小室外的细胞计数Fig 9-10 Under a 200-fold microscope observed that after transwell experiments the number of different phenotypes of tumor-associated macrophages across migration and invasion
综上所述,肿瘤相关巨噬细胞的异质性和可塑性为我们有效治疗胃癌提供了一个可能的治疗靶点,直接抑制肿瘤组织中巨噬细胞向M2型巨噬细胞即TAMs转化,通过相关的途径诱导TAMs向M1型巨噬细胞转化,通过转化成对肿瘤细胞有抑制作用的巨噬细胞进一步对肿瘤细胞发生直接杀伤作用,减少肿瘤细胞扩散和转移的机会,有效地控制和治疗胃癌。
