聚乙二醇化干扰素-α对不同基因型慢性丙型肝炎患者治疗效果比较*
2019-01-23赵鹏,王磊
赵 鹏,王 磊
α-干扰素(IFN-α)是临床常用于治疗CHC的药物,主要有普通干扰素和聚乙二醇化干扰素-α(peg-IFN-α)两种[1~4]。目前,国内治疗 CHC 的标准方案是联合应用peg-IFNα和利巴韦林(RBV)治疗(PR方案)。由于HCV基因组具有高度的变异性,可被分为6种主要的基因型及70多种亚型[5]。我们应用Peg-IFN α-2a联合RBV治疗了108例CHC患者,分析比较了HCV I型和非HCV I型CHC患者病毒学和生化学应答率的差异,现将研究结果报道如下。
1 资料与方法
1.1 临床资料 2013年10月~2016年10月我院诊治的CHC患者108例,男性62例,女性46例;年龄为25~74岁,平均年龄(45.7±11.3)岁。符合《丙型肝炎防治指南》[6]的诊断标准。经病毒基因分型检测,发现HCV I型58例【男性32例,女性26例;年龄 27~74(46.1±10.7)岁】;非 HCV I型 50例【男性30例,女性20例;年龄25~70(45.8±11.6)岁】。纳入标准:(1)两次以上检测结果表明血清抗 HCV 阳性,HCV RNA≧1000 IU/ml;(2)血清ALT 升高。排除标准:(1)妊娠或哺乳期妇女;(2)肝硬化;(3)精神疾病;(4)恶性肿瘤;(5)合并酒精性肝病患者。本研究获得医院医学伦理委员会批准,患者签署知情同意书。
1.2 治疗方法 给予所有患者Peg-IFN α-2a(派罗欣,上海罗氏制药有限公司)180 μg皮下注射,1次/w,RBV(广东肇庆星湖生物科技有限公司,国药准字 H19999407)15 mg·kg-1·d-1口服,治疗 48 w。停药后,随访24 w。
1.3 疗效评价标准 生化学应答:血清ALT水平恢复正常(<40 U/L);病毒学应答包括:(1)快速病毒学应答(RVR):治疗4周时血清HCV RNA 定量检测低于检测下限,即 <1000IU/ml;(2)早期病毒学应答(EVR):治疗12周时,HCV RNA 定量检测小于检测下限,或定量检测结果显示血清HCV RNA水平降低等于或大于2个对数级以上;(3)治疗结束时病毒学应答(ETVR):治疗48周结束时,血清HCV RNA定量检测小于检测下限;(4)持续病毒学应答(SVR):在治疗结束随访24周时,血清HCV RNA定量检测小于检测下限[7]。
1.4 统计学处理 应用SPSS 22.0统计学软件进行数据分析,计量资料以±s表示,采用独立样本的t检验,计数资料以%表示,采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较 两组间年龄、性别、体质指数(BMI)、HCV RNA载量和血清ALT水平等一般资料比较,差异无统计学意义(P>0.05,表1)。
表1 两组基线资料[%,(±s)]比较
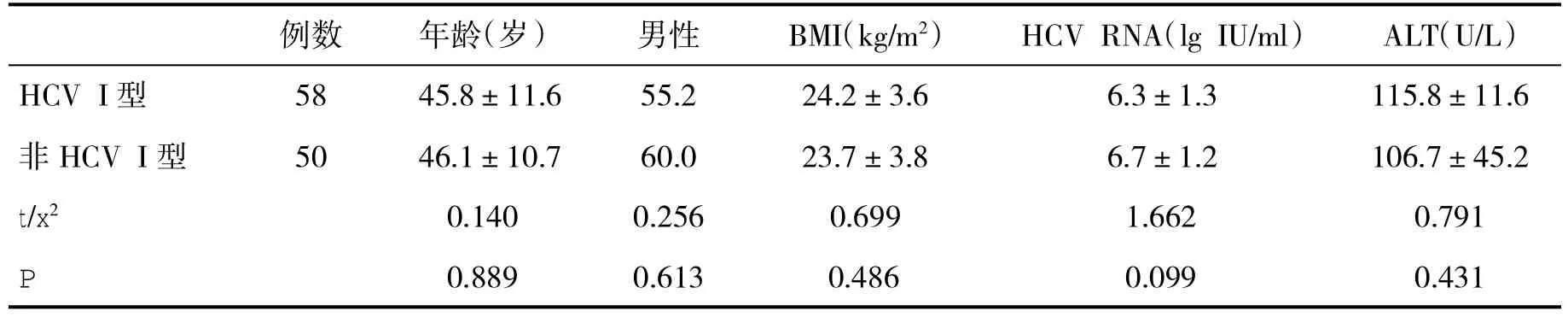
表1 两组基线资料[%,(±s)]比较
例数年龄(岁)男性BMI(kg/m2)HCV RNA(lg IU/ml)ALT(U/L)HCV I型 58 45.8±11.6 55.2 24.2±3.6 6.3±1.3 115.8±11.6非 HCV I型 50 46.1±10.7 60.0 23.7±3.8 6.7±1.2 106.7±45.2 t/x2 0.140 0.256 0.699 1.662 0.791 P 0.889 0.613 0.486 0.099 0.431
2.2 两组患者治疗后病毒学应答率比较 经过48周的治疗和24周随访,HCV I型感染者RVR、EVR、ETVR和SVR水平均显著低于非HCV I型感染者(P<0.05,表2)。
2.3 获得与未获得RVR和EVR患者SVR比较 获得RVR或EVR患者,最终获得SVR显著高于未获得患者(P<0.05,表3)。

表2 两组病毒学应答率(%)比较
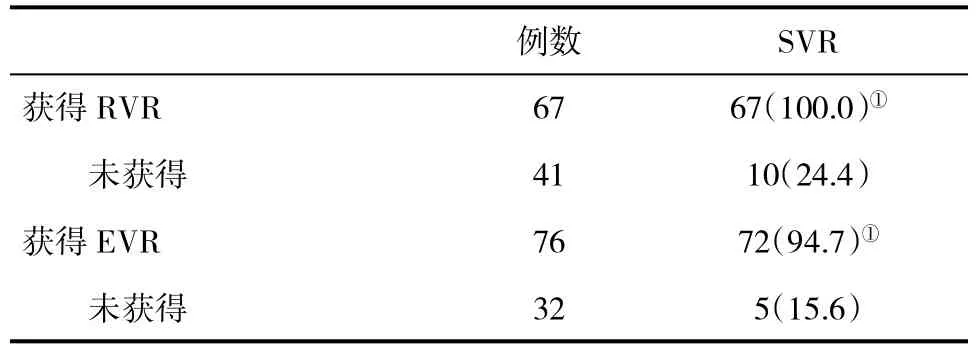
表3 获得与未获得RVR和EVR患者SVR(%)比较
2.4 两组不同病毒载量患者病毒学应答率比较 以基线血清HCV RNA水平为准,两组血清HCV RNA≤4×105IU/ml患者被认为系低病毒载量组,而血清HCV RNA>4×105IU/ml被认为系高病毒载量组,结果在低病毒载量患者,HCV I型与非HCV I型感染者 RVR、EVR、ETVR和 SVR比较,差异无统计学意义(P>0.05),而在高病毒载量患者,非HCV I型感染者RVR、EVR、ETVR和SVR均显著高于HCV I型感染者(P<0.05,表4)。
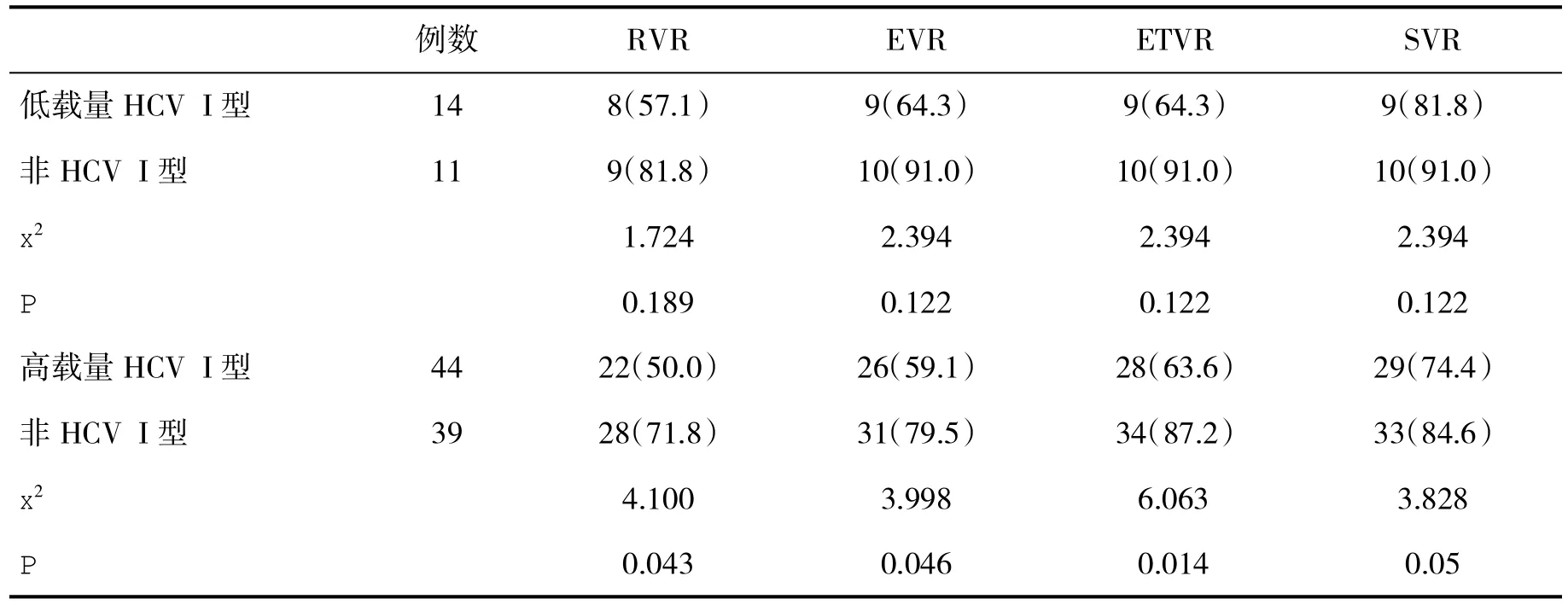
表4 两组不同病毒载量患者病毒学应答率(%)比较
2.5 两组生化学应答率比较 在治疗24周、48周和随访24周时,非HCV I型感染者生化学应答率均显著高于 HCV I型感染者(P<0.05,表5)。
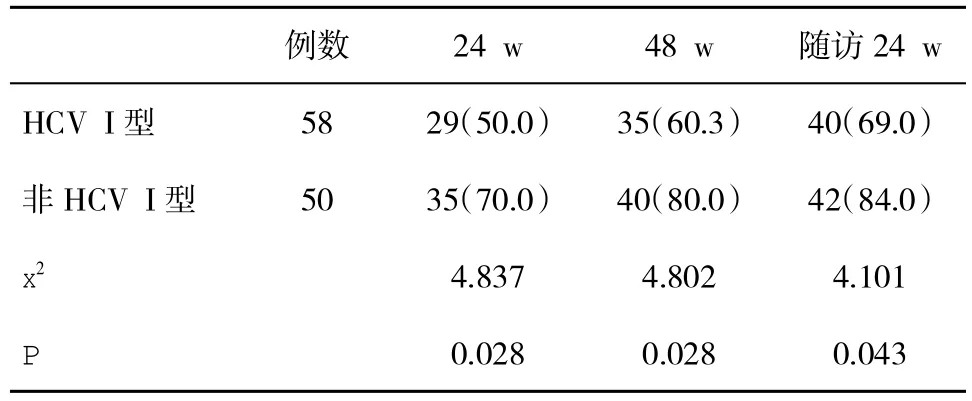
表5 两组生化学应答率(%)比较
3 讨论
本研究应用的Peg-IFN α-2a为聚乙二醇共价结合IFN-α,经皮下注射后能够延长血清半衰期,长效抑制病毒复制,其主要通过肝脏分解,使受到HCV感染的肝细胞处在高浓度的干扰素环境下,进而提高抗病毒效果[8-10]。目前,治疗CHC患者主要是应用IFN-α等药物进行抗病毒为主,在清除HCV的同时也能够延缓疾病进展[11]。目前,国内公认的CHC标准治疗为peg-IFN-α联合RBV治疗。但联合用药的效果容易受到年龄、性别、体质量等多项基线指标的影响。本研究选取的患者基线资料差异无统计学意义,排除了干扰因素对疗效的影响。目前,主要评价抗病毒治疗效果的指标为SVR,即根据患者在治疗结束24周血清HCV RNA阴性来判断效果[12,13]。
本研究发现,HCV I型感染患者经过Peg-IFN α-2a治疗后SVR为58.6%,显著低于非HCV I型感染者的 86.0%(P<0.05),提示 Peg-IFN α-2a对非HCV I型丙型肝炎患者的治疗效果好于HCV I型感染者,与有关[14]的报道结果基本一致,但显著高于国外[15,16]报道的结果,可能是因为亚洲人群IL-28B CC型等位基因有利于发生 SVR。本研究未检测患者IL-28B基因型,需要在以后的研究中予以补充[17]。本研究结果显示HCV I型感染者生化学应答率显著低于非HCV I型感染者(P>0.05),也提示非HCVI型感染者治疗效果好于I型。我国CHC基因型以I型为主。本组纳入患者HCV I型感染例数也稍多于非I型感染者。国内外相关研究结果表明,快速病毒学应答和早期病毒学应答对预测 SVR有重要的价值。本研究结果也表明,获得RVR者,其SVR明显高于未获得RVR的患者,获得EVR者,其SVR也明显高于未获得EVR的患者,提示早期检测HCV RNA水平是预测疗效结果的重要指标。有研究结果提示血清HCV RNA载量与感染病毒基因型无关,而本研究结果表明,在高病毒载量患者,非I型感然者SVR发生率显著高于I型感然者。引起结果差异的原因可能有:(1)不同基因型HCV的复制能力可能有所不同;(2)检测血清HCV RNA的方法不同;(3)病毒基因分型方法不同。总体来看,本研究结果提示非HCV I型感染者RVR、EVR、ETVR和SVR获得率均高于HCV I型感染者,提示临床仍然需要根据患者HCV RNA载量和病毒基因型来制定个体化的治疗方案。
本研究发现应用长效干扰素的主要不良反应为发热、头痛、乏力等症状。其中发热、乏力为比较常见的用药后不良反应,采用物理降温,以及给予非甾体类消炎药可缓解症状。同时,本研究发现的不良反应随着治疗时间的延长,大部分的症状可以得到控制甚至完全消失。在骨髓抑制方面,表现为白细胞或血小板减少,在停止用药后也能够逐渐恢复,给予对症治疗后患者均能完成治疗。其他的不良反应还有甲状腺功能异常等,但未出现严重的事件,证明了用药的安全性。
