外源褪黑素对缺氮胁迫下单针藻Monoraphidium sp. QLY-1中油脂合成的影响
2019-01-23宋雪婷赵永腾余旭亚
宋雪婷,赵永腾,余旭亚
(昆明理工大学 生命科学与技术学院, 昆明 650500)
化石燃料是不可再生能源,目前化石燃料的过度使用导致能源危机日益严重,因此开发和利用可再生能源成为当前研究的热点[1]。生物能源的出现为解决目前面临的能源短缺问题提供了一种新思路,生物柴油作为生物能源的典型代表,因具有可再生、清洁、环保、十六烷值高等优点,而被作为化石能源的理想替代品[2]。产油微藻由于具有油脂含量高、生长周期短、光合效率高等优点成为当前生产生物柴油的最佳原料,也成为陆生植物利用的一种潜在替代物[3]。但微藻在传统培养条件下存在生物量和油脂产率低、生产成本高等一系列问题,阻碍了产油微藻的大规模应用[4]。
微藻油脂的合成受多种因素的影响。研究表明,氮饥饿是促进各种微藻中油脂积累和调控脂肪酸组成最有效的方法[5]。非生物胁迫条件虽能增加油脂含量,但在一定程度上会降低微藻的生物量。生物柴油生产需要大量的生物质提供原料,生物量的降低使得生物柴油的商业化生产受到了制约,这一限制可以通过两阶段培养策略解决,即异养培养-光化学诱导。
褪黑素(Melatonin,MT)是一种吲哚类色胺,化学名称为 N-乙酰-5-甲氧基色胺,是一种内源性的植物激素,具有抗氧化活性。研究显示,MT作用类似于吲哚乙酸(IAA)和细胞分裂素(CK),在绿色植物中能够调节光周期及植物生长。此外,作为抗氧化剂,MT可以消除活性氧、提高抗氧化酶活性等[6]。这种作用类似于甜菜碱和黄腐酸,在非生物胁迫条件下,可以促进微藻细胞内油脂积累[7]。由此推测,缺氮条件下,外源MT可能会进一步促进微藻中油脂的积累。
本文研究了缺氮条件下,添加外源MT对单针藻Monoraphidiumsp.QLY-1生长、油脂积累以及生理生化指标的影响,并探讨了MT对活性氧(ROS)含量及相关抗氧化酶活性的影响,分析了外源MT调控藻细胞中ROS含量和油脂合成之间的关系,为促进微藻油脂积累提供了新的思路。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
单针藻Monoraphidiumsp. QLY-1 ,筛选、保存于本实验室。MT,购于生工生物工程有限公司;葡萄糖测定试剂盒,丙二醛(MDA)、活性氧(ROS)测定试剂盒,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)测定试剂盒,均购自上海碧云天生物技术有限公司。所用试剂均为分析纯,购自昆明鼎国试剂公司。
1.1.2 仪器与设备
TS-1102恒温振荡摇床,FA2004N分析天平,LDZX-50KBS灭菌锅,VS-840-1超净工作台, Ultrospec 2100pro紫外可见分光光度计,RF-540荧光分光光度计(Shimadzu),TS-2011GZ恒温光照振荡摇床,5804R高速低温离心机(德国Eppendorf公司),1730R高速冷冻离心机(丹麦Labogene Scanspeed公司),FD5-12冷冻干燥机(西盟国际集团),Agilent 7890A系列气相色谱仪(Agilent Technologies),Agilent 5975C系列质谱仪。
1.2 实验方法
1.2.1 微藻培养
以BG-11培养基为基础培养基,将单针藻Monoraphidiumsp.QLY-1接种于含有250 mL培养基的500 mL锥形瓶中,25℃、150 r/min、异养培养(葡萄糖10 g/L)11 d。
1.2.2 MT诱导处理
将异养种子分别接种到自养BG-11培养基及自养缺氮BG-11培养基中(培养基体积250 mL),接种量为1 g/L。以缺氮BG-11培养基作为对照组,添加MT(1 μmol/L)为处理组,在光照强度30 μmol/(m2·s),温度25℃,摇床转速150 r/min的条件下培养。每天收集藻细胞,测定单针藻Monoraphidiumsp.QLY-1的生物量和油脂含量。
1.2.3 碳水化合物和蛋白质含量的测定
按照葡萄糖测定试剂盒说明书测定碳水化合物中葡萄糖的含量。利用牛血清白蛋白(BSA)作为标准测定蛋白质含量。
1.2.4 ROS和MDA含量的测定
分别按测定试剂盒说明书测定。
1.2.5 抗氧化酶(SOD、POD、CAT)活性的测定
分别按测定试剂盒说明书进行测定。
1.2.6 生物量和油脂含量的测定
取10 mL体积的藻液,通过离心收集 (5 000 r/min,10 min),置于-80℃冰箱冷冻2 h以上取出,用真空冷冻干燥机冷冻48 h,之后称量干藻粉的质量。以每升藻液中干藻粉的质量表示生物量。
微藻油脂提取及含量测定采用Bligh等[8]的方法。微藻细胞内的油脂主要包裹在细胞壁中,需要进行细胞破壁,之后利用有机溶剂进行提取,具体操作步骤见Zhao等[9]方法。
1.2.7 油脂分级
用1 mL的氯仿溶解1.2.6所提取的油脂,利用硅胶层析进行分离。具体方法如下:用30 g的硅胶填充硅胶柱(25 mm×25 mm),将氯仿溶解的油脂110℃加热过夜,并加入到硅胶柱中,连续用2/3柱体积的氯仿冲洗6次,丙酮冲洗4次,甲醇冲洗4次。将氯仿相冲洗所得液体烘干即为中性脂,丙酮相冲洗所得液体烘干即为糖脂,甲醇相冲洗所得液体烘干即为磷脂[10]。
1.2.8 脂肪酸组成分析
提取的微藻油脂添加2 mL 3%硫酸-甲醇溶液,于70℃水浴回流4 h进行甲酯化后,取2 mL正己烷萃取4 h,萃取相过滤后待GC-MS分析。
色谱条件:Agilent 7890A系列气相色谱仪;HP-5MS 毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气,压力 0.137 9 MPa;升温程序为70℃,保持1 min,以20℃/min升温至180℃,然后以6℃/min升温至230℃,保持20 min;进样量1 μL,分流比50∶1。
质谱条件:Agilent 5975C系列质谱仪;进样口温度250℃;接口温度270℃;离子源温度230℃;电离电压70 eV;四极杆温度150℃;载气为高纯氦气,流速1.0 mL/min;扫描方式为全扫描模式,扫描范围(m/z)30~450。
峰值与国家标准与技术研究所(NIST)质量光谱库(NIST08.L)的质量光谱进行比较,以保留时间定性,用面积归一化法计算脂肪酸的含量[9],其中不饱和度等于2倍的多不饱和脂肪酸与单不饱和脂肪酸之和。
1.2.9 数据处理
全部实验均设置3组平行,结果表示为“平均值±标准差”,通过ANOVA(SPSS19.0)一步法分析实验数据。最小显著性差异进行多重比较,检验组间差异,且当P< 0.05具有显著性差异,P< 0.01具有极显著差异。
2 结果与讨论
2.1 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1细胞生长的影响(见图1)
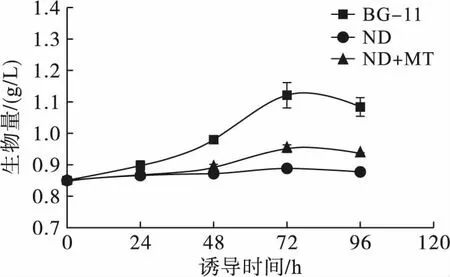
图1 不同处理条件对单针藻Monoraphidium sp. QLY-1 生物量的影响
由图1可知,缺氮(ND)条件下,MT处理组和对照组微藻的生长都较为缓慢,均低于BG-11培养基下的生物量;在外源MT诱导下,48 h藻细胞的生物量略高于对照组条件下的。结果表明,藻细胞在BG-11培养基中生长最快,最高生物量达到1.12 g/L。而在缺氮条件下,外源MT依然可以维持微藻的生长,可能是由于MT提高了微藻利用细胞内氮的能力。这与Babu等[11]报道的结果,即在氮限制条件下,添加植物激素IAA和DA-6能够促进Chlorellasorokiniana利用细胞内的氮源进行生长相一致。
2.2 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1油脂含量的影响(见图2)
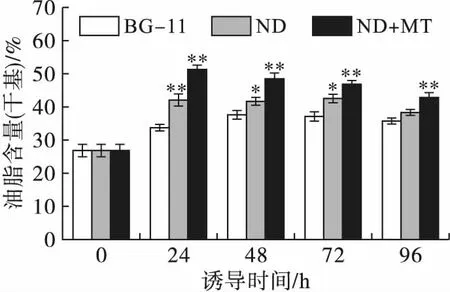
注:与BG-11相比,*为显著性差异(P<0.05),**为极显著差异(P<0.01)。
图2不同处理条件对单针藻Monoraphidiumsp.QLY-1油脂含量的影响
由图2可知,在缺氮条件下,单针藻油脂含量从26.87%提高到42.06%,增加了15.19个百分点。MT联合缺氮处理下,其油脂含量最高达到51.38%,是对照组的1.22倍,与先前研究结果相比,油脂含量增势明显[12]。油脂积累的增长反映了缺氮和MT的互作效应。缺氮可促进单针藻中油脂的积累,外源MT联合缺氮可进一步促进油脂的积累。此现象可能是由于缺氮条件下MT调控了藻细胞内碳的再分配,从而提高了微藻中油脂的积累。此外,单针藻中油脂的积累也可能与胞内有机物的转化有关,比如降解蛋白质及碳水化合物,从而为藻细胞积累油脂提供碳源和能量[7]。
在微藻油脂含量增加的同时,其油脂组分也发生了变化。在MT诱导下微藻中的油脂组分变化如图3所示。
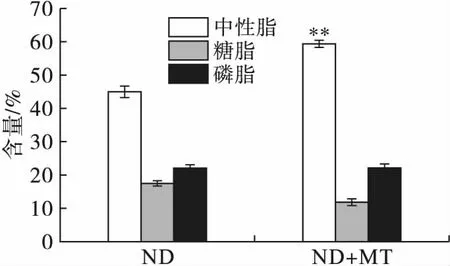
注:**为与对照相比存在极显著差异(P<0.01)。
图3不同处理条件对单针藻Monoraphidiumsp.QLY-1油脂分级的影响
由图3可见,中性脂含量在MT处理下从45%增加至59.31% 。糖脂含量下降了5.7个百分点,这可能是由于糖脂向中性脂的转换。此结果与Yoon等[13]发现微藻在低光照条件下糖脂向中性脂的转化一致。而磷脂与对照组无显著性差异。
2.3 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1生理生化指标的影响(见图4)
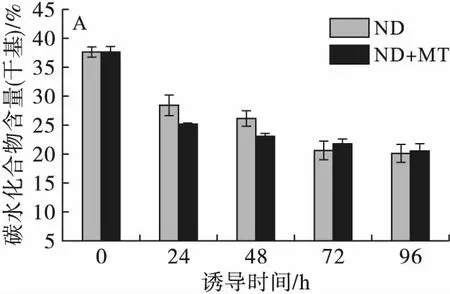
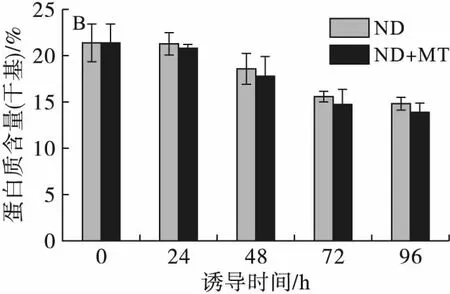
图4不同处理条件对单针藻Monoraphidiumsp.QLY-1碳水化合物(A)和蛋白质(B)含量的影响
碳水化合物、蛋白质是微藻的主要成分,在非生物胁迫条件下其可能改变并转化成为油脂[14]。由图4可知,与油脂含量变化相反,在24 h添加MT的诱导条件下碳水化合物含量从37.69%下降至25.24%,对照组从37.69%下降至28.39%。MT联合缺氮诱导,藻细胞内蛋白质含量最高达到20.82%,72 h蛋白质含量从20.82%下降至14.73%;而对照组蛋白质含量从21.27%下降至15.55%,Che等[7]的研究也呈现了类似的结果,微藻在高盐、高光照、氮饥饿的条件下会导致蛋白质含量的降低和油脂含量的增加[15]。在MT处理下,碳水化合物和蛋白质含量的下降可能与氮源、光照强度和碳的再分配有关,这与Zhang等[16]的研究结果,即盐胁迫下微藻ChlorellasorokinianaSDEC-18中淀粉向脂质合成的转化一致。Li等[12]也发现MT联合光诱导下,微藻中蛋白质和碳水化合物的降低伴随着脂质的积累。
2.4 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1细胞内ROS、MDA含量的影响(见图5)
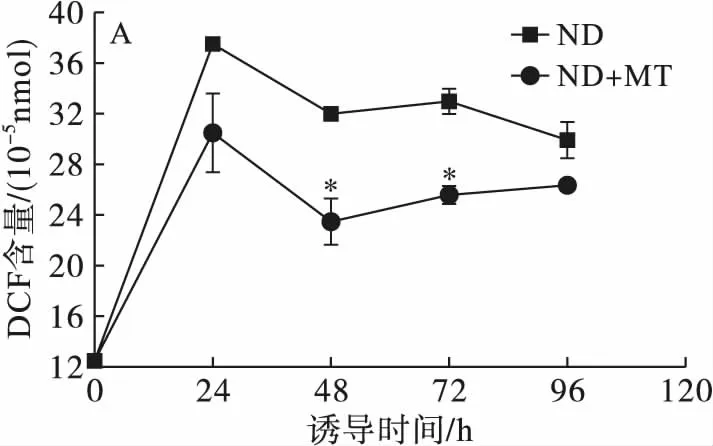
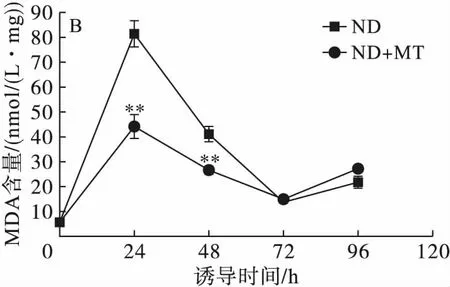
注:与对照组相比,*为显著性差异(P<0.05),**为极显著差异(P<0.01)。
图5不同处理条件对单针藻Monoraphidiumsp.QLY-1细胞中ROS(A)和MDA(B)含量的影响
ROS作为信号分子,涉及多个细胞代谢过程以及防御相关的基因表达,对微藻油脂的积累发挥着重要作用,其信号传导途径及其作用的机制已经成为近年来研究的热点[17]。由图5可见,对照组前24 h藻细胞内的ROS含量显著性增加,24 h后ROS含量缓慢下降之后趋于平缓,添加MT诱导下呈现相同的变化趋势,但是ROS含量明显低于对照组。
丙二醛(MDA)是反映细胞膜脂过氧化程度的指标,其含量的高低可表明微藻细胞在盐胁迫、强光以及氮饥饿等非生物胁迫条件下引起细胞氧化损伤的程度[12]。由图5可见,在整个培养阶段,藻细胞内的MDA含量总体上是增加的,但是前48 h外源MT的添加使得藻细胞内MDA含量显著低于对照组,24 h对照组的MDA含量是其1.84倍(P<0.01)。与对照组相比,添加MT的MDA含量变化与脂质积累呈现相反趋势,表明MT在脂质积累的过程中降低了MDA含量,对藻细胞可能起到了一定的保护作用,促进了藻细胞中脂质的积累。
缺氮条件下能够增加ROS、MDA的含量,外源MT的添加能够降低藻细胞内的ROS和MDA的含量,使微藻细胞避免因环境胁迫造成的氧化损伤,保持细胞的正常代谢。Yu等[18]研究表明添加植物激素组与不添加组相比,显著降低了缺氮条件下细胞内ROS、MDA的含量,保护微藻免受氧化应激的影响。MT作为一种有效的抗氧化剂,可有效地清除胞内过量的ROS以及由氮缺乏引起的细胞损伤[14]。氮胁迫条件下,外源MT可调节微藻在油脂积累过程中的ROS和MDA含量,且微藻中油脂的积累与胞内ROS和MDA含量呈现出相负相关。
2.5 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1细胞内抗氧化酶的影响(见图6)
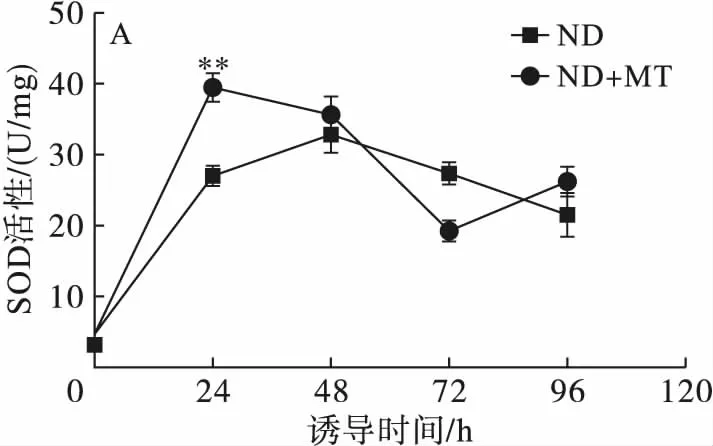
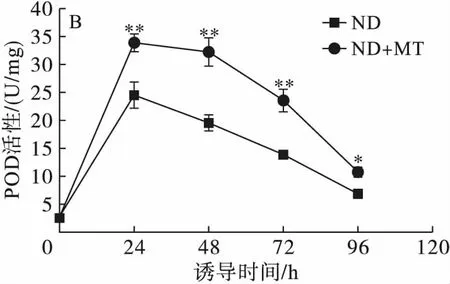
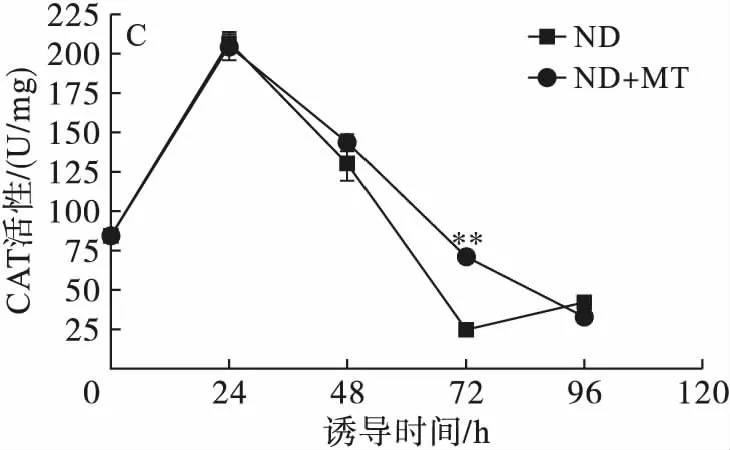
注:与对照组相比,*为显著性差异(P<0.05),**为极显著差异(P<0.01)。
图6不同处理条件对单针藻Monoraphidiumsp.QLY-1细胞中SOD(A)、POD(B)、CAT(C)的影响
由图6可知,外源MT联合缺氮诱导条件下,导致藻细胞内与ROS含量密切相关的抗氧化酶活性的升高。SOD催化超氧化物自由基和氢分解产生H2O2和O2,为对抗由ROS引起的毒性提供了第一道防线[19]。如图6A所示,在MT的处理下,诱导24 h SOD的活性达到最高(39.45 U/mg),是对照组的1.46倍(P<0.01),随着诱导时间的延长,SOD的活性整体趋于降低,96 h降至26.19 U/mg。这与Yu等[18]在ScenedesmusSDEC-8和ChlorellasorokinianaSDEC-18中发现SOD的活性变化相似。
POD是代谢的末端氧化酶之一,属呼吸功能相关的酶,能催化H2O2分解。如图6B 所示,MT处理条件下,POD活性于24 h达到最高(33.94 U/mg),是对照组的1.38倍(P<0.01),之后呈现下降趋势,但总体上看,48 h和72 h 时也明显高于对照组(P<0.01)。
CAT 能够消除H2O2对细胞的损伤,将其代谢为H2O和O2,从而保护机体免受自由氧基的损害[20]。由图6C可知,在MT的处理下,前24 h藻细胞内的CAT活性与对照组没有显著性差异,均呈现显著性增加的趋势,随着诱导时间的延长,CAT活性总体呈现下降趋势,在72 h CAT活性是对照组的2.86倍(P<0.01)。
上述结果表明,在缺氮条件下,ROS含量的增加导致细胞氧化性损伤,从而引起细胞免疫防御系统启动,3种抗氧化酶作为应答氧化胁迫的主要效应物,与对照组相比,在MT处理下均呈现明显增加的趋势。这与彭金良等[21]添加α-萘酚胁迫对普通小球藻中抗氧化酶活性的变化一致。但在培养后期3种抗氧化酶活性呈现出下降的趋势,这可能与蛋白质的降解有关[22]。因此,外源MT调控缺氮条件下藻细胞内ROS含量与相关抗氧化酶活性有关。
2.6 缺氮联合MT诱导对单针藻Monoraphidium sp. QLY-1脂肪酸组成的影响(见表1)
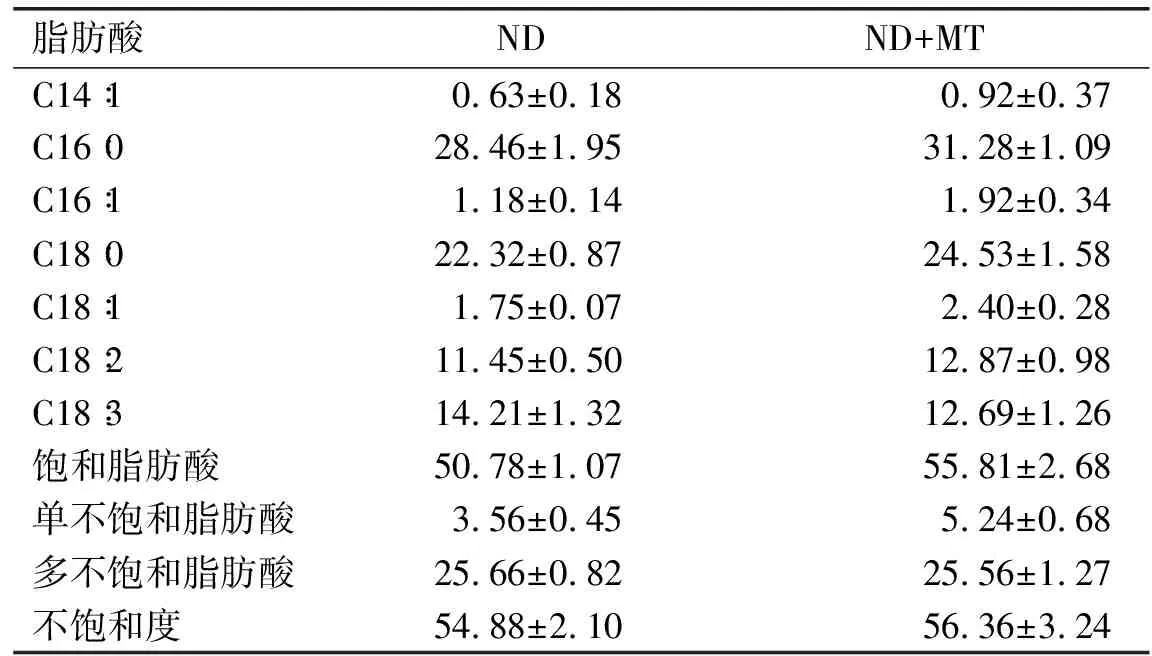
表1 不同处理条件对单针藻Monoraphidium sp. QLY-1脂肪酸组成的影响 %
由表1可知,缺氮条件下外源MT的添加导致单针藻Monoraphidiumsp. QLY-1脂肪酸组成变化。棕榈酸(C16∶0)、硬脂酸(C18∶0)、亚油酸(C18∶2)和亚麻酸(C18∶3)是脂肪酸的主要组成成分,C16∶0与对照组相比提高了2.82 个百分点,C18∶0 和C18∶2分别是对照组的1.10倍和1.12倍。在MT的处理下,饱和脂肪酸含量从50.78%增加至55.81%,比对照组提高了5.03个百分点,在一定程度上饱和脂肪酸含量的升高可生产出较高氧化稳定性及十六烷值的生物柴油;单不饱和脂肪酸含量从3.56%提高至5.24%,是对照组的1.47倍;其不饱和度(DU)与对照组相比差别不大。Li等[12]用1 μmol/L 褪黑素诱导藻细胞,与对照相比脂肪酸组成和DU值无显著性变化。
3 结 论
在缺氮条件下,单针藻油脂含量从26.87%提高到42.06%,增加了15.19个百分点,外源MT联合缺氮条件下,其油脂含量最高可达到51.38%,是对照组的1.22倍。外源MT联合缺氮诱导藻细胞产生了一系列的生理反应,藻细胞内蛋白质和碳水化合物含量下降,且MT能够有效清除氮饥饿条件下藻细胞内积累的过量ROS,降低MDA水平,提高与清除ROS相关的3种抗氧化酶的活性,这些变化都与促进藻细胞内的油脂积累相关。随着MT诱导微藻脂质积累机制的进一步研究,外源添加MT联合缺氮培养有望成为微藻生产油脂的一种有效策略。
