绵羊IGF- I基因II类变异剪接体生物信息学及组织表达分析
2019-01-23宋旭婷翟羽飞张嘉楠亓美玉王志鹏姚玉昌
宋旭婷,翟羽飞,张嘉楠,亓美玉,王志鹏,付 晶,姚玉昌*
(1.黑龙江普通高等学校动物遗传育种与繁殖重点实验室,黑龙江哈尔滨 150030;2.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030;3.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086)
胰岛素样生长因子-1(Insulin Like Growth Factor I,IGF-I)是一种物种间高度保守的多功能肽,在哺乳动物中由70个氨基酸残基和3个分子内二硫键组成,主要由肝脏分泌产生,对生长、生殖、代谢、免疫和多种疾病具有调节功能[1-2]。IGF-I基因在培育动物新品种中发挥重要作用。有研究表明,14月龄时转IGF-I基因绵羊后代公羊和母羊的产毛量分别提高了9.2%和3.4%[3];转IGF-I基因猪的瘦肉率提高10%,脂肪减少20%[4]。
RNA的可变剪接(Alternative Splicing)是真核生物基因表达调控的重要形式,可变剪接在生物界普遍存在,其中95%的人类基因和40%以上的植物基因存在着可变剪接现象[5-6]。IGF-I基因在表达时存在外显子互斥现象,进而调节着基因表达的差异性和蛋白质功能的多样性[7]。目前,在人类中已发现包括IGF-IEa、IGF-IEb和IGF-IEc至少3种类型[8],在鼠中也已发现包括IGF-IEa和IGF-IEb(该型与人中的IGF-IEc型的剪接方式一致)在内的2种类型[9],在猪、牛和鹿等物种也有相关研究报道[10-12]。但目前关于绵羊IGF-I基因的可变剪接方式还未明晰,产生的变异剪接体类型有待进一步揭示。
IGF-I基因在不同物种间高度保守,本研究基于已发表的绵羊IGF-I基因I类变异剪接体类型[13],以东北细毛羊为实验材料,探讨IGF-I基因II类变异剪接体的生物学特性及组织表达规律,为揭示IGF- I基因不同变异剪接体的生物学功能奠定基础。
1 材料与方法
1.1 实验动物 实验动物选择来自东北农业大学绵羊新品种繁育基地的30日龄和36月龄东北细毛羊公羊各3只,屠宰后立即取心脏、肝脏、肌肉、脾脏、肺脏、肾脏、肠、胃、皮肤、脂肪、膀胱和睾丸组织样,于液氮中速冻后,-80 冰箱保存。
1.2 引物信息 比较分析牛、猪、鹿等物种IGF-I基因的可变剪切模式及序列同源性,明确目标序列高度保守区域,设计2对克隆和半定量引物,特异性引物1(F:5'-ACCCACCCTGACCTGCTGT-3';R:5'-CATTCT TCGCTCTTTAGGAAGGG-3')、特异性引物2(F:5'-ACCCACCCTGACCTGCTGT-3';R:5'-TTCAGTTTCTA GCTCCAGTCTCTC T-3')、半定量引物R1(F:5'-CAA ACAAAAATGGTTACACCTACAC-3';R:5'-AAATGT
ACT TCCTTCTGAGCCTTGG-3')、半定量引物R2(F:5'-CAAACAAAAATGGTTACACCTACA C-3´;R:5´-CCCTCCTGGATGTTTCTTTGG-3') 和β-actin 基 因 引 物(F:5'-AGATGTGGATC AGCAAGCAG-3';R:5'-CCAATC TCATCTCGTTTTCTG-3')。
1.3 总RNA提取及cDNA合成 采用液氮研磨结合RNAiso Plus裂解法(9109,TaKaRa)提取12个组织总RNA,利用紫外分光光度计和1%琼脂糖凝胶电泳检测总RNA纯度和浓度。反转录cDNA按照试剂盒说明书(RR047A,TaKaRa)的具体操作步骤完成。
1.4 全长编码区克隆鉴定 以东北细毛羊肝脏池为模板,利用1.2中列出的特异性引物1和2分别扩增目的序列。PCR扩增条件及克隆方法参照之前的报道[13]。纯化后带有目标序列的pMD 18-T克隆质粒测序,将拼接比对后的完整序列进行后续生物信息学预测。DNAMAN和NCBI BLAST在线比对获得序列物种同源性等信息。
1.5 预测网站 将已克隆获得片段进行开放阅读框区域预测。GenBank数据库查找并下载Class 2-Ea和Class 2-Eb氨基酸序列,用于构建系统进化树,其他相关生物学预测方法详见参考文献[13]。
1.6 组织表达分析 考虑到IGF-I基因的剪接方式以及引物的特殊性,本研究选择半定量PCR检测IGF-I基因不同变异剪接体在12种组织样品中的表达情况。具体方案参照Zhang等[12]研究方法。
1.7 统计分析 使用Image J软件获取目的条带灰度值,采用SPSS 18.0软件单因素方差分析法对数据进行统计学处理。
2 结果与分析
2.1 绵羊IGF-I基因克隆 以东北细毛羊肝脏池cDNA为模板,RT-PCR扩增结果显示均出现特异性扩增条带,测序后证明获得了2种变异剪接体(图1和图2)。综合比对啮齿类、类人猿等哺乳动物IGF-I基因的可变剪接特征,并与课题组之前在绵羊肝脏池中获得的2条绵羊IGF-I基因I类(NM_001009774.3,MG572781)序列对比后发现,本研究新获得的片段是绵羊IGF-I基因II类变异剪接体,即为绵羊IGF-I基因II类Ea型 (IGF-Iclass 2-Ea, GenBank登录号:MG572782)和IGF-I基因 II类 Eb型(IGF-Iclass 2-Eb,GenBank登 录 号:MG572783)。
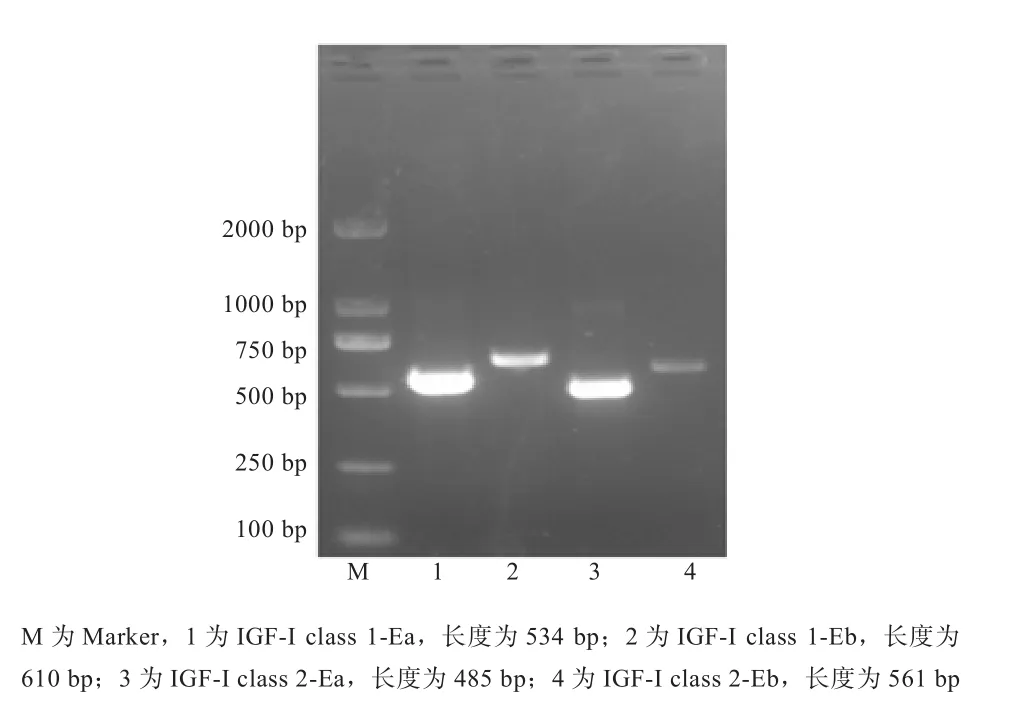
图1 绵羊IGF-I基因4种变异剪接体PCR扩增结果

图2 绵羊IGF-I基因II类变异剪接体结构模式图
2.2 2种变异剪接体生物信息学预测分析结果
2.2.1 组成分析 本研究获得的绵羊IGF-I基因II类变异剪接体组成分析与其他物种结果相一致(表1)。IGF-I基因II类Ea型(序列长度为485 bp)ORF位于42~459 bp核苷酸,预测编码蛋白质长度是138 aa;IGF-I基因II类Eb型(序列长度为561 bp)ORF位于42~560 bp核苷酸,预测编码蛋白质长度是172 aa(图3)。信号肽在线预测结果表明,2种变异剪接体1~33个氨基酸为信号肽区域,剪切点位于33~34氨基酸处(图4)。
2.2.2 系统进化树分析 由图5可见,绵羊IGF-I基因II类Ea型与山羊(Capra hircus)在一个小分支上,遗传距离相对较近;与啮齿类(Rodents)和灵长类(Primates)遗传距离相对较远。绵羊的IGF-I基因II类Eb型与牛(Bos taurus)在一个小分支上,遗传距离较近;与小鼠(Mus musculus)遗传距离较远,这2种剪接变异体的系统进化树分析结果符合物种进化规律。

表1 绵羊IGF-I 基因序列组成分析
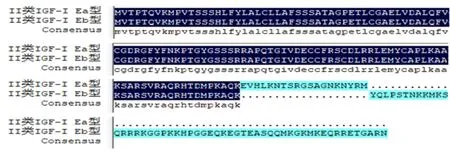
图3 绵羊IGF-I基因II类变异剪接体的氨基酸序列比对
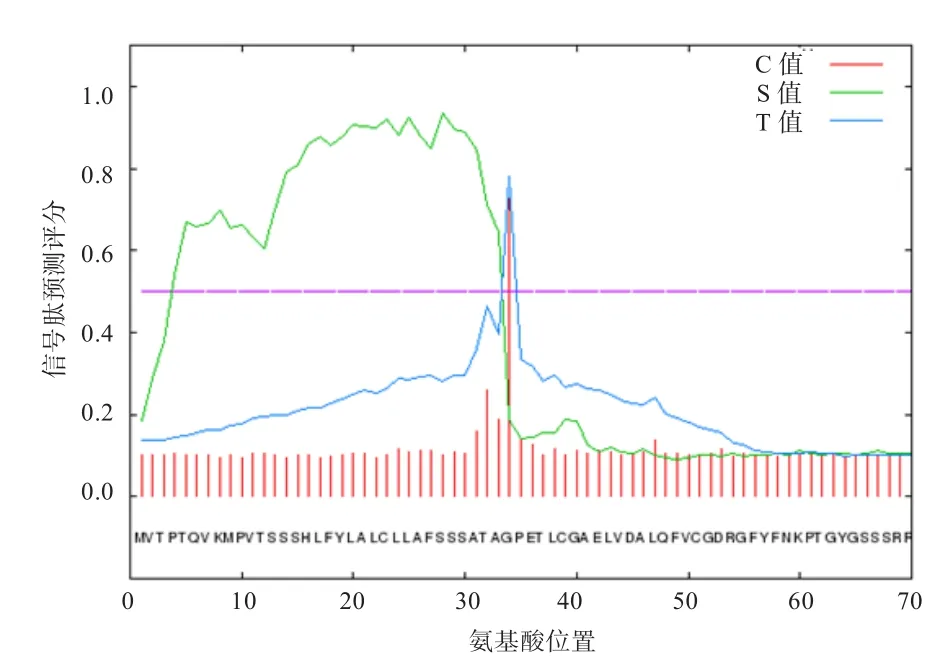
图4 绵羊IGF-I基因II类变异剪接体信号肽序列预测结果

图5 绵羊IGF-I基因II类变异剪接体系统进化树分析结果
2.2.3 蛋白质基本理化性质预测 在线预测蛋白质理化性质结果表明IGF-I基因II类Ea型预测编码138 aa,相对分子质量为15 149.42,理论等电点(PI)为9.44,由19个氨基酸组成,其中丝氨酸达到10.1%,异亮氨酸仅为0.7%。分子式为C654H1048N194O196S12;氨基酸的最大疏水性为2.756,最小值为-1.978(图6-a)。IGF-I基因II类Eb型预测编码172 aa,相对分子质量为19 070.93, PI为9.93,由19个氨基酸组成,其中赖氨酸达到9.3%,异亮氨酸仅为0.6%。分子式为C816H1331N253O246S14;氨基酸最大疏水性为2.756,最小值为-3.067(图6-b)。

图6 绵羊IGF-I基因II类变异剪接体蛋白亲疏水性预测结果
2.2.4 功能域预测 在线预测亚细胞定位结果(表2)表明,2种变异剪接体均是分泌蛋白,与IGF-I的功能相一致,主要定位于分泌途径,并且该方法与信号肽在线预测软件(SignalP 4.0)结果一致,表明存在信号肽区域。
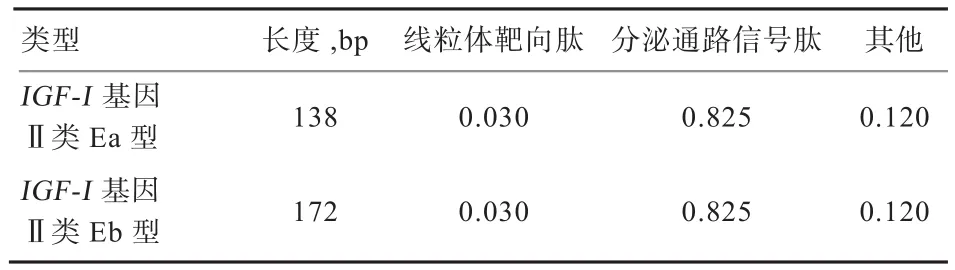
表2 绵羊IGF-I基因序列TargetP亚细胞定位预测
2.2.5 共价修饰预测 利用在线网站预测2种变异剪接体共价修饰位点的存在数量。磷酸化修饰位点在线预测结果(图7)显示,IGF-I基因II类Ea型有17处可能的磷酸化修饰位点,分别位于丝氨酸(n=10)、苏氨酸(n=5)和酪氨酸(n=2),IGF-I基因II类Eb型有20处可能的磷酸化修饰位点,分别位于丝氨酸(n=12)、苏氨酸(n=6)和酪氨酸(n=2)。糖基化修饰位点在线预测结果显示,IGF-I基因II类Ea型与Eb型分别有9个和11个潜在的糖基化位点。
2.2.6 结构域预测 二级结构在线预测结果(图8-a和8-b)表明,IGF-I基因II类Ea型编码的138个氨基酸中,α-螺旋数量为47个(34.06%),β-折叠数量为9个(99%),无规则卷曲数量为82(59.42%);IGF-I基因II类Eb型编码的172个氨基酸中,α-螺旋数量为68个(39.53%),β-折叠数量为14个(8.14%),无规则卷曲数量为90个(52.33%),2种变异剪接体均不存在β-转角结构。三级结构在线预测结果(图8-c和8-d)显示2种变异剪接体均为弯曲螺旋状。
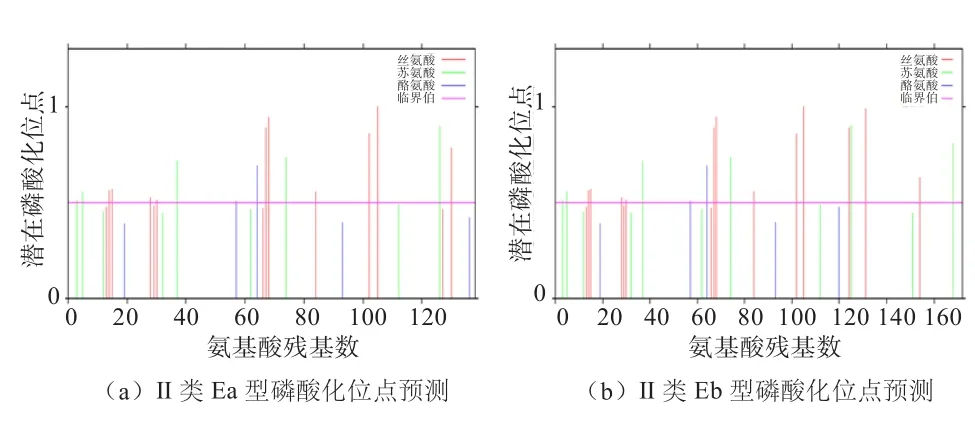
图7 绵羊IGF-I基因II类变异剪接体磷酸化位点预测结果
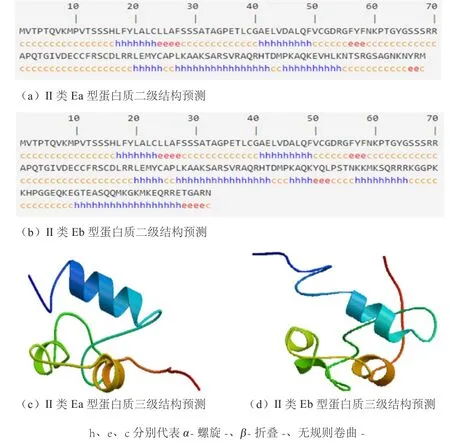
图8 绵羊IGF-I基因II类变异剪接体蛋白质结构域预测结果
2.6 组织表达检测 如图9所示,肝组织中变异剪接体的表达水平最高,其次为脂肪、胃、睾丸、肌肉和皮肤,心、脾、肺、肾、肠、膀胱组织的表达水平较低。在胃中,2种剪接变异体在羔羊期的表达水平均极显著高于成羊期(P<0.01);在睾丸中,IGF-I基因II类Ea型在羔羊期的表达水平显著高于成羊期(P<0.05);在其余检测的组织中,2种变异剪接体的表达水平在羔羊期和成羊期没有显著差异(P>0.05)。综合比较分析2个变异剪接体多组织间的表达水平,发现II类Ea型的表达水平高于Eb型,为主要的转录本类型。
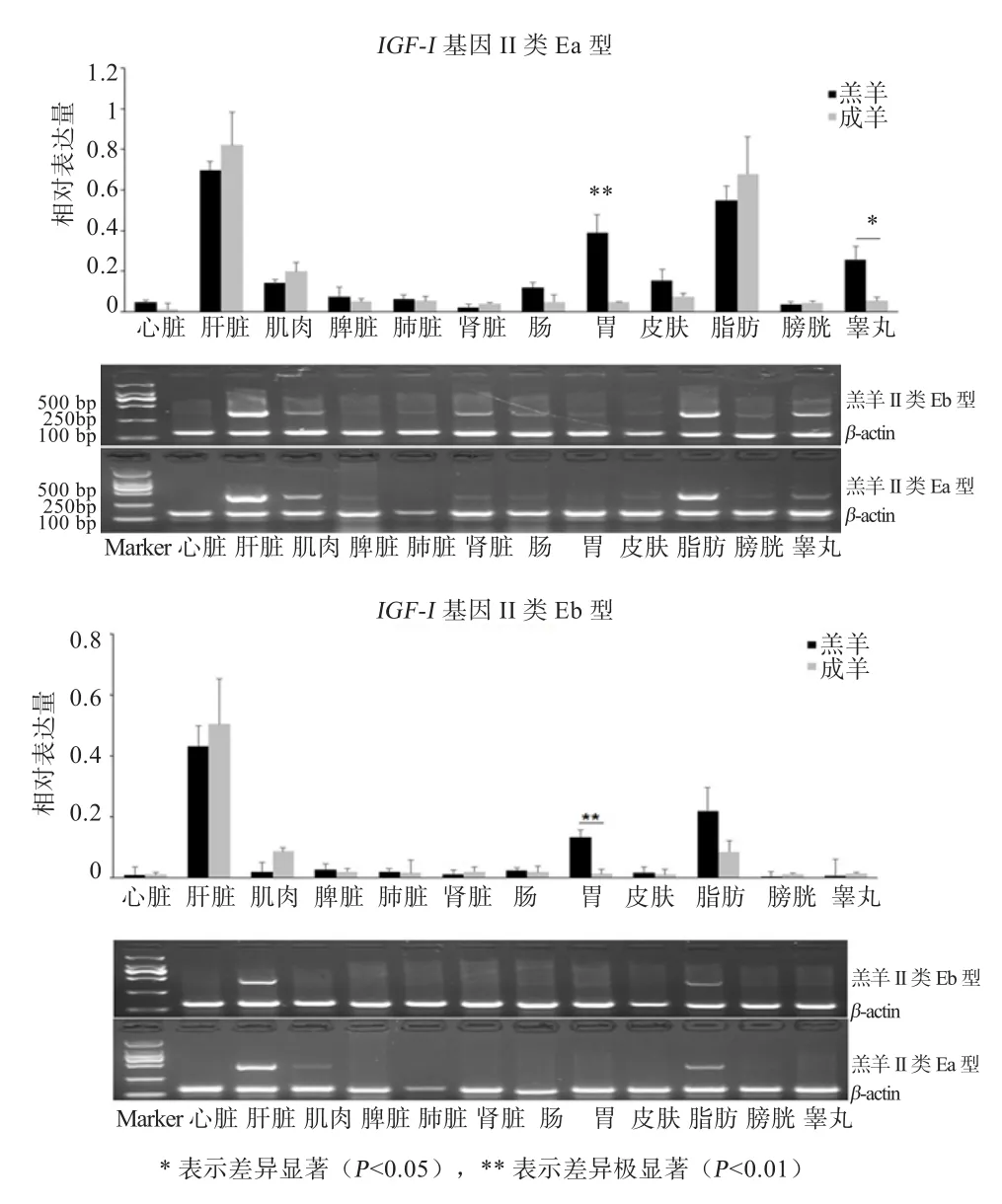
图9 绵羊IGF-I基因II类变异剪接体的组织表达情况
3 讨 论
IGF-I是体内普遍存在的生长因子,对绵羊生长、肉质和羊毛产量具有显著的促进作用[14-15]。分析多物种IGF-I基因前体RNA的剪接模式时发现,IGF-Iclass 1-Ea型诱导成肌细胞分化和融合形成肌管,而IGF-Iclass 1-Eb抑制成肌细胞的最终分化,从而积累更多的成肌细胞形成次级肌管[16-17]。本研究成功获得了绵羊IGF-I基因 II类Ea和Eb型,其中Ea型(GenBank登录号:MG572782)编码138个氨基酸,Eb型(GenBank登录号:MG572783)编码172个氨基酸。IGF-I基因II类与I类变异剪接体之间相比较,包含了99 bp的差异剪接区域,该区域为绵羊中新发现的剪接区域,构成了IGF-I基因II类变异剪接体的5´UTR和信号肽区域。这也是IGF-I基因I类和II类变异剪接体的主要差异,导致了氨基酸组成上的不同,进而引发蛋白质基本理化性质上(PI和亲疏水性等)的差异,但总体上IGF-I基因I类和II类变异剪接体相类似,均为水溶性氨基酸。目前,关于IGF-I基因II类变异剪接体的研究还不完善,因此进行系统进化树分析时可用的参考序列较少。本研究表明,绵羊与牛和山羊具有较高的同源性,这也符合物种进化规律。
含有信号肽结构的蛋白质可以通过内质网引导蛋白质肽链进入内质网腔内,然后分泌到胞外[13,18]。本实验对新获得的IGF-I基因II类变异剪接体在线预测信号肽后发现,第33~34位氨基酸为其预测切割位点,这也是IGF-I基因II类变异剪接体与I类变异剪接体的主要差异。有研究表明,IGF-I基因I类和II类变异剪接体相比较,II类变异剪接体含有更短的信号肽基序,这一特点将引发更有效的分泌功能[19]。本研究结果表明,IGF-I基因II类的2种变异剪接体在亚细胞定位、蛋白质二级结构和三级结构预测结果方面相类似,没有发现明显区别,而且它们都包括一定数量的共价修饰位点。一般情况下,肽链容易在包含游离羟基并且不带电荷的氨基酸残基(色氨酸、丝氨酸和苏氨酸)上发生磷酸化修饰,而此处带电状态的改变,将导致结构及活性发生变化。同磷酸化修饰相比较,糖基化修饰范围较广,其主要发生场所位于内质网内,蛋白质经过修饰后肽链可减弱或消除消化酶的作用,引导蛋白质的正确折叠,并赋予多种生物学活性以及传导信号的功能。
本研究对IGF-I基因II类变异剪接体的多组织表达分析结果表明,Ea型和Eb型在检测的12种组织中均表达,但表达水平存在明显的差异,其中以肝脏中的表达最高,这与IGF-I的生物学功能相适应。肝脏作为IGF-I的主要合成分泌器官,机体中约75%的循环水平IGF-I来自肝脏,与IGF-IR相互作用后,行使其生物学功能。除肝脏外,2种变异剪接体在胃和脂肪中的表达水平也相对较高。检测胃中IGF-I基因II类变异剪接体的表达规律时发现,羔羊期2种变异剪接体的表达量显著高于成羊期,推测这与羔羊期机体的快速生长、消化机能的逐渐成熟以及较高的日粮营养水平相适应[20-21]。此外,针对睾丸组织的研究表明,IGF-I基因II类Ea型在羔羊期的表达水平显著高于成羊期,这可能与生殖器官的逐步发育成熟有关,IGF-I基因对动物睾丸组织液、睾丸间质细胞类固醇激素的合成有重要影响,进而调节繁殖性能[22]。总体上,本研究表明,相对于Eb型,Ea型是主要的表达类型,在大多数组织均有表达,且表达水平较高,这与Oberbauer等[23]在鼠和牛中的研究结果相一致,这一现象产生的原因可能是由于二者在E结构域上的差异导致。
综上所述,本研究克隆得到了绵羊IGF-I基因II类的2种变异剪接体,并分析它们的结构特性及在主要组织器官中的时空表达规律,为揭示IGF-I基因不同变异剪接体的生物学功能奠定基础。
