小尾寒羊FSHβ和LHβ基因在生殖轴的表达研究
2019-01-23寸静宇刘秋月王翔宇胡文萍张效生张金龙赵永聚储明星
寸静宇,刘秋月,王翔宇,狄 冉,胡文萍,张效生,张金龙,赵永聚,储明星*
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;
2.西南大学动物科技学院,重庆 400715;3.天津市畜牧兽医研究所,天津 300381)
产羔性状是绵羊的重要经济性状之一。对于绵羊而言,提高每胎的产羔数是提升生产经济效益的重要措施[1]。许多研究表明,雌性动物繁殖性能主要受下丘脑-垂体-卵巢轴(Hypothalamic-Pituitary-Ovarian Axis,HPOA)的调控,HPOA的相关基因是研究动物繁殖性状的重要候选基因。
促卵泡激素(FSH)和促黄体素(LH)都是糖蛋白类促性腺激素,是控制哺乳动物生殖的核心激素,由垂体前叶嗜碱性细胞合成和分泌[2],它们由α和β2个亚基组成。FSH主要刺激卵泡的生长发育,且在LH的协同作用下,激发卵泡成熟,诱发排卵[3],同时在下丘脑-垂体-性腺轴中起重要作用。LH可与FSH协同促使卵泡排卵,排卵后在LH作用下颗粒细胞转变为黄体细胞,促进类固醇激素合成和分泌[4]。刘建斌等[5]研究发现,FSHβ基因可能是影响小尾寒羊高繁殖性能的一个主效基因。Zi等[6]报道,发情期高繁殖力乐至黑山羊脑垂体中FSHβ基因的mRNA表达量显著高于低繁殖力藏山羊。Kumar[7]通过建立LHβ基因敲除小鼠模型证明了该基因对哺乳动物繁殖性能有一定的影响。Nivet等[8]实验表明,LHβ缺乏可能引发牛卵泡的早期闭锁、肿瘤蛋白P53和转化生长因子b1这类闭锁剂的上调和生长支持的抑制。
鉴于此,本实验使用Taqman探针法对小尾寒羊群体FecB基因进行分型,经过连续观察并记录产羔数和黄体数(产羔数和黄体数均≥2,则定义为多羔),确定了小尾寒羊FecB基因突变++型中产单羔和产多羔的个体,并以此为研究对象,使用实时荧光定量PCR技术检测FSHβ和LHβ基因在生殖轴相关组织中的表达情况,试图在排除FecB主效基因的影响后找出FSHβ和LHβ基因和小尾寒羊产羔性能的关系,为小尾寒羊多羔性状的机理研究提供参考。
1 材料与方法
1.1 实验样品及主要试剂 随机选取2~3周岁健康状况良好的小尾寒羊母羊6只(FecB ++型单羔和多羔各3只),饲养于天津市畜牧兽医研究所试验羊场。用孕酮阴道栓(CIDR)对6只小尾寒羊进行处理,12 d后撤栓,在撤栓后45 h左右屠宰并立即采集大脑、小脑、下丘脑、卵巢、子宫、输卵管、垂体7种组织,液氮中保存,转移到-80 冰箱保存备用。
RNA提取试剂盒购于天根生化科技有限公司(北京),反转录试剂盒(PrimeScriptTMRT Reagent Kit)和荧光定量染料(SYBR®Premix Ex TaqTM Ⅱ)均购于TaKaRa公司(大连)。
1.2 RNA提取 用Trizol 和RNAprep pure动物组织总RNA提取试剂盒(天根生化科技北京有限公司)提取上述组织总RNA。利用Nanodrop 2000检测所提取的总RNA浓度和OD值,并用1.5%的琼脂糖凝胶对RNA进行电泳检测,置于-80 冷冻备用。
1.3 cDNA合成 利用反转录试剂盒反转录合成cDNA,反转录体系总体积为20 μL:PrimeScript RT Enzyme Mix I 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5×PrimeScript Buffer(for Real Time)4.0 μL,RNA 1.0 μg,RNase-Free ddH2O 补足至总体积为 20 μL。反转录反应条件:37 15 min,85 5 s,获得cDNA第一链。全程在冰上操作。反转录产物进行5倍稀释,用持家基因β-actin进行PCR检测,可成功扩增。将符合标准的cDNA置于-20 保存,以用于检测目的基因的表达。
1.4 定量引物设计 根据GenBank提供的绵羊FSHβ和LHβ基因mRNA序列(登录号分别为NM_001009798.1、NM_001009380.1),利用Primer Premier 6.0软件进行跨外显子引物设计,以β-actin(NM_001009784.2)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物名称和序列以及扩增片段大小见表1。
1.5 实时荧光定量PCR 荧光定量检测利用Roche Light Cycler®480Ⅱ 型荧光定量 PCR 仪进行,以β-actin基因为内参基因,每个样品重复检测3次。反应体系总 体 积 为 20 μL:SYBR Premix Ex TaqⅡ 10 μL, 上、下游引物各 0.8 μL,cDNA 模板 2.0 μL,RNase-Free ddH2O 6.4 μL。PCR 程序:95 预变性5 s,95 变性10 s,60 30 s,40个循环;反应结束后对熔解曲线进行分析。

表1 荧光定量引物信息
1.6 统计分析 采用2-ΔΔCT法计算目的基因相对表达量,数据差异显著性用SPSS 19.0进行统计学分析,组间比较用单因素方差分析(One-Way ANOVA),用最小显著差异法(LSD)进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 总RNA提取与cDNA合成 使用动物组织总RNA提取试剂盒提取小尾寒羊各组织的RNA,用1.5%琼脂糖凝胶电泳检测,结果表明,电泳条带明亮清晰、整齐、无拖尾(图1),说明所提取的小尾寒羊各组织的RNA完整度好,且无降解和污染;以反转录之后的cDNA为模板对β-actin进行sqRT-PCR扩增,设计的β-actin引物扩增效果良好(图2),目的片段与预期的97 bp一致,且条带单一,反转录之后的cDNA可以用于后续的荧光定量实验。
图 1 RNA电泳检测
2.2 绵羊FSHβ基因在小尾寒羊(多羔和单羔)繁殖相关组织中的表达 如图3所示,FSHβ基因主要集中在小尾寒羊下丘脑、卵巢、输卵管、子宫等组织中表达。在小尾寒羊多羔群体中,FSHβ基因在下丘脑、卵巢、输卵管、子宫、垂体、小脑、大脑组织表达量均高于单羔群体,其中下丘脑、卵巢、输卵管、子宫、垂体差异极显著(P<0.01)。

图2 cDNA检测
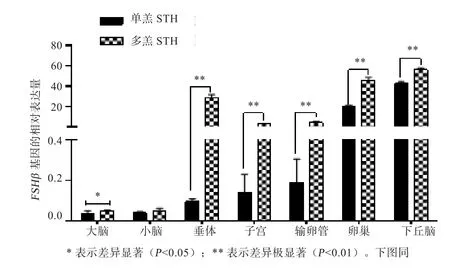
图 3 FSHβ基因在小尾寒羊的组织表达
2.3 绵羊LHβ基因在小尾寒羊(多羔和单羔)繁殖相关组织中的表达 如图4所示,LHβ基因在小尾寒羊垂体、下丘脑、输卵管组织高表达,在子宫、卵巢、小脑、大脑组织低表达。在小尾寒羊多羔群体中,LHβ基因在垂体、下丘脑、输卵管、子宫、卵巢组织表达量均极显著高于单羔群体(P<0.01)。
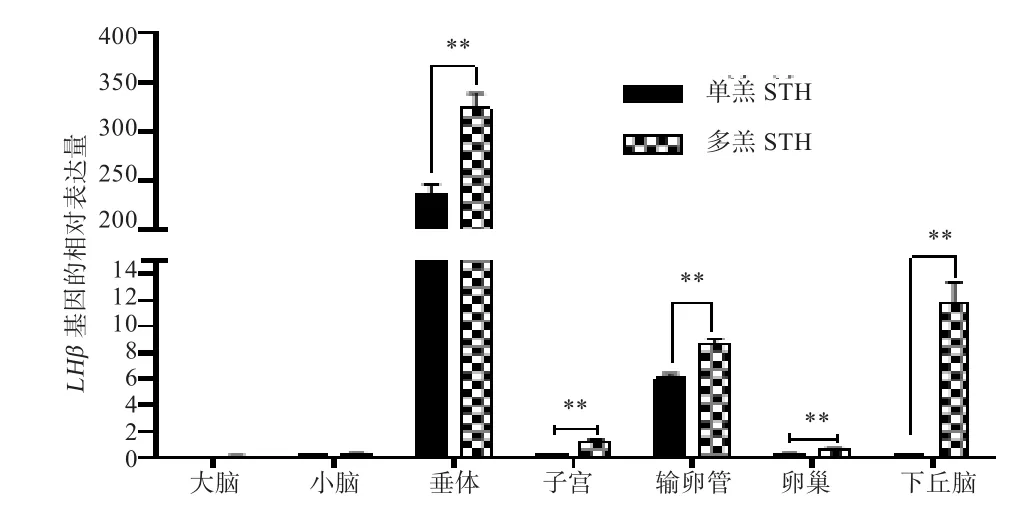
图 4 LHβ基因在小尾寒羊的组织表达
3 讨 论
3.1FSHβ基因表达与动物繁殖 已知FSHβ主要调节卵泡的增殖和分化[9]。研究发现,FSHβ可促进老鼠[10]和绵羊[11]的卵巢发育、卵泡形成以及增强FSHR mRNA和蛋白在卵巢中的表达。本研究结果显示,FSHβ在垂体、子宫、输卵管、卵巢和下丘脑中表达量较高,其次在大脑和小脑中表达,与FSHβ在二花脸和杜洛克猪[12]、家兔[13]、梅山猪[14]的表达结果相一致。本研究也发现,在小尾寒羊多羔群体中FSHβ基因在下丘脑、卵巢、子宫、输卵管、垂体组织中的表达量均极显著高于单羔群体。国内外研究者发现,FSHβ的表达在高产的兴国灰鹅的输卵管[15]和山羊的垂体和卵巢组织中[5-6]高于低产动物,与本实验结果一致。本研究结果显示,FSHβ在下丘脑组织高表达,与Wei 等[10]研究结果相一致,推测FSHβ可能在脑组织中参与和调控性激素的合成和代谢过程,同时也可能对脑组织的某些功能起调节作用。还有研究表明,FSHβ不仅只在雌性动物中表达,它也在雄性动物的繁殖相关组织中表达。产舒恒等[16]研究显示,FSHβ在梅山公猪的HPT轴的组织中也有表达,说明FSHβ基因不仅对雌性动物的繁殖性能有作用,也对雄性动物精子的发育与成熟有一定作用。FSHβ基因在小尾寒羊单、多羔群体大脑、小脑、垂体、子宫、输卵管、卵巢和下丘脑的组织均有表达,提示FSHβ可能在小尾寒羊发情或者排卵的过程中起着重要作用,但具体机制有待继续研究。
3.2LHβ基因表达与动物繁殖LHβ在繁殖过程中扮演一个关键的角色,它调控卵母细胞的发育成熟、排卵、受精和黄体的发育。Nivet等[8]的研究表明,LH缺乏可能引发牛卵泡的早期闭锁,说明了LHβ在卵巢发育中的重要作用。LHβ的作用必须与细胞膜上的特异性受体LHR结合,通过受体介导把生物信息传递到靶细胞内,才能发挥正常的生物学功能。因此,国内外对LHβ基因的研究相对较少。本研究发现,LHβ基因在小尾寒羊垂体、下丘脑、输卵管、大脑、小脑、卵巢、子宫7种组织中均有表达,其中在垂体、下丘脑、输卵管组织中表达量较高,在大脑、小脑、卵巢、子宫组织低表达。吴国平[17]和史红军等[18]检测到LHβ分别在浙东白鹅[17]和藏羊[18]的垂体组织中都有表达,这与本研究发现的LHβ在小尾寒羊的垂体组织中高表达相一致。另外,LH是由垂体合成分泌后经血液运输作用在 LHR,推测其与小尾寒羊多羔性能有一定关联。本研究也发现,在小尾寒羊多羔群体中LH基因在下丘脑、卵巢、子宫、输卵管、垂体、小脑、大脑组织表达量均极显著高于单羔群体。推测小尾寒羊的产羔性能受到LHβ的调控。
4 结 论
本研究通过实时荧光定量技术检测发现FSHβ和LHβ基因在小尾寒羊下丘脑-垂体-卵巢轴组织均有表达。FSHβ在小尾寒羊下丘脑高表达,LHβ在小尾寒羊垂体高表达。FSHβ和LHβ基因在小尾寒羊多羔群体的繁殖相关组织表达量均极显著高于单羔群体,推测FSHβ和LHβ在小尾寒羊多羔繁殖性状的调节过程中可能起到一定作用。
