EMIES/p-TsOH型低共熔溶剂的合成及其氧化脱硫性能的研究
2019-01-22王鑫博李秀萍赵荣祥
王鑫博,李秀萍,赵荣祥
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
汽柴油燃烧形成的SOx是造成大气污染的元凶之一[1]。为了保护人类赖以生存的环境,世界上很多国家纷纷制定燃料油含硫标准强制降低汽柴油中的硫含量[2,3]。这些规定给炼油企业造成了巨大的压力。目前,工业上较为成熟的脱硫方法是加氢脱硫[4-6],该技术对于硫醇、硫醚等脂肪族硫化物具有较高的脱硫率,而对于噻吩类硫化物的脱除效果并不明显[7,8]。此外,加氢过程反应条件苛刻(高温、高压),需要使用昂贵的催化剂,这些缺点使得越来越多的研究人员将目光放在了非加氢脱硫上,非加氢脱硫技术包括萃取脱硫[9]、氧化脱硫[10]、吸附脱硫[11,12]、生物脱硫等[13]。其中,氧化脱硫技术具有反应条件温和、不需要氢气和对于噻吩类硫化物脱除率高等优点,被认为是最具有发展前途的脱硫工艺[14]。
在氧化脱硫过程中,常常要加入萃取剂来提高脱硫效果。传统的萃取剂多为甲酰胺、吡咯烷酮和乙腈等有毒的化学试剂。这些试剂的应用对于环境会造成破坏。使用离子液体可以在一定程度上解决污染环境的问题,但是离子液体价格昂贵,制备过程复杂等缺点限制了其工业应用。近年来,一种更为绿色的溶剂,低共熔溶剂[15](DESs)的出现有望解决离子液体在脱硫方面的不足。低共熔溶剂[16,17]是氢键受体和氢键供体通过氢键制备而成。其具有挥发性小、不易燃烧、可循环使用的优点[18-20]。通常,低共熔溶剂的熔点低于合成的原料,这一性质使得原本为固相的原料在形成低共熔溶剂后变成了液相,使得其有机会成为脱硫过程的萃取剂。Gano等[21]利用氯化铁型的低共熔溶剂萃取脱除模拟油中的DBT,脱除率达到64%。Li等[22]制备TBAC/PEG低共熔溶剂,脱除率达到82.83%。但是单一的萃取脱硫很难达到较高的脱硫水平,为进一步提高脱硫效果,一些学者考虑合成具有催化活性的功能型低共熔溶剂应用于氧化脱硫过程。其中,Yin等[23]通过制备ChCl/p-TsOH和TBAC/p-TsOH型低共熔溶剂,脱硫率可以达到97.25%和95.9%。Liu等[24]通过制备ChCl/2PEG型低共熔溶剂,对于模拟油中的DBT脱除率达到99.1%。Cao等[25]制备ChCl/FeCl3型低共熔溶剂,发现其具有较高的脱硫效果。Dai等[26]以ChCl/p-TsOH为催化剂,H2O2为氧化剂,脱硫率可以达到89%。Lü等[27]以四丁基氯化铵草酸物质的量比1∶2型低共熔溶剂作为催化剂,H2O2作为氧化剂,脱硫率可以达到98%。Mao等[28]通过制备C9H10O2/0.5ZnCl2型低共熔溶剂,脱硫率达到99.2%。以上研究人员所制备的低共熔溶剂通常都具有良好的脱硫效果,但是由于都含有Cl离子,在其使用和提纯过程中难免会对环境带来污染[29]。
本研究是通过简单加热搅拌的方式将1-乙基-3-甲基咪唑硫酸乙酯(EMIES)和对甲苯磺酸(p-TsOH)混合物制备非氯型低共熔溶剂。并以其作为催化剂和萃取剂、H2O2作为氧化剂应用于油品的氧化脱硫。考察了反应温度、氧硫比、低共熔溶剂加入量以及含硫类型对硫化物脱除效果的影响,并对不同硫化物脱除进行了动力学分析。并在实验的基础上对于氧化脱硫的机理进行讨论。
1 实验部分
1.1 试剂及仪器
正辛烷(98%,国药集团化学试剂有限公司);二苯并噻吩(98%,阿拉丁试剂有限公司);苯并噻吩(97%,阿拉丁试剂有限公司);4,6-二甲基二苯并噻吩(99%,阿拉丁试剂有限公司);对甲苯磺酸(99%,阿拉丁试剂有限公司);H2O2(30%,辽宁泉瑞试剂有限公司);1-乙基-3-甲基咪唑硫酸乙酯(上海成捷化学有限公司)。微库仑综合分析仪(WK-2D,江苏江分电分析仪器有限公司);傅里叶变换红外光谱仪(FT-IR,NEXUS 870,美国尼高力仪器公司,KBr压片);AV-400型核磁共振仪(CH3OD为溶剂,TMS为内标);热重分析仪(SDT Q600,美国TA仪器公司)。
1.2 低共熔溶剂的制备
将1-乙基-3-甲基咪唑硫酸乙酯和对甲苯磺酸以物质的量比1∶1加入到50 mL的烧杯中混合均匀。在100 ℃的温度下,搅拌至固体溶解成黏稠状液体,即为 EMIES/p-TsOH低共熔溶剂,图1为低共熔溶剂的合成过程和氢键形成位置。

图 1 低共熔溶剂的合成及氢键模型
1.3 萃取-氧化脱硫过程
分别将一定量的二苯并噻吩(DBT)、4,6-二甲基二苯并噻吩(4,6-DMDBT)和苯并噻吩(BT)溶解到500 mL的正辛烷中,配置成500 mg/L的模拟油。在一定的温度下,将一定量的低共熔溶剂、H2O2和5 mL模拟油加入到带有冷凝装置的100 mL平底三角瓶内,在一定的温度下搅拌进行氧化脱硫反应,总的反应时间为180 min。每隔20 min在上层油相吸取少量模拟油使用WK-2D微库仑硫含量测定仪测定硫含量,其脱硫率按下面公式进行计算[30]:
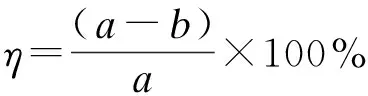
(1)
式中,η为脱硫率,a为脱硫前模拟油硫含量(500 mg/L),b为脱硫后模拟油硫含量。
2 结果与讨论
2.1 低共熔溶剂的红外光谱分析
为了研究1-乙基-3-甲基咪唑硫酸乙酯与对甲苯磺酸之间是否形成氢键,分别对1-乙基-3-甲基咪唑硫酸乙酯、对甲苯磺酸和EMIES/p-TsOH进行了红外分析,其红外谱图见图2。在1-乙基-3-甲基咪唑硫酸乙酯的红外谱图中可以看出,在1574 cm-1处的峰属于咪唑环上C=N的伸缩振动,1700-1400 cm-1属于不饱和C的伸缩振动以及芳环骨架的震动,说明了咪唑环的存在[31],而1171 cm-1出现的峰是归属于咪唑环上C-H面内变形振动,1210 cm-1归属于 S=O键的伸缩振动。通过对甲苯磺酸的红外表征,可以看出,在1600、1453和1495 cm-1处的峰属于苯环中的C=C振动,680和566 cm-1是C-S键的弯曲振动[32]。在EMIES/p-TsOH的红外谱图中含有EMIES和p-TsOH的特征峰,由对比可知,在形成低共熔溶剂后,EMIES中1210 cm-1处的吸收峰偏移到1227 cm-1。说明EMIES和p-TsOH之间存在键合作用。

图 2 EMIES/p-TsOH、 EMIES、 p-TsOH的红外光谱谱图
2.2 低共熔溶剂的氢谱分析
为了进一步验证EMIES和p-TsOH之间形成了氢键,分别对EMIES、p-TsOH和EMIES/p-TsOH进行了1H-NMR分析,结果见图3。由图3可知,在p-TsOH的氢谱中,δ=2.23和7.52处的峰,在合成低共熔溶剂后分别移动到了δ=2.36和7.75处。而EMIES的氢谱中δ=4.74处的峰也移动到了EMIES/p-TsOH谱图中的δ=4.22处。说明EMIES和p-TsOH之间形成了氢键[33,34],见图3。
2.3 低共熔溶剂的热重分析
为了研究EMIES/p-TsOH低共熔溶剂的热稳定性,对低共熔溶剂和组成低共熔溶剂的单一组分进行了热重分析,结果见图4。

图 3 低共熔溶剂的 1H-NMR谱图
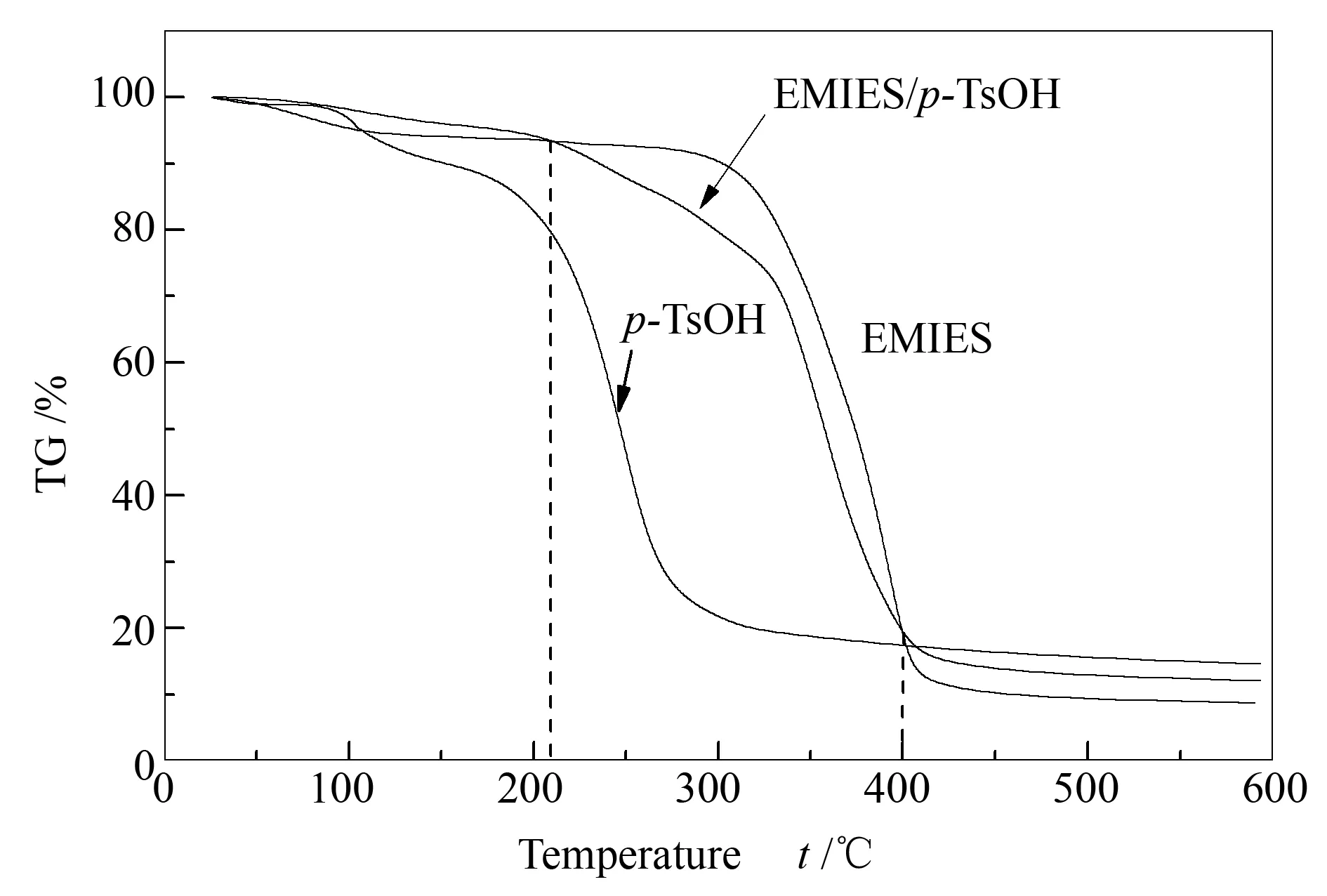
图 4 EMIES/p-TsOH低共熔溶剂的热重分析
由图4可知,低共熔溶剂的热分解过程可以分成三个阶段:分别为低于208 ℃、208-400 ℃,高于400 ℃。相比于单一组分,在208 ℃之前低共熔溶剂的热稳定性好于单一组分,这可能是由于单一组分间的氢键作用提高了低共熔溶剂的热稳定性[35]。在208-400 ℃的第二阶段,低共熔溶剂的热稳定性弱于离子液体而明显强于对甲苯磺酸。在400 ℃以后,低共熔溶剂趋于完全分解[36]。从上面的分析结果可以看出,低共熔溶剂在208 ℃之前具有较好的热稳定性。而氧化脱硫反应进行的温度一般在100 ℃以下,所以在此氧化脱硫条件下低共熔溶剂可以稳定的存在。
2.4 不同脱硫体系对脱硫率的影响
为了研究不同脱硫体系对模拟油中DBT脱除的影响,设计了三组不同的脱硫体系,结果见表1。当以EMIES/p-TsOH萃取剂进行单一的萃取脱硫时,模拟油中的DBT脱除率仅为1.4%。以EMIES作为催化剂与萃取剂,H2O2作为氧化剂,对模拟油中的DBT脱除率为36%。然而,当使用低共熔溶剂EMIES/p-TsOH为萃取剂和催化剂,H2O2为氧化剂时,对模拟油中的DBT脱除率高达96.2%。因此,选择EMIES/p-TsOH为研究对象,进行反应条件的优化。

表 1 不同脱硫体系对脱硫率的影响
reaction condition: 5 mL model oil, 70 ℃,n(H2O2)/n(S)=6, 1 mL EMIES/p-TsOH, 180 min
2.5 反应温度对脱硫率的影响
反应温度是影响脱硫效果的一个重要因素。在EMIES/p-TsOH作为催化剂与萃取剂,过氧化氢作为氧化剂的氧化-萃取脱硫体系中,反应温度对模拟油中的DBT脱除效果的影响见图5。

图 5 温度对脱硫的影响
由图5可知,在180 min的反应时间内,当反应温度从40 ℃升高到70 ℃时,模拟油中的DBT脱除率从70%提高到95%。这是因为提高反应温度可以降低低共熔溶剂的黏度,增加低共熔溶剂的活性,进而提高模拟油中DBT的脱除率[37]。然而,当温度从70 ℃提高到80 ℃时,模拟油中DBT的脱除率未见升高,这是因为过高的反应温度使过氧化氢分解加剧,此外,氧化反应产生的水稀释了低共熔溶剂,不利于模拟油中DBT的萃取脱除[38]。综上,选择70 ℃作为最佳的反应温度。
2.6 n(H2O2)/n(S)比对模拟油中DBT脱除率的影响
图6为双氧水加入量对脱硫性能的影响。由图6可知,当n(H2O2)/n(S)=2时,模拟油中的DBT脱除率仅为56%。当n(H2O2)/n(S)由2增长到8时,模拟油中的DBT脱除率由56%上升到96.2%。这是因为增加过氧化氢的量,可以提高反应体系中DBT的氧化效率[39,40]。当n(H2O2)/n(S)比继续增加到10时,DBT脱除率仅增长0.2%,这是由于过氧化氢分解产生的水会稀释低共熔溶剂,影响其萃取能力[41]。因此,加入过多的双氧水是不利的。综合考虑经济成本,该脱硫体系的最佳氧硫比是8。

图 6 氧硫比对脱硫率的影响
2.7 低共熔溶剂加入量对DBT脱除率的影响
在本氧化-萃取脱硫过程中,低共熔溶剂既是催化剂也是萃取剂,是极为重要的反应因素。其含量对DBT脱除效果的影响见图7。由图7可知,当剂油比从0.1∶1增长到0.2∶1时,DBT的脱除率从95.4%增长到96.2%。这是因为增加低共熔溶剂的量可以增强模拟油中DBT的萃取效率。然而,当剂油比从0.2∶1增长到0.4∶1,该脱硫体系对模拟油中的DBT脱除率从96.2%降低到95%。这是因为过量的低共熔溶剂虽能促使更多的二苯并噻吩进入到低共熔溶剂相中,但是体系中氧硫比会下降,影响到模拟油中DBT的脱除[42]。综合以上分析,最佳的剂油比是0.2∶1。
2.8 硫化物种类对DBT脱硫率的影响
实际油品中含有多种不同硫化物,而这些硫化物的脱硫活性存在较大的差别。为此,在最佳的反应条件下,研究了4,6-DMDBT和BT的脱除效果,并将它们的脱硫率与DBT进行对比,实验结果见图8。

图 7 低共熔溶剂的量对脱硫率的影响

图 8 不同硫化物的脱除效果
由图8可知,模拟油中的DBT、4,6-DMDBT和BT的脱除率依次为96.2%、92.2%和88.8%。可以看出在相同的反应条件下,DBT要比BT更容易脱除,这一结论与不同硫化物上硫原子电子云密度和空间位阻效应有关,依据文献报道,DBT的电子云密度为5.758,BT的电子云密度为5.739,4,6-DMDBT的电子云密度为5.758。在氧化脱硫过程中,越高的电子云密度能够获得越高的脱硫率[43,44]。4,6-DMDBT和DBT的电子云密度较为相近。但是,4,6-DMDBT上的两个甲基阻止硫原子与低共熔溶剂中活性位物种的接触。因此,DBT的脱除率大于4,6-DMDBT。
2.9 不同硫化物的动力学分析
根据Wei等[45]的报道,在催化氧化反应中,氧化脱硫反应速率遵循一级反应动力方程[46],如下列公式所示。本实验通过反应动力学进一步评估低共熔溶剂对DBT、4,6-DMDBT和BT的脱除能力。
(2)

(3)
依据上面的公式,对DBT、4,6-DMDBT和BT进行动力学分析,其动力学分析结果见图9,图9中,C0是初始硫含量,Ct是反应tmin后剩余的硫含量,k是一级反应动力学常数,R2是相关系数。由动力学可知在该氧化脱硫系统中DBT的一级反应动力学常数为0.04063 min-1,相关系数为0.98569;4,6-DMDBT的一级反应动力学常数为0.01184 min-1,相关系数为0.99228;BT的一级反应动力学常数为0.0013 min-1,相关系数为0.98218。动力学常数大的反应速率快,据此,DBT最易被脱除,而BT的脱除最难,这与之前的实验结果一致。

图 9 不同硫化物氧化脱除的动力学分析
2.10 表观活化能
根据一级动力学方程(ln(C0/Ct)=kt)[47],其中,C0为总的硫含量,Ct为时间tmin时的硫含量,t为反应时间,并且Ct=C0(1-x)。所以一级动力学方程可以写成ln(1-x)=-kt,其中,x为转化率。图10为不同温度下的一级动力学方程曲线。由图10可知,在333、343和353K温度下的一阶反应速率常数k分别为0.00983、0.02291和0.03818 min-1。根据Arrhenius方程[48](lnk=-Ea/RT+lnA)可计算出氧化脱出DBT所需的表观活化能,其中,R为摩尔气体常数,T为热力学温度,A为指前因子。
图11为在EMIES/p-TsOH 催化作用下DBT的表观活化能。
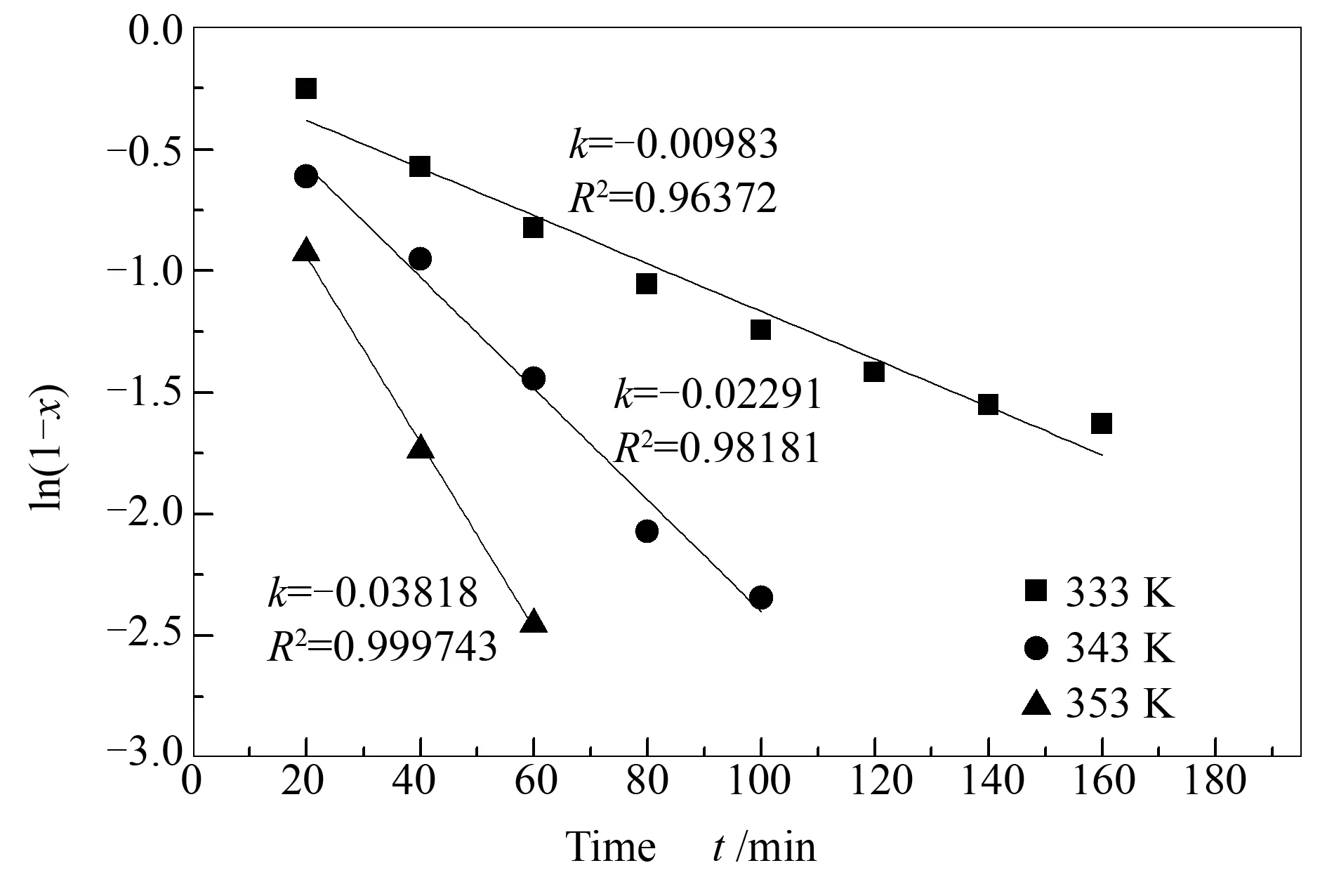
图 10 不同温度下的一级动力学方程曲线

图 11 在EMIES/p-TsOH 催化作用下DBT的表观活化能
由图11可知,由Arrhenius方程可知,通过lnk和1/RT可求出表观活化能,在该反应体系下萃取-氧化脱除模拟油中DBT的表观活化能约为66.4 kJ/mol。
2.11 低共熔溶剂的再生与循环使用
在萃取-氧化脱硫反应结束之后,先用分液漏斗将油相和低共熔溶剂相分离,再用旋转蒸发仪将低共熔溶剂相中残余的水蒸发出去,用同体积的CCl4对低共熔溶剂进行反萃取三次,再利用旋转蒸发仪将CCl4蒸出。在三角烧瓶中加入5 mL模拟油,新鲜的过氧化氢和回收的低共熔溶剂在最优的反应条件下进行重复性实验,实验结果见表2,低共熔溶剂经过五次使用后,模拟油中的DBT脱除率由96.2%降低到93.6%。这种脱硫活性的降低可能与回收过程中低共熔溶剂有少量损失和氧化产物的存在有关[49]。

表 2 EMIES/p-TsOH的循环使用性能
reaction condition:Voil=5 mL;n(H2O2)/n(S)=8;
t=70 ℃;VEDSs/Voil=0.2∶1
2.12 氧化产物的红外表征
为了确定氧化脱硫过程中氧化反应生成物的种类。首先将低共熔溶剂相和油相用分液漏斗分开,再用旋转蒸发仪将低共熔溶剂相中的水移除。加入等体积的四氯化碳萃取出低共熔溶剂相中的反应产物,再用旋转蒸发仪蒸发残余的四氯化碳,最后得到白色晶体,见图12(a)。将白色晶体与二苯并噻吩进行红外分析,所得红外光谱谱图见图12(b)。由图12(b)可知,在白色晶体的红外光谱谱图中,分别在1166、1047和1288 cm-1的位置有三个二苯并噻吩砜特征峰[50,51]。这说明DBT被氧化成了DBTO2。

图 12 DBT和氧化产物的红外光谱谱图
2.13 氧化脱硫机理
在以EMIES/p-TsOH为催化剂和萃取剂,H2O2为氧化剂的脱硫体系中,DBT的萃取-氧化脱硫机理见图13。首先,EMIES/p-TsOH低共熔溶剂具有一定的萃取能力,通过π-π共轭作用将模拟油中的DBT萃取到低共熔溶剂相中,然后通过过氧化氢的强氧化性将低共熔溶剂氧化成过氧化物的形式,此过氧化形式的低共熔溶剂可以将其中的DBT氧化成为相应的二苯并噻吩砜,由于模拟油相和低共熔溶剂相存在浓度差,DBT不断被萃取到低共熔溶剂相中被氧化成相应的砜类,直到体系的双氧水消耗殆尽。

图 13 EMIES/p-TsOH存在下的氧化脱硫机理
3 结 论
通过加热搅拌EMIES和p-TsOH的混合物,制备了EMIES/p-TsOH型低共熔溶剂。并通过FT-IR、1H-NMR和TGA表征对低共熔溶剂进行分析探讨,以确定反应物间形成了低共熔溶剂。在反应温度为70 ℃,n(H2O2)/n(S)为 8,VEDSs/Voil= 0.2∶1和5 mL模拟油的最佳反应条件下,EMIES/p-TsOH对模拟油中的DBT、4,6-DMDBT和BT的脱除率达到96.2%、92.2%和88.8%。EMIES/p-TsOH具有较高的催化活性以及稳定性。
