罕见“三重综合征”1例并文献复习
2019-01-22曹敏玲池晓玲蒋俊民
曹敏玲,池晓玲,蒋俊民
患者,女,49岁,身高151 cm,体质量42.3 kg,既往无乙肝病史。父亲曾有乙肝、黄疸病史,因肝癌去世,其弟弟亦有乙肝及黄疸病史。2017年7月无明显诱因下逐渐身体消瘦(体质量降低2.5 kg ),后出现身目黄染,伴有小便黄,呈浓茶样,陶土样大便,量少,纳差,上腹部胀闷不适, 自行服用胃药(具体不详)后无缓解。2018年2月10日身目黄染加重,门诊筛查肝炎分型均阴性,进一步行腹部CT增强扫描示:肝S4段小囊肿;肝右叶小斑点状钙化灶;肝门区淋巴管轻度扩张;胆囊结石。进一步行上腹部MR示:(1)早期肝硬化,脾大,胃底静脉曲张;肝内多发囊肿;胆囊未见显示,肝S4段小囊肿可能(图1);(2)磁共振胰胆管造影(MRCP)示胆总管胰上端未见显影,意义待查 ;(3)胆总管胰腺上段管壁疑增厚。于2月11日住院治疗,查自身免疫性肝病(AIH)示:SSA/52KD抗体阳性,抗gb210抗体阳性,抗线粒体M2抗体阳性;免疫全套示:免疫球蛋白A 4.29 g/L,免疫球蛋白G 28 g/L,免疫球蛋白M 5.25 g/L;肝穿刺病理提示:肝细胞水肿,点状坏死及碎片状坏死,汇管区较多淋巴细胞浸润,胆管淤积,伴早期肝硬化形成,符合病毒性肝炎或者自身免疫性肝炎改变。免疫组化及特殊染色结果:Glypican-3(-),Hepatocyte(+),CD34血管(+),CK19(胆管+),Ki-67(散在+),p53(-),CEA(-),CD10(-),PAS(-)。诊断为重叠综合征:AIH+原发性胆汁性肝硬化(PBC)。 因护肝治疗后肝功能好转不明显,3月初行内窥镜下逆行胆管造影术(ERCP)+鼻胆管引流,引流2周后黄疸症状减轻不明显,进一步行鼻胆管造影显示:胆总管无扩张,肝内胆管稀疏、僵直;胆管造影考虑:硬化性胆管。出院后坚持熊去氧胆酸(UDCA)250 mg、甘草酸二胺口服,每日3次。治疗后门诊复查肝功能提示:胆红素进行性升高(由122 升至153 μmol/L),凝血功能均正常。7月21日复查上腹部MRCP:肝内胆管走行正常,轻度扩张,肝总管及胆总管上段显影不清,胆囊未见明确显影,胰管显影良好,未见明显扩张(图2)。胃镜提示:胃内多发溃疡,未予激素治疗,维持甘草酸二胺及熊去氧胆酸治疗。7月22日复查总胆红素上升至158 μmol/L,结合MRCP结果,以及患者长期陶土样大便,考虑为三重综合征:AIH+PBC+原发性硬化性胆管炎(PSC)。以PSC为主,调整熊去氧胆酸250 mg ,每日4次。7月31日复查肝功能较前好转,总胆红素下降至128.1 μmol/L,后病情稳定出院,1个月后黄疸较前进一步消退,患者自诉无特殊不适。
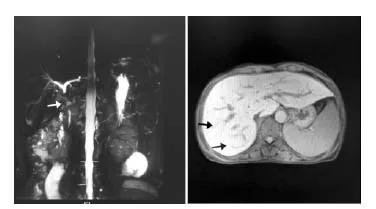
图1 上腹部MR增强表现 图2 上腹部MRCP表现
讨论AIH是由异常自身免疫反应介导的肝实质炎性病变,多发于女性, 以高丙种球蛋白血症、血清抗核抗体(ANA)、抗平滑肌抗体(SMA)等阳性和对免疫抑制治疗应答为特点[1]。本病为遗传倾向疾病,存在相关基因的人群能在特定的环境、药物、感染等因素影响下发病。常伴肝外其他自身免疫性疾病(如甲状腺炎)[2]。由于25%的AIH患者可能出现AMA-M2阳性而可能与PBC混淆,但AIH的组织病理以肝细胞损害为主、胆管损害很少[3]。值得注意的是当患者同时具备AIH与PBC的临床与病理学特点时,应考虑AIH/PBC重叠综合征。本例患者肝穿刺病理同时存在肝细胞界面炎性反应及汇管区胆汁淤积表现,故病理考虑AIH+PBC重叠。
PBC多见于中年女性,早期无症状或轻微皮肤瘙痒,肝内淤胆进行性加重,常常伴高胆固醇血症而发生皮肤黄色瘤,多伴其他自身免疫性疾病(Sjögren综合征、慢性风湿性关节炎、慢性自身免疫性甲状腺炎等),晚期可进展为肝硬化、门脉高压、腹水等特征。实验室检查可有胆管系酶血清ALP、GGT等明显升高,IgM升高,ESR加快,血总胆固醇升高[4]。AMA是PBC特异性最高的自身抗体。无症状PBC阳性率约88.1%,有症状PBC约为92.8%。目前已知PBC患者中AMA的亚型之一抗M2的阳性率最高,可高达95%[5]。肝脏组织学特点包括,中等小叶间胆管或间隔胆管显示慢性非化脓性破坏性胆管炎或小胆管消失[6]。同时, 也发现UDCA的疗效与PBC的病理分期是明显相关的,在PBC早期应用UDCA的效果较好,若PBC已达Ⅲ~Ⅳ期,则加大UDCA剂量也不能使患者的症状及肝功能改善[7]。本例患者病理分期已达Ⅲ~Ⅳ期,理论上若以PBC为主,加大UDCA剂量难以见到生化学改善,而该患者加大剂量后生化学应答良好,更加支持重叠PSC诊断。
PSC是一种以胆管进行性炎性反应、增生和纤维化为特征的慢性胆汁淤积性肝病,最终进展到肝硬化,有10%~30%的患者将发展为胆管癌[8]。本病多见于青年男性,男女比例为2∶1,大多数患者伴随有炎性肠病(inflammatory bowel disease, IBD) 。发病机制目前尚无定论,可能与免疫机制失调、基因易感性和胆管上皮细胞功能紊乱有关[9]。ERCP及MRCP发现胆道串珠样或肝内胆管枯树枝样改变是诊断PSC的金标准[10]。PSC最具特征性的组织病理改变是胆管周围“洋葱皮样”改变,表现为纤维组织围绕小胆管呈同心圆样排列,但此特征性病理改变很少见,仅见于10%的PSC 患者[11]。Ig4相关性胆管炎(IAC)是新近发现的病因不明的胆道疾病,其生化和胆管形态特征与PSC相同,经常累及肝外胆管,对抗炎治疗有应答,往往与自身免疫性胰腺炎及其他纤维化状态关联,特点是血清IgG4升高和胆管与肝组织中IgG4阳性浆细胞浸润[12]。本例患者MRCP可见肝内胆管稀疏、僵直,此为类枯树枝样改变,为诊断PSC的金标准,IgG4阴性,暂不考虑为IAC。UDCA药物治疗PSC能改善患者的临床症状及生化指标,除了并发胆管癌的患者,肝脏移植仍然是治愈PSC的惟一选择[13]。综上所述,患者从肝脏病理及胆管造影结果提示同时具备AIH+PBC+PSC的经典表现,故明确诊断为罕见的“三重综合征”。
临床上,AIH+PBC+PSC三种免疫性肝病重叠极其罕见[14]。一般来说以AIH+PBC或者AIH+PSC多见[15]。PBC与AIH重叠发病的混合型,以及AMA阴性、ANA阳性、ALT又较高的PBC诊断比较困难[16]。但PBC时AIP、GGT、IgM及血清胆固醇远比AIH时高。抗M2及肝活检更具有重要的鉴别意义[17]。PSC因有慢性淤胆性肝病特点,故需与原发性胆汁性肝硬化鉴别[18]。要点是PSC好发男性,IgM不高或稍高,AMA阴性,p-ANCA阳性,更重要的是通过MRCP/ERCP及肝活检鉴别[19]。患者肝活检病理提示PBC+AIH,MRCP又可见肝内胆管改变,肝外胆管显影不清,结合陶土样大便,直接胆红素比值明显升高,存在梗阻性黄疸,又与PSC诊断吻合。PSC可与AIH重叠,表现为两者病变特征。比较罕见的是PBC与PSC重叠,病例数较少,需要MRCP/ERCP及病理同时证实。故结合肝脏病理及多个影像学检查,均符合三重叠免疫性肝病的特征。UDCA属于亲水性胆汁酸,经代谢进入机体可成为优势胆汁酸,占体内总胆汁酸的40%~50%。具有免疫调节、细胞保护与利胆作用, 机制表现为增加内生胆汁酸分泌,同时减少内生胆汁酸的潜在细胞毒作用;能阻碍炎性细胞因子的产生,还可以保护细胞膜稳定,同时降低异常HLA抗原的生成。 对于单纯PSC的患者,一般推荐最大剂量为20~30 mg·kg-1·d-1,并未出现明显不良反应。本例患者予以25 mg·kg-1·d-1治疗后,生化指标较前逐步好转,观察1个月未见明显不良反应。故对于PSC为主的“三重综合征”的患者,可以尝试加大UDCA的剂量改善肝功能。
