吗啡联合厄洛替尼对肺腺癌裸鼠成瘤的抑制作用及机制
2019-01-22张雅静马骖梁欢相成张燕
张雅静,马骖,梁欢,相成,张燕
厄洛替尼是一种特异性的表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase Inhibitors,EGFR TKIs),通过竞争性地抑制ATP与受体胞内区结合,从而抑制酪氨酸激酶活化,阻断EGFR的传导通路,从而达到治疗肿瘤的目的。目前已广泛应用于EGFR敏感突变的晚期非小细胞肺癌患者的治疗,不但使患者的中位生存时间明显延长,且总体耐受良好[1-2]。吗啡作为阿片类药物的代表,广泛应用于癌痛的治疗,极大地提高了肿瘤患者生活质量。但有研究发现,阿片类药物可能影响肿瘤复发、转移[3-5]。因此,本文通过建立裸鼠成瘤模型进一步在体内观察吗啡联合厄洛替尼对肿瘤细胞的影响,为其临床安全应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 动物: SD雄性裸鼠,4周龄,体质量(15±3)g,购自河北医科大学实验动物中心,实验动物生产合格证号:SCXK(冀)2013-1-003,于河北科技大学药用分子实验室无菌条件下分笼饲养,自由进食饮水;裸鼠适应性喂养1周后,随机数字表法分为4组,对照组、吗啡组、厄洛替尼组、吗啡联合厄洛替尼组(联合组),每组6只。
1.1.2 试剂及药物: 人非小细胞肺癌细胞(HCC827)(中科院细胞库),RPMI1640培养基(美国Gibco公司),胎牛血清(美国Gibco公司),TUNEL检测试剂盒(Millipore),BAX (Abcam,ab53154)、Caspase-3(Abcam,ab1384)、Bcl-2(Abcam,ab59348),厄洛替尼(上海罗氏制药有限公司),盐酸吗啡片(东北制药集团沈阳第一制药有限公司)。
1.2 裸鼠成瘤模型构建 2017年2—8月于河北科技大学药用分子实验室进行实验。
1.2.1 细胞培养及药物处理: 使用含10%胎牛血清的RPMI-1640培养基培养HCC827细胞,培养条件:37℃,5% CO2+95%空气孵育箱内常规培养传代。
1.2.2 皮下成瘤: 取对数生长期HCC827细胞,经胰酶消化后制成5×107/ml的单细胞悬液,于各组鼠前腋皮下注射200 μl。对照组每日胃饲生理盐水 5 ml/d,吗啡组胃饲含吗啡(20 mg/kg)生理盐水5 ml/d,厄洛替尼组胃饲含厄洛替尼(5 mg/kg)生理盐水5 ml/d,吗啡联合厄洛替尼组胃饲含吗啡(20 mg/kg)和厄洛替尼(5 mg/kg)生理盐水 5 ml/d。实验中裸鼠自由摄食饮水。
1.3 检测指标与方法
1.3.1 肿瘤体积计算: 每周测量瘤体长径(a)和瘤体短径(b),并计算肿瘤体积。肿瘤体积(mm3)=ab2/2。
1.3.2 肿瘤细胞凋亡检测: 实验3周后处死裸鼠,分离新鲜肿瘤组织,部分用于磷酸盐缓冲液(PBS)冲洗,胰蛋白酶消化制成单细胞悬液,调整细胞数为1×106/ml,使用预先配制好的1×Binding Buffer 100 μl重悬细胞,按组别加入FITC Annexin Ⅴ 5 μl和PI染料5 μl震荡混匀,室温避光孵育15 min后加入1×Binding Buffer 400 μl混匀,流式细胞仪(FITC Annexin Ⅴ/PI双染法)检测各组细胞凋亡情况。Annexin Ⅴ-FITC阳性PI阴性细胞,代表早期凋亡率;Annexin Ⅴ-FITC阳性PI阳性细胞,代表晚期凋亡率。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.3.3 Bcl-2、Bax和Caspase-3蛋白表达检测: 上述剩余肿瘤组织标本用眼科剪剪碎后加入大约5倍体积的组织裂解液,用玻璃研磨器将组织块研碎,冰上裂解30 min,4℃低温离心机高速离心(13 000 r/min 20 min),提取上清液即为总蛋白。采用BCA试剂盒进行蛋白定量后行Western blot实验:抗Bax(1∶1 000)、Bcl 2(1∶500)、Caspase-3(1∶300)和抗GAPDH抗体(1∶1 000),4℃孵育过夜。TTBS洗膜3次,每次20 min,加入HRP标记的IgG(TTBS按1: 10 000稀释),37℃孵育1 h。TTBS避光洗膜3次,每次25 min,将ECL试剂盒中的A液和B液等量混合,滴加于膜上,反应1 min后对Western blot条带进行显影,以目的条带和GAPDH条带的光密度值比值作为最终结果。

2 结 果
2.1 肿瘤体积比较 对照组肿瘤生长迅速,随时间延长肿瘤体积明显增大;吗啡组肿瘤生长缓慢,体积相对减小,但与对照组相比差异无统计学意义(P=0.063);厄洛替尼组及联合组肿瘤生长更为缓慢,裸鼠肿瘤体积均明显缩小,与对照组比较差异具有统计学意义(P=0.000);与厄洛替尼组比较,联合组变化不明显(P=0.701),见图1。
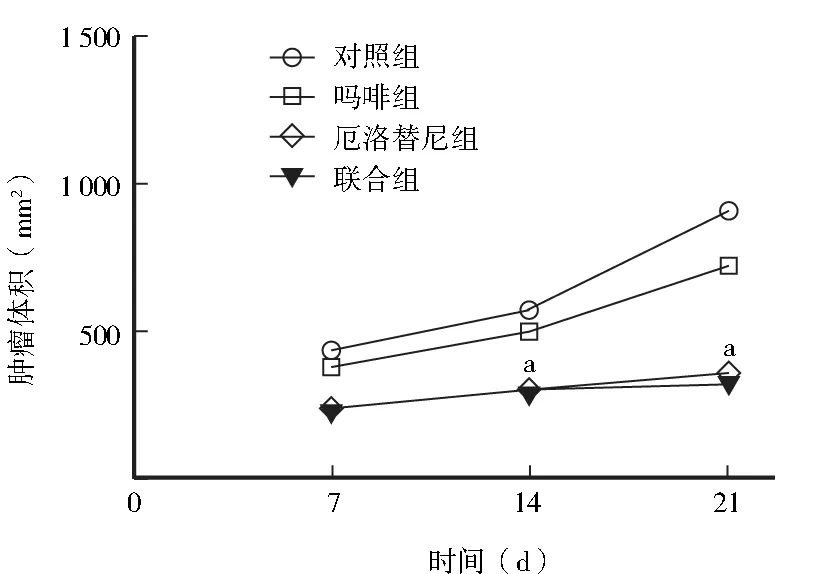
注:与对照组比较,aP<0.01
2.2 肿瘤细胞凋亡率比较 各组细胞凋亡率比较,差异有统计学意义(F=126.287,P<0.01)。与对照组(11.77±0.71)%比较,吗啡组肿瘤细胞凋亡率(13.87±1.97)%虽有所增加,但差异无统计学意义 (P>0.05),厄洛替尼组(35.73±2.78)%和联合组肿瘤细胞凋亡率(37.17±2.39)%较对照组明显增多 (t/P=20.455/<0.001,t/P=24.954/<0.001);而厄洛替尼组与联合组肿瘤细胞凋亡率比较,差异无统计学意义(t=0.969,P=0.353),见图2、3。
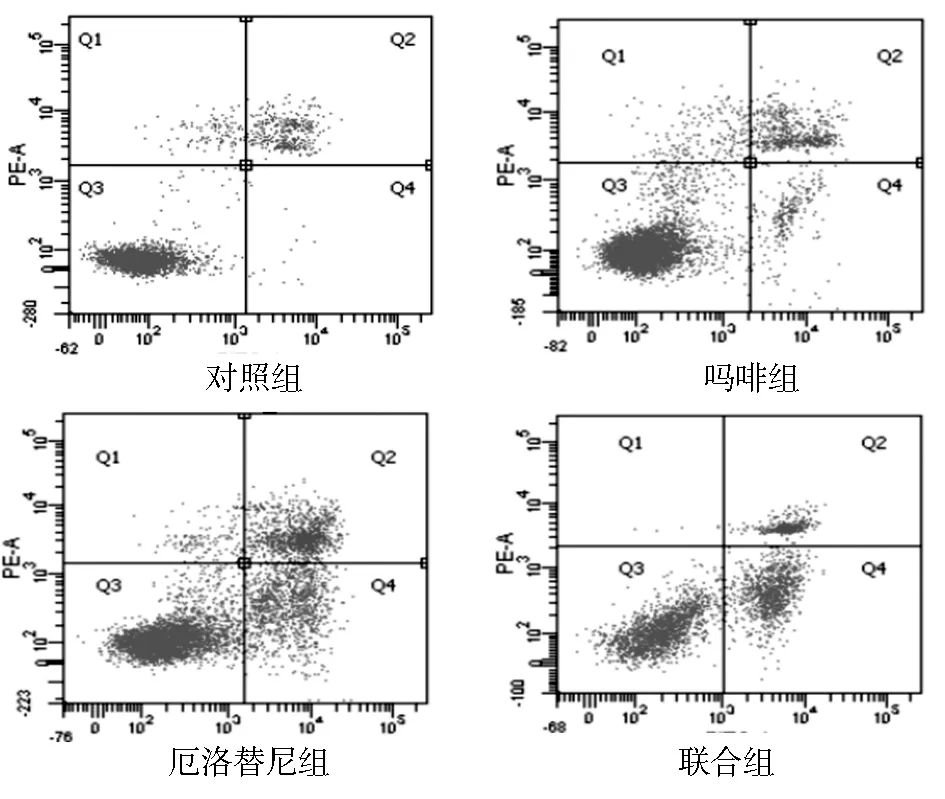
图2 FITC AnnexinⅤ/PI双染法流式细胞术各组细胞凋亡图
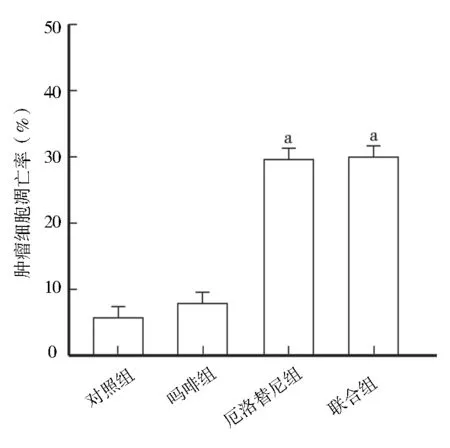
注:与对照组比较,aP<0.05
2.3 凋亡相关蛋白Bcl-2、Bax和Caspase-3的表达比较 各组凋亡相关蛋白Bcl-2、Bax和Caspase-3比较,差异有统计学意义(F=101.555、161.308、96.757,P<0.001)。与对照组比较,吗啡组Bcl-2、Bax和Caspase-3蛋白表达均无统计学意义(P>0.05),厄洛替尼组和联合组Bcl-2表达减少,Bax和Caspase-3表达增加,差异均具有统计学意义(P=0.000);厄洛替尼组与联合组比较,Bcl-2、Bax和Caspase-3的表达差异均无统计学意义(P>0.05),见图4、5。
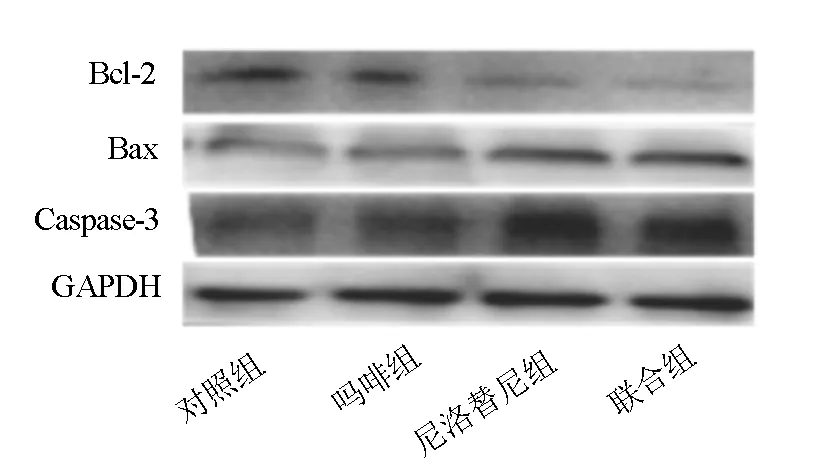
图4 各组凋亡相关蛋白的电泳图

注:与对照组比较,P<0.001
3 讨 论
随着精准医学概念的提出,EGFR基因突变的发现,EGFR-TKI类药物如厄洛替尼的研发及临床应用,为亚裔尤其是中国携带EGFR敏感突变的肺癌患者带来了更长生存时间和更好的生活质量[1-2]。肺癌目前居恶性肿瘤发病和死亡首位,5年生存率依然差强人意[6-7]。随着病情进展,大部分患者都会经历癌痛的折磨,严重影响患者的治疗和生活质量。依据“三阶梯止痛”原则,吗啡已被广泛用于肿瘤患者癌痛的治疗。但迄今为止,吗啡等阿片类药物与肿瘤细胞增殖和凋亡的具体机制仍不清楚[3-5,8]。
笔者前期研究发现,在细胞学水平吗啡、厄洛替尼以及吗啡联合厄洛替尼作用于HCC827细胞后,均可引起HCC827细胞凋亡率增加[9]。在前期实验的基础上通过建立HCC827肺腺癌细胞裸鼠成瘤模型深入地研究吗啡联合厄洛替尼对肿瘤细胞的影响及其机制。
研究发现,吗啡组肿瘤生长稍缓慢,与对照组比较差异无统计学意义。厄洛替尼组及吗啡联合厄洛替尼组肿瘤生长更为缓慢,与对照组比较肿瘤体积明显缩小,差异有统计学意义(P<0.05)。与厄洛替尼组相比吗啡联合厄洛替尼组肿瘤体积无明显差别。该结果表明吗啡联合厄洛替尼时,吗啡并未影响厄洛替尼抗肿瘤及延缓肿瘤生长的作用。
凋亡作为细胞程序性细胞死亡方式,在维持机体细胞新生及代谢平衡方面起着至关重要的作用[10-11]。为进一步研究动物水平吗啡联合厄洛替尼抗肿瘤机制,进一步应用流式细胞学技术和Western blot技术检测了细胞凋亡率和凋亡相关蛋白的表达。既往研究表明Bcl-2属于原癌基因家族,可通过抑制Caspase-3的表达发挥抗凋亡效应[12];敲除Bcl-2家族成员Bim可以引起内源性药物抵抗或者降低肿瘤细胞EGFR-TKIs的敏感性而产生耐药[13],Bax基因下调亦会导致厄洛替尼诱导细胞凋亡效应减弱[14-17]。笔者前期研究也发现吗啡作用于HCC827细胞可引起细胞凋亡率及凋亡相关蛋白Bcl-2、Bax和Caspase-3表达的变化[16]。
与对照组比较,吗啡组细胞凋亡率及凋亡相关蛋白Bcl-2、Bax、Caspase-3的表达,差异无统计学意义,与前期细胞水平结果不相一致[18]。其原因分析可能与体内体外试验因素有关,亦可能与吗啡浓度有关。刘红军等[19]研究发现,吗啡呈浓度依赖性的促进MADB-106乳腺癌细胞的凋亡。厄洛替尼组及吗啡联合厄洛替尼组细胞凋亡率明显增加,抗凋亡蛋白Bcl-2表达减少,促凋亡蛋白Bax和Caspase-3表达增加,且差异具有统计学意义(P<0.01);与厄洛替尼组比较,吗啡联合厄洛替尼组在细胞凋亡率及凋亡相关蛋白的表达无明显差别(P>0.05)。进一步说明厄洛替尼或吗啡联合厄洛替尼应用时可通过线粒体通路诱导细胞凋亡来发挥抗肿瘤效应。
吗啡在缓解疼痛的同时并不会消弱厄洛替尼的抗肿瘤作用,本研究为吗啡联合厄洛替尼治疗晚期非小细胞肺癌患者生活质量的提升提供了理论基础,为吗啡和厄洛替尼的临床应用提供实验依据。
利益冲突:无
作者贡献声明
张雅静:设计研究方案,实施研究过程,论文撰写;马骖:提出研究思路,分析实验数据;梁欢:实施研究过程,数据收集整理;相成:进行统计学分析;张燕:论文终审
