荒漠齿肋赤藓(Syntrichia caninervis)非结构性碳水化合物含量对植株脱水的响应
2019-01-18李永刚张元明
李永刚,张元明,*
1 中国科学院新疆生态与地理研究所干旱区生物地理与生物资源重点实验室, 乌鲁木齐 830000 2 中国科学院大学, 北京 100049
生物土壤结皮(Biological Soil Crusts, BSCs)是由隐花植物如蓝藻、荒漠藻、地衣、苔藓和土壤中微生物,以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,是干旱半干旱荒漠地表景观的重要组成之一[1]。生物土壤结皮对荒漠的稳定和土壤微环境的改善具有重要作用[2-3]。据生物土壤结皮的演替顺序,大致可分为藻结皮、地衣结皮和苔藓结皮,而苔藓结皮既是生物结皮演替的最高阶段也是结皮生物量的最主要贡献者,对土壤水分的维持和群落的演替的具有重要影响[4]。苔藓植物作为植物演替的先锋物种,能够在极端高、低温、干燥、强辐射等条件下生存,因此具有很强的抗胁迫特性[5]。为此,诸多研究对其在胁迫条件下的形态特征[6- 11]、生理生化特性[12- 19]、分子表达等方面做了详细研究[20- 22]。然而,对藓类植物体内的非结构性碳水化合物变化的相关研究还相对较少。
非结构性碳水化合物包括可溶性非结构性碳水化合物和不溶性非结构性碳水化合物[23],可溶性非结构性碳水化合物又包括蔗糖、葡萄糖、果糖和山梨醇等。不可溶性非结构碳水化合物主要是指淀粉[23-24]。可溶性糖是植物生长发育的主要物质,能够为植物的生长发育提供能量和中间产物;其中蔗糖是植物体内主要的运输物质,并且可以作为信号物质用来调节植物细胞内基因的表达,对细胞的代谢进行调节;果聚糖是植物营养组织主要的暂贮形式,能够短时间贮藏有机物供给营养组织;然而淀粉是植物的长期贮存物质[25]。非结构性碳水化合物既是植物光合作用的直接储存物质,也是植物生长和发育的重要调节物质,能够随环境(如水分、温度、大气、二氧化碳和土壤养分)变化而变化[26-28]。非结构性碳水化合物含量的变化极有可能是植物对环境变化产生的信号,从而调节体内基因的表达,有效的减缓环境胁迫对植物体造成的损伤,进而调节植物在环境改变时的生长发育。例如,刘香萍等[29]对紫花苜蓿的抗寒抗旱研究中发现,秋季紫花苜蓿主根内的可溶性碳水化合物的变化对抗寒性和再生率有着重要作用。许志信和白永飞[25]对草原碳水化合物的储藏部位以及对植物不同生长发育时期植物非结构性碳水化合物储存的位置和含量的变化与环境相关。对于耐旱植物非结构性碳水化合物的研究表明,耐旱植物体内非结构性碳水化合物含量的变化和环境与水分胁迫改变有关[5]。
干旱半干旱地区降水较少,且多以脉冲形式降雨[30],荒漠藓类植物易受复水-脱水循环的影响,对水分变化十分敏感的荒漠藓类植物,在形态和生理上必然会表现出一定的响应特征。然而,有关荒漠藓类植物体内非结构性碳水化合物的响应特征尚无相关报道。在古尔班通古特沙漠腹地和南缘年降雨量不同,南缘降雨量较高,苔藓植物对水分变化极为敏感,降雨量的不同对苔藓非结构性碳水化合物的影响鲜有报道。因此,我们选取古尔班通古特沙漠优势藓类植物齿肋赤藓(Syntrichiacaninervis),对其在复水后脱水48 h内齿肋赤藓非结构性碳水化合物的变化进行研究,以期了解齿肋赤藓在脉冲式降雨后非结构性碳水化合物变化规律,为深入理解荒漠藓类植物对干旱环境的适应机制提供资料。
1 材料与方法
1.1 研究区概况
研究区位于新疆准噶尔盆地中部的古尔班通古特沙漠(44°11′—46°20′ N, 84°31′—90°00′ E, 海拔300—600 m)。古尔班你通古特沙漠面积为4.88×104km2,是中国最大的固定和半固定的沙漠。该沙漠的基地是第四世纪疏松冲积物,主要有0.1—0.25 mm粒级的沙粒组成。由于受到喜马拉雅山脉的阻隔作用,来自印度洋西南季风的水汽未能进入到内陆,导致该沙漠属于典型的温带大陆性气候。年均降水量仅70—160 mm,潜在年蒸发量在2606.6 mm左右,年均温7.26℃,冬季平均气温在-16.8℃。该沙漠在冬季具有稳定的积雪覆盖,平均积雪厚度达到20 cm左右,占全年降水量的25%以上[31-32]。
该沙漠植被以白梭梭(Haloxylonpersicum) 和梭梭(Haloxylonammodendron)等小半乔木为建群种。沙丘中下部有蛇麻黄(Ephedradistachya)、淡枝沙拐枣(Calligonumleucocladum)等灌木广泛分布[33],春季融雪使得短命类短命植物及一年生草本广泛发育。此外,该沙漠地表生物土壤结皮发育良好,主要包括藻结皮,地衣结皮和苔藓结皮3种类型。藻结皮主要分布在沙垄中上部,地衣和苔藓结皮主要分布在下坡和丘间低地,尤其在蛇麻黄、沙拐枣等灌丛下发育良好[33]。古尔班通古特沙漠南缘地貌类型以南北走向的树枝状沙垄为主,表现为固定、半固定沙丘,其间广泛分布着由梭梭、生物结皮、以及其他沙生植物组成的小乔木群落,梭梭是建群种。平均气温7.19℃,极端最高气温41.5℃。多年平均降水量128.6 mm,潜在蒸发量为1746.4 mm。春夏降雨量约占总降水量的2/3,秋季干燥,冬季积雪厚度一般在20 cm以上,积雪覆盖持续100—160 d,春季的覆雪融水和春夏季的降雨是维持本区植被生存的主要水分来源[34]。古尔班通古特沙漠腹地风沙地貌类型以固定、半固定沙垄为主,沙垄顶部普遍存在10—40 m宽度不等的流动带[35],平均气温5—5.7℃,极端最高气温40℃以上, 极端最低气温小于-40℃,年降雨量70—160 mm,年蒸发量2000—2800 mm,冬季稳定积雪厚度在20 cm左右。沙漠腹地较沙漠南缘更为干旱。沙漠南缘齿肋赤藓盖度较高于腹地。
1.2 研究对象
齿肋赤藓(S.caninervis)是古尔班通古特沙漠苔藓结皮的优势种,属于丛藓科赤藓属,具有良好的耐旱性和变水性。在高温干燥的情况下,通常失水并呈现出黑色或黑褐色,处于休眠状态。复水后快速变为绿色,并在短时间内恢复光合作用[36]。
1.3 样品的采集及处理
样品采集于古尔班通古特沙漠腹地(45°24′N,87°31′E,海拔478 m)和南缘(44°36′N,88°15′E,海拔478 m)两个区域,在区域内随机选择发育良好的齿肋赤藓结皮,用自制PVC管(内径10 cm,高5 cm)垂直插入沙土中,小心取得未扰动的苔藓结皮样品,每个区域取40个,封底后迅速运至实验室。由于6 mm和10 mm降雨后苔藓含水量无差异,且6 mm降雨时苔藓光合色素含量最高,能够恢复其生理活性[36-37],因此齿肋赤藓复水时加入6 mm降雨量的蒸馏水,通过PVC管的面积大小计算每个PVC管中应加入蒸馏水的量为47.1 mL(计算公式: PVC管的面积A=πr2,降雨量:V=A×h,r=5 cm,h=0.6 cm,计算后V=47.1,即47.1 mL)。用小型喷壶向PVC管中的齿肋赤藓表面喷洒47.1 mL的蒸馏水。为研究齿肋赤藓在脱水过程中不同时间的非结构碳水化合物含量的变化,以0 h(喷水前)为对照,在喷水后1、2、4、8、16、24 h和48 h进行取样,每个处理取5个重复。在不同时间节点,用刀片快速切取苔藓茎叶样品,过筛3次以去除样品中夹杂的沙粒,称取150 mg鲜重(0.0001 g精度天平)样品,用锡箔纸包裹后用液氮快速冷冻,然后放置于-80℃冰箱备用。
1.4 含水量的测定
分别对齿肋赤藓复水前(0 h)和脱水不同阶段(1、2、4、8、16、24 h和48 h)的含水量进行测定,并在不同时间点称取0.5 g地上部分鲜样,将称好的鲜样放进烘箱先105℃杀青,然后65℃下48 h烘干、称干重,含水量=(鲜重-干重)/鲜重。
1.5 非结构性碳水化合物的测定
样品的非结构性碳水化合物测定参照上海植物生理学会(1985)著《植物生理实验手册》。将样品用粉碎机粉碎,加7 mL 70%乙醇提取10 min,4℃下8000g离心10 min,收集上清液于100 mL容量瓶中,反复3次,合并上清液,用70%乙醇定容,即为可溶性糖提取液。
1.5.1 可溶性总糖含量测定
取1 mL可溶性糖提取液,加入5 mL蒽酮试剂,90℃水浴锅中反应15 min,待冷却后于620 nm下读取吸光度值[38]。根据标准曲线可以计算其浓度,为保证不同含水量间浓度的比较,文中浓度均计算为mg/g干重。
1.5.2 蔗糖含量测定
取1 mL可溶性糖提取液,加入7.6 mol/L KOH 0.1 mL,沸水浴10 min,冷却后加入5 mL蒽酮试剂,90℃保温15 min,待冷却后于620 nm下读取吸光度值[36]。根据标准曲线可以计算其浓度。
1.5.3 果糖含量测定
取1 mL可溶性糖提取液,加入5 mL蒽酮试剂,25℃反应90 min后,于620 nm下比色,根据果糖标准曲线,计算植物组织提取液中的果糖含量。
1.5.4 淀粉含量的测定
采用高氯酸法,用上述离心后的沉淀物测定植物样品中的淀粉含量,沉淀物加入30% (v/v)的高氯酸8.5 mL,静置过夜,然后于80℃水浴中提取10 min,冷却,4000 r/min离心10 min,取上清液定容到100 mL的容量瓶中,取1 mL提取液,于620 nm下测量吸光度值。
1.6 数据处理
利用SPSS 22.0对所测得的数据进行正态性和方差齐性检验,并对不同时间点的齿肋赤藓可溶性总糖、蔗糖、果糖和淀粉等含量进行单因素方差分析和多重比较,用ORIGIN 9.0作图。
2 结果分析
2.1 脱水过程中齿肋赤藓含水量随时间的变化特征

图1 复水后齿肋赤藓含水量随时间的变化 Fig.1 Changes of water content in S. caninervis shoots after rehydration
由图1可知,植株含水量在复水后1 h内急剧上升并达到最大,采自不同区域的苔藓植株含水量分别从0.0635 mg/g和0.0645 mg/g上升到0.5112 mg/g和0.6023 mg/g。随后在1到2 h呈现加速下降趋势,下降速度分别为0.0617 mg g-1h-1和0.0793 mg g-1h-1,随后在2—24 h之间含水量继续缓慢下降,下降速率分别为0.0158 mg g-1h-1和0.0185 mg g-1h-1。不同区域对脱水过程植物含水量具有相似变化,脱水1、2、4、8 h和16 h与复水前相比差异极显著(P<0.01),脱水24 h与复水前差异显著(P<0.05),脱水48 h后与复水前含水量无差异(P=0.426)。复水前不同区域齿肋赤藓植物含水量无差异,复水后在最大含水量时出现极显著性 (P<0.05) 差异,在脱水48 h后含水量在不同区域上无显著差异。
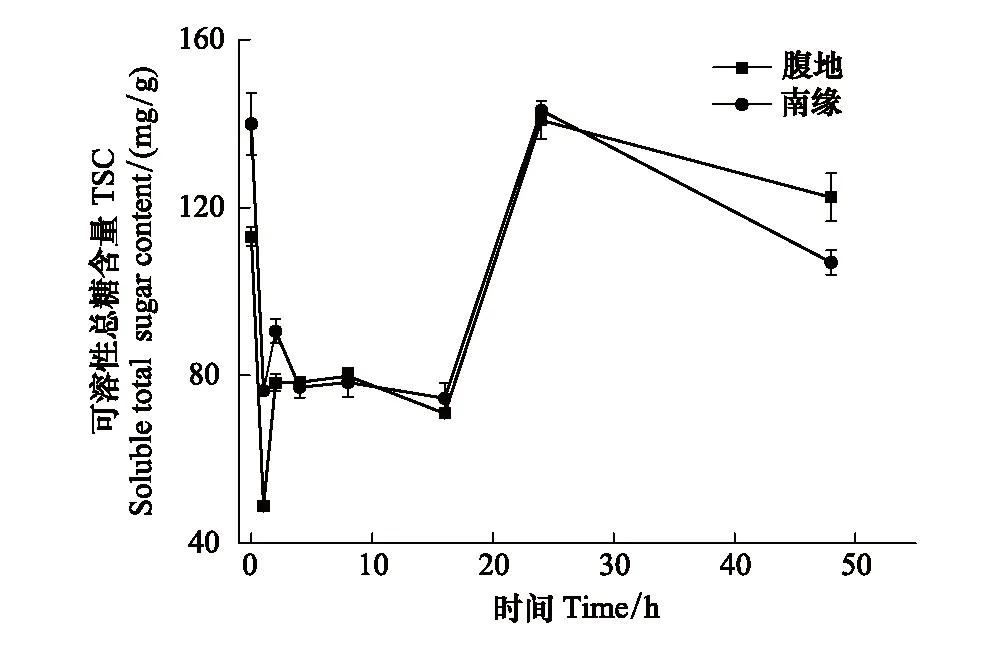
图2 可溶性糖随脱水时间的变化Fig.2 The TSC changes with time after the rain
2.2 脱水过程中齿肋赤藓植株可溶性总糖、蔗糖和果糖的变化特征
脱水过程不同区域齿肋赤藓植株可溶性总糖含量随时间呈现下降、稳定、上升、下降四个阶段的变化。复水后1 h齿肋赤藓植株含水量达到最大值(图1),从图2中可知,在复水后1 h内齿肋赤藓可溶性总糖含量快速下降,腹地和南缘的齿肋赤藓可溶性总糖含量下降速率分别为64.275 mg g-1h-1和63.573 mg g-1h-1;其中腹地的齿肋赤藓可溶性总糖含量下降到最低值,南缘的齿肋赤藓可溶性总糖含量下降未达到整个脱水过程的最低值,且两个地区齿肋赤藓可溶性总糖含量存在显著性差异(P<0.05)。不同区域的齿肋赤藓蔗糖与果糖含量的变化趋势与可溶性总糖相似,腹地中齿肋赤藓植株蔗糖和果糖含量达到最小值,南缘齿肋赤藓植株蔗糖和果糖含量未达到最小值,且蔗糖和果糖含量分别在不同区域之间存在显著的差异(图3,图4)。
脱水过程中随着含水量的逐渐降低,在2—16 h期间,沙漠腹地齿肋赤藓在2—8 h无显著变化,在8—16 h可溶性总糖含量出现下降趋势,脱水8 h与16 h时齿肋赤藓植株可溶性总糖含量出现显著性差异(P<0.05),沙漠南缘齿肋赤藓可溶性糖含量在2—4 h有下降的趋势,脱水2 h与4 h齿肋赤藓植株可溶性总糖含量存在显著性差异,4 h后趋于稳定,且在脱水16 h时可溶性糖含量达到最小值。然而在脱水2—16 h期间不同区域齿肋赤藓蔗糖和果糖含量也出现不同的变化趋势,其中沙漠腹地齿肋赤藓蔗糖含量出现先降低后稳定的变化,果糖含量表现出先升高后降低的趋势,沙漠南缘齿肋赤藓蔗糖含量变化趋势与沙漠腹地不同,表现出先降低再升高最后趋于稳定,且在脱水4 h时达到蔗糖含量的最低值,果糖含量与腹地齿肋赤藓果糖含量变化趋势相反,出现先降低后稳定,且在脱水16 h时果糖含量达到最低值。
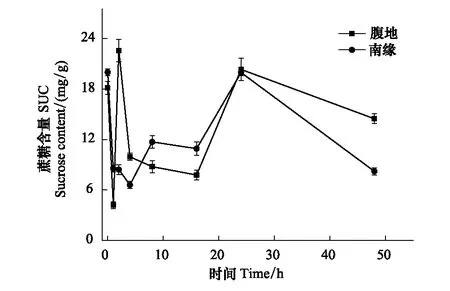
图3 蔗糖含量随脱水时间的变化Fig.3 The SUC changes with time

图4 果糖含量随脱水时间的变化Fig.4 The FC changes with time
脱水16 h,沙漠腹地和南缘齿肋赤藓含水量分别下降到22.83%和23.35%。此后,在脱水16—24 h期间不同区域齿肋赤藓可溶性总糖含量出现极显著上升,腹地和南缘齿肋赤藓可溶性总糖含量的上升速率分别是8.729 mg g-1h-1和8.36 mg g-1h-1,脱水24 h时齿肋赤藓可溶性总糖,蔗糖含量在两个区域无显著差异(P=0.651),但果糖含量在两个区域之间存在显著的差异(P<0.05)。
脱水24 h,齿肋赤藓含水量分别下降到10%和11%,脱水48 h后不同区域齿肋赤藓含水量与复水前含水量无差异(腹地P=0.672和南缘P=0.426),脱水24—48 h齿肋赤藓可溶性总糖含量再次缓慢下降,速率分别是0.67 mg g-1h-1和1.46 mg g-1h-1(图2)。下降后齿肋赤藓可溶性总糖和蔗糖含量在腹地和南缘两个地区间存在显著的不同(P<0.05),南缘齿肋赤藓含量在脱水结束后可溶性总糖,蔗糖,果糖含量显著低于复水前它们的含量。果糖的含量在不同区域之间存在极显著的差异(P<0.01)。在含水量最高的时候蔗糖含量达到最低值,随后再2—16 h趋于稳定状态,16—24 h出现较为迅速的积累,24—48 h出现最为缓慢的下降。
2.3 脱水过程中淀粉在齿肋赤藓植株中淀粉含量的变化特征。
从图5中我们可以看出两地点的苔藓的淀粉含量的变化趋势完全相同,复水前不同区域齿肋赤藓淀粉含量存在显著性差异,在复水后1 h内淀粉含量出现极显著的下降,下降速率分别为腹地和南缘分别为37.859 mg g-1h-1和55.305 mg g-1h-1,此时两个区域齿肋赤藓淀粉含量达到最小值;脱水2 h时淀粉含量显著增加,随后在脱水2—16 h期间淀粉含量缓慢降低,腹地和南缘下降速度分别为1.55 mg g-1h-1和1.75 mg g-1h-1;脱水16—24 h淀粉含量显著增加,增长速率分别是腹地5.24 mg g-1h-1和南缘7.63 mg g-1h-1,且在24 h时淀粉含量达到最高;在24—48 h,沙漠腹地齿肋赤藓淀粉含量趋于稳定,沙漠南缘齿肋赤藓含量出现缓慢的下降,下降速率为1.22 mg g-1h-1,在脱水24 h和48 h 之间存在显著性差异。在脱水48 h后齿肋赤藓的淀粉含量在南缘仍显著高于腹地。脱水过程中南缘齿肋赤藓淀粉含量在各个时段都显著高于腹地齿肋赤藓淀粉含量。
2.4 脱水过程中齿肋赤藓植株非结构性碳水化合物含量的变化特征。
非结构性碳水化合物包括淀粉和可溶性糖,脱水过程中非结构性碳水化合物的变化趋势与淀粉相似。如图6所示脱水1 h非结构性碳水化合物含量出现极显著降低,腹地和南缘的下降速率分别为102.13 mg g-1h-1和118.88 mg g-1h-1,两个区域的齿肋赤藓非结构性碳水化合物含量下降至最低;在脱水1—2 h齿肋赤藓植株非结构性碳水化合物含量显著的增加,增加速率分别为腹地73.825 mg g-1h-1和南缘60.545 mg g-1h-1;2—16 h处于稳定阶段;16—24 h出现显著的增加,腹地和南缘增加速率分别为13.94 mg g-1h-1和15.99 mg g-1h-1,在24 h非结构性碳水化合物含量达到最高;24—48 h非结构性碳水化合物缓慢下降,腹地和南缘的下降速率分别为1.34 mg g-1h-1和2.69 mg g-1h-1。在脱水48 h期间,沙漠南缘的齿肋赤藓非结构性碳水化合物含量显著高于腹地。
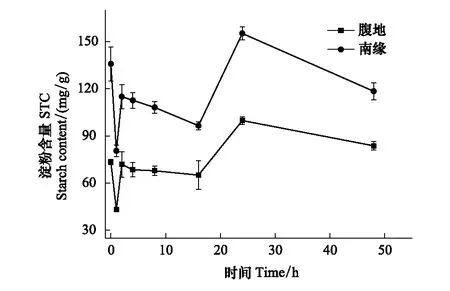
图5 淀粉含量随脱水时间的变化Fig.5 The STC changes with time
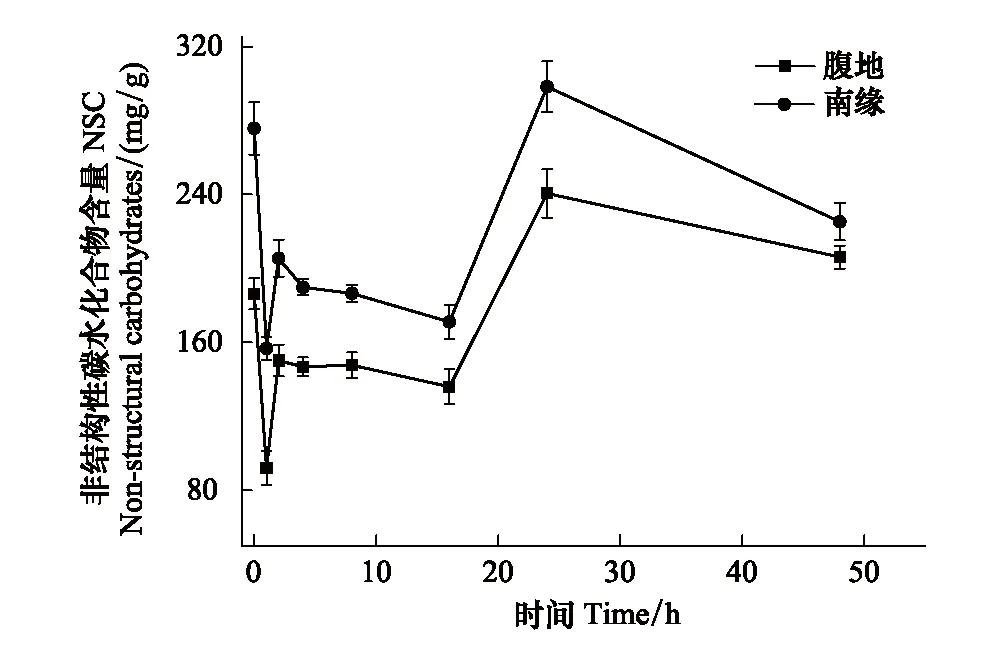
图6 非结构性碳水化合物随时间的变化 Fig.6 The changes in Non-structural carbohydrates with time increase
3 讨论
3.1 脱水过程中齿肋赤藓非结构性碳水化合物变化与水分胁迫的关系
高等植物碳水化合物代谢对干旱胁迫十分敏感,水分的胁迫会直接影响植物碳水化合物代谢,从而引起植物生长和代谢的改变[39]。齿肋赤藓复水前处于休眠状态,休眠期齿肋赤藓具有较高的非结构性碳水化合物含量,能为复水后齿肋赤藓的生长提供碳源,而且能为植物光合作用不足时起到缓冲作用,这与Hoch对森林生态系统树木的研究结果相似[40]。复水后齿肋赤藓迅速恢复活性,非结构性碳水化合物迅速作为碳源供齿肋赤藓生长和代谢,非结构性碳水化合物转化为代谢物质供齿肋赤藓的生长,降低非结构性碳水化合物含量维持细胞吸水调节光合作用。脱水过程后期齿肋赤藓受到干旱胁迫时,非结构性碳水化合物含量迅速增加,这一现象与小麦受到干旱胁迫,小麦叶片细胞可溶性糖迅速积累,维持渗透压、降低水势、减少叶片水相似[41-42]。齿肋赤藓在受到干旱胁迫时过河作用降低,可溶性糖和淀粉的含量明显上升,用于提高齿肋赤藓渗透压以及储存碳源,随着脱水过程的持续,齿肋赤藓将受到极端干旱的胁迫,与维管植物不同齿肋赤藓可以直接进入休眠状态,维持较高的可溶性糖和淀粉的含量[43]。
3.2 脱水过程中齿肋赤藓非结构性碳水化合物的积累与光合作用的关系
前期研究发现齿肋赤藓在干旱情况下,往往处于休眠状态,叶片背卷,紧贴于茎,呈黑褐色;当环境中有可利用的水分时,齿肋赤藓能够快速恢复其细胞膜的选择吸收功能,迅速吸水展开叶片,恢复其正常的生理代谢功能。藓类植物能够在30—90 s内完成复水过程,数分钟内激活其光合活性[44-45]。我们研究发现齿肋赤藓在复水1 h后含水量达到最大值,且蔗糖、果糖、淀粉含量出现极显著的下降,说明齿肋赤藓非结构性碳水化合物的积累不在脱水早期。复水后光合作用能在40 min中内恢复到原来的90%以上,在光合作用未完全恢复时,呼吸消耗大量碳水化合物,保证其正常代谢功能。含水量在20%—70%之间,暗呼吸随水分含量的下降而下降,并且一般认为呼吸速率恢复快于净光合速率[45-46]。在1—16 h蔗糖果糖含量上升后处于一个相对稳定非结构性碳水化合物含量。1—2 h藓类植物随着光合作用的恢复,产生大量糖等有机物,此时可溶性糖和淀粉的含量增加。随后可溶性总糖和淀粉含量处于相对稳定时期。随着脱水过程光合色素含量在脱水2 h后迅速增加,脱水6 h达到最大,脱水10 h至完全干燥时,光合色素含量缓慢降低[47-48],同时含水量在20%—70%之间,光合作用不断减弱,呼吸作用和光合作用变化趋势相似,也呈现下降趋势[49]。光合作用和呼吸作用同时下降可能导致可溶性糖和淀粉的含量处于相对稳定的状态。在16 h后可溶性总糖和淀粉出现显著性积累,然后缓慢降低,表明齿肋赤藓非结构性碳水化合物的积累主要发生在16 h至24 h之间,16 h时齿肋赤藓含水量下降到20%,齿肋赤藓受到干旱胁迫,非结构性碳水化合物含量增加。国春晖[50]研究也发现脱水过程中刺叶赤藓叶片可溶性糖持续积累,脱水24 h 时叶片可溶性糖含量已接近未脱水时的4倍。非结构性碳水化合物是植物典型的渗透调节物质,非结构化合物含量的改变可以直接影响植物渗透调节。植物细胞通过渗透调节能增加细胞溶质浓度,降低渗透势,保持膨压,缓和脱水胁迫,有助于光合作用、气孔运动和细胞生长等生理过程正常进行[51-53]。徐杰等[54]也认为藓类植物体内可溶性糖含量能够对干旱胁迫产生应激反应,它能有效地保护细胞膜和蛋白质的结构,使生物体在许多异常情况下,如高温、脱水、冷冻时仍保持细胞内湿润,防止细胞因失水而造成细胞内养分的损失和细胞损伤,从而使这些生物具有较强的抗旱、抗寒的能力。在24 h后齿肋赤藓非结构性碳水化合物出现缓慢的下降,主要因为齿肋赤藓受到严重的干旱胁迫,光合作用降低,部分非结构性碳水化合物转化为保护蛋白和酶以适应对干旱的胁迫的响应。同时,可溶性总糖作为渗透调节物质抵御齿肋赤藓受到干旱胁迫,并维持植物细胞的完整性。齿肋赤藓在脱水过程中光合作用的恢复与光合产物的积累不是同步进行,光合产物的积累显著迟于光合作用的恢复。这种机制的发生可能存在以下原因:(1)复水后光合作用的恢复较呼吸作用慢,复水后齿肋赤藓恢复生理特性,需要消耗大量储存的非结构性碳水化合物;(2)含水量在20%以上,齿肋赤藓未受到干旱胁迫时,随含水量的降低光合和呼吸作用都呈现下降,光合产物部分被呼吸作用消耗,部分可以转化为结构性物质,有助于齿肋赤藓的生长;(3)含水量下降至20%后,齿肋赤藓受到干旱胁迫后,呼吸作用消耗部分光合产物,光合产物不再向结构性物质转化,光合产物大量积累;(4)含水量持续下降至复水前水平,齿肋赤藓受到严重的干旱胁迫,为适应胁迫,需将部分非结构性碳水化合物转化为防止膜损伤和细胞器损伤的物质。
3.3 不同区域齿肋赤藓非结构性碳水化合物的含量
脱水过程中两个区域的齿肋赤藓非结构性碳水化合物含量的变化趋势相似。复水前、复水后和脱水过程中沙漠南缘齿肋赤藓植株淀粉含量显著高于沙漠腹地。齿肋赤藓非结构性碳水化合物含量与淀粉含量相似,沙漠南缘的齿肋赤藓非结构性碳水化合物含量显著高于沙漠腹地。结果说明不同地区齿肋赤藓非结构性碳水化合物含量显著不同。沙漠腹地和沙漠南缘其土壤含水量的研究发现土壤表层含水量较低[55-57],齿肋赤藓主要在土壤表面,没有维管组织和根,因此齿肋赤藓的生长主要受到降雨的影响。沙漠腹地降水的年、月、季的分布与沙漠周边地区基本一致,10年的平均降水量123.4 mm,比沙漠周边同期平均降水量偏少32.3%[58]。南缘的非结构性碳水化合物含量显著高于沙漠腹地,可能由于降雨量在沙漠南缘高于沙漠腹地,齿肋赤藓具有较好的生长,同时具有较高的非结构性碳水化合物来含量抵御高频次的小降雨事件。复水前沙漠南缘可溶性总糖、蔗糖和果糖含量高于沙漠腹地,经过复水后的脱水过程沙漠南缘齿肋赤藓可溶性总糖、蔗糖和果糖含量低于沙漠腹地。说明两个地区的齿肋赤藓可溶性糖对相同复水条件的脱水过程响应不同。沙漠腹地降雨量低,对干旱胁迫具有较强的适应能力,因此在脱水结束后中沙漠腹地的可溶性糖含量与复水前无差异。这与干旱胁迫后,抗旱性强的小麦比抗旱性弱的小麦能保持较高的可溶性总糖含量,有较强的光合及干物质积累能力[42,59-60]。淀粉含量在两个地区保持相对稳定复水前和脱水后没有显著的变化,主要由于淀粉作为能量储存物质,在受到干旱胁迫后,植物会积累大量的淀粉含量,为进入休眠和再恢复生长和代谢提供物质能量基础[43]。然而非结构性碳水化合物含量的变化表现出复水前南缘齿肋赤藓非结构性碳水化合物含量显著高于腹地齿肋赤藓,脱水过程结束后则表现为两个地区齿肋赤藓非结构性碳水化合物含量无显著性差异,主要由于南缘齿肋赤藓可溶性总糖含量出现明显的下降。因此不同地区齿肋赤藓非结构性碳水化合物的显著差异和对脱水过程响应的显著不同,可能是齿肋赤藓对环境因素的长期适应的结果。
4 结论
(1)齿肋赤藓复水后,非结构性碳水化合物在脱水过程中主要出现4个阶段:1 h内非结构性碳水化合物含量显著降低,2—16 h非结构性碳水化合物含量没有显著变化,16—24 h非结构碳水化合物含量显著增加,24—48 h非结构性碳水化合物含量缓慢下降至复水前水平。
(2)古尔班通古特沙漠南缘齿肋赤藓非结构性碳水化合物含量显著高于沙漠腹地。古尔班通古特沙漠不同区域齿肋赤藓非结构碳水化合物含量显著不同。
(3)古尔班通古特沙漠腹地与南缘齿肋赤藓的非结构性碳水化合物对脱水过程具有不同的响应,主要表现在两个地区齿肋赤藓可溶性糖含量变化的显著不同。
致谢:感谢尹本丰博士和朱秉坚博士对野外采样和室内测定非结构性碳水化合物含量实验的帮助。
