新橙皮苷对破骨细胞分化影响的实验研究▲
2019-01-18程建文李晓峰
谭 桢 张 丹 程建文 李晓峰
(1 广西医科大学第二附属医院骨科,南宁市 530007;2 广西医科大学第一附属医院麻醉科,南宁市 530021;3 广西医科大学第一附属医院创伤骨科手外科,南宁市 530021)
骨重建包括骨形成和骨吸收两种相互平衡的过程,分别由成骨细胞和破骨细胞调控[1]。破骨细胞的过度作用导致骨吸收增多,打破骨形成和骨吸收的平衡,将引起如骨质疏松症等疾病,破骨细胞在这类疾病中的作用非常关键[2]。
骨保护素/核因子-κB受体活化因子配体/核因子-κB受体活化因子(OPG/RANKL/RANK)通路与破骨细胞的形成和分化密切相关[3],通过RANKL/RANK信号的刺激,促进破骨细胞分化[4]。有研究表明,柚皮苷具有抑制破骨细胞分化及抗骨质疏松的作用[5]。新橙皮苷是一种枳实提取物,与柚皮苷均为黄酮类化合物[6],具有保护心血管系统、抗肿瘤及抗炎等作用[7]。但有关新橙皮苷对破骨细胞作用的研究仍较少。我们通过体外实验发现,不同浓度的新橙皮苷对破骨细胞的凋亡率及活力无影响,但是能抑制破骨细胞的分化,且具有时间依赖性。现将结果报告如下。
1 材料与方法
1.1 材料与试剂 α-MEM液和胎牛血清购自澳大利亚TRACE公司,GST-rRANKL购自澳大利亚西澳大学分子生物学实验室,新橙皮苷(纯度>98%)购自成都曼思特生物科技有限公司。
1.2 破骨细胞凋亡实验 将RAW264.7细胞种植至含有胞分化培养基的6孔培养板内,细胞培养过夜。第二天更换培养基,将不同浓度的新橙皮苷加入培养孔中,浓度分别为0 μM、1 μM、2.5 μM、5 μM、10 μM和20 μM,孵育细胞24 h。用PBS洗涤两次后收集细胞,用0.5 mL Annexin V Binding缓冲液重悬细胞以及Annexin V-PE液染色细胞悬浮液。在室温暗室继续孵育细胞15 min,最后加入Binding缓冲液,通过流式细胞仪进行分析并获得健康细胞率、细胞死亡率以及细胞凋亡率。
1.3 破骨细胞活力的测定 将小鼠骨髓巨噬细胞以6×103个/孔的密度种植入含有细胞分化培养基的96孔培养板,分5组,每组3个孔。加入RANKL培养过夜,加入不同浓度的新橙皮苷(0 μM、2.5 μM、5 μM、10 μM、20 μM),继续培养48 h。吸取20 μL CellTiter 96®试剂,分别加入96孔培养板的每个细胞样本孔中。在37℃下继续培养2 h后,用ELISA检测仪测量样本在490 nm的光吸收值,以新橙皮苷浓度为横坐标,吸光值为纵坐标绘制直方图。
1.4 破骨细胞生成抑制时间依赖性实验 将小鼠骨髓巨噬细胞分为对照组和实验组,对照组为D0组(NE-),实验组第0天为D0组(NE+),第1天为D1组(NE+),第3天为D3组(NE+),第5天为D5组(NE+),第7天为D7组(NE+),每组3个孔。将骨髓巨噬细胞以6×103个/孔种植入96孔培养板,分别于第0、1、3、5、7天给D0组(NE+)、D1组(NE+)、D3组(NE+)、D5组(NE+)、D7组(NE+)加入新橙皮苷10 μM。对照组D0组(NE-)从第0天开始只加入RANKL培养,不加入新橙皮苷。第8天,将各组作TRAP染色。在光学显微镜下计数破骨细胞,将细胞核≥3个的细胞归类为破骨细胞,并对TRAP染色阳性的破骨细胞拍照。
1.5 统计学方法 采用SSPS 18.0统计学软件包进行数据分析。实验组与各自的对照组进行两两比较,计量资料以均数±标准差( x±s)表示,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 破骨细胞凋亡情况 散点图结果显示各组健康细胞率分别为94.9%、91.4%、92%、93.9%、91.8%、93.2%,坏死率分别为4.5%、8.1%、7.4%、5.7%、7.8%、6.4%,凋亡率分别为0.6%、0.5%、0.5%、0.5%、0.4%、0.4%。随着新橙皮苷浓度的增加,各组健康细胞率均保持于90%以上的高水平,而坏死率和凋亡率均维持在低水平(图1A、B)。

A.破骨细胞凋亡散点图

B.各类细胞状况
图1 破骨细胞凋亡实验。A.用RANKL诱导RAW264.7细胞,同时加入各浓度新橙皮苷,培养24 h后用Annexin V-PE 液染色细胞,进行流式细胞仪分析。B.经过不同浓度新橙皮苷处理的RAW264.7细胞,凋亡率均低于1%,而健康细胞率均高于90%。
2.2 新橙皮苷对破骨细胞活力的影响 各组吸收值比较,差异无统计学意义(P>0.05)。以0 μM组为对照,各浓度组药物对细胞活力均无影响(P>0.05)。见图2。

图2 新橙皮苷对破骨细胞活力的影响
2.3 破骨细胞生成抑制时间依赖性实验 结果显示D0组(NE-)形成的破骨细胞数平均为87.3个,D0组(NE+)为82.7个,D1组(NE+)为74个,D3组(NE+)61.3个,D5组(NE+)61.7个,D7组(NE+)64.3个。第1、3、5、7天加入10 μM的新橙皮苷均对破骨细胞形成有抑制作用(P<0.01),其中第5天加入的新橙皮苷对破骨细胞形成抑制作用最为显著(P<0.001)(图3)。
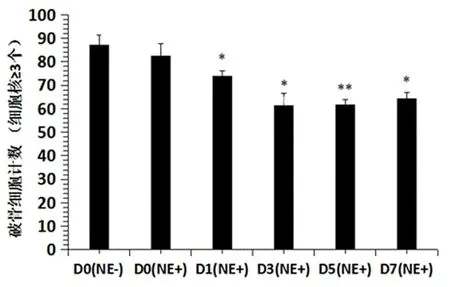
图3 破骨细胞生成抑制时间依赖性实验
3 讨 论
骨质疏松是一种“沉默的疾病”,往往到发生骨折时才被发现[8]。中草药治疗骨骼疾病的历史悠久,它能促进骨折愈合,而且安全性比化学药品更高[9-11],是目前治疗骨质疏松的研究热点之一。
枳实是常见的中药,可提取出各种黄酮类化合物[6],如柚皮芸香苷(narirutin)、柚皮苷(naringin)、橘皮苷(hesperidin)、析圣草枸橼苷(neoeriocitrin)和新橙皮苷(neohesperidin)。黄酮类化合物具有天然的抗氧化特性,能保护心血管系统、抗肿瘤及抗炎等[12-16]。柚皮苷已被证实在骨质疏松治疗方面有独特优势[5,17]。
本实验旨在研究新橙皮苷对破骨细胞分化的影响,探讨其潜在的骨质疏松治疗作用。目前常用的破骨细胞前体细胞是骨髓巨噬细胞和RAW264.7细胞[18-20]。BMM容易贴壁[21],不易制成细胞悬液,而RAW264.7细胞克隆表达RANK mRNA,能稳定地保留RANKL诱导破骨细胞的遗传特性和表型,基因表达与骨髓巨噬相似,且能制成细胞悬液,非常适合用来研究破骨细胞的分化[22]。因此在使用流式细胞仪检测细胞凋亡率实验中,我们采用RAW264.7细胞。结果表明,加入不同浓度新橙皮苷后,健康细胞率均在90%以上,而凋亡率始终维持在低水平。
为了进一步检测新橙皮苷的安全性,我们进行了细胞活力实验。目前常用的细胞活力实验有MTT和MTS法[23],而MTS形成的甲瓒产物可溶于水,毒性更少[24],而且较μTT步骤简单。因此,我们采用MTS法进行检测,结果显示不同浓度的新橙皮苷对小鼠骨髓巨噬细胞分化的破骨细胞活力无明显影响。
目前对破骨细胞分化的信号通路已有共识,其中RANKL/RANK信号通路是影响破骨细胞分化的主要通路。RANK属于TNF家族受体,RANKL激活RANK后,使下游一系列蛋白产生级联反应,包括IκB、NF-κB、ERK和cJun/AP-1,促进破骨细胞增殖和分化[25-26]。RANKL/RANK信号通路在调控生理性骨吸收的同时,也能调控病理性骨吸收[27]。
在骨破坏性疾病如骨质疏松症发病机制中破骨细胞过度的骨吸收起关键作用。因此,抑制破骨细胞的形成或活性可以作为治疗骨质疏松症的一个途径。可以通过抑制破骨细胞前体细胞分化为TRAP阳性多核巨细胞,抑制细胞骨架、细胞功能形成和影响成熟破骨细胞生存等多方面进行干预[28]。
在破骨细胞生成抑制时间依赖性实验中,于各时间点在小鼠骨髓巨噬细胞中加入RANKL及10 μM新橙皮苷进行分化诱导。结果显示新橙皮苷对RANKL诱导的破骨细胞形成具有时间依赖性抑制作用,提示新橙皮苷影响RANKL/RANK信号通路,抑制下游一系列蛋白级联反应,从而抑制破骨细胞分化。
综上所述,新橙皮苷能很好地抑制破骨细胞的分化,同时对细胞凋亡及细胞活力无明显影响,为进一步探讨影响破骨细胞分化机制的实验研究以及寻找安全有效的抗骨质疏松药物的研究奠定基础。
