叶绿体巯基亚硝基化修饰蛋白质组学研究进展
2019-01-14董美辰喻娟娟戴绍军
董美辰, 喻娟娟,2, 秦 智, 戴绍军*
(1.上海师范大学 生命科学学院 植物种质资源开发协同创新中心,上海 200234;2.东北林业大学 盐碱地生物资源环境研究中心,黑龙江 哈尔滨 150040)
一氧化氮(NO)是动植物体内的重要信号分子,可调控多种信号转导和代谢途径[1].在胁迫条件下,植物内会快速产生大量的NO.低浓度NO可作为植物抗胁迫和病原体防御的重要信号分子,调节时间依赖性应激反应,而高浓度NO可生成活性氮分子(RNS)引起亚硝化胁迫[2].
蛋白质巯基亚硝基化(S-nitrosylation)是一种不依赖于环磷酸鸟苷(cGMP)的NO信号转导途径,即NO分子与蛋白质半胱氨酸(Cys)残基共价结合形成S-亚硝基硫醇(-SNO)的过程.大量研究证实S-亚硝基化修饰可影响酶活性,改变蛋白质结构,影响蛋白质定位,调节蛋白质-蛋白质相互作用,从而调节植物多种生理和病理过程[3].
目前,生物素置换法(BST)和液相色谱串联质谱法为高通量鉴定S-亚硝基化蛋白提供了很好的平台(表1)[4-11].生物素置换法可通过三步流程将S-亚硝基化蛋白质的NO部分替换为生物素标签.首先采用S-硫代甲基化试剂MMTS(S-methyl-methanethiosulfonate)封闭蛋白质的还原型自由巯基(-SH),随后采用抗坏血酸选择性还原-SNO形成-SH,再采用巯基特异性生物素标记试剂标记新还原的-SH,例如生物素-HPDP(N-[6-(biotinamido) hexyl]-3′-(2′-pyridyldithio) propionamide).最后利用抗生物素蛋白对生物素化蛋白进行富集和纯化,结合质谱分析实现S-亚硝基化蛋白的鉴定[12].以该方法为基础,又相继衍生出多种鉴定S-亚硝基化蛋白的新技术.结合生物素置换法和同位素亲和标签(ICAT)技术可实现S-亚硝基化蛋白与修饰位点的鉴定,并且可在同一次实验中定量不同样品中同一蛋白质的S-亚硝基化水平[13-14].在该方法中,在通过抗坏血酸还原-SNO得到-SH之后,分别用重试剂(ICAT-H)和轻试剂(ICAT-L)标记处理样品与对照样品,经胰蛋白酶酶切消化后,利用抗生物素蛋白对生物素化蛋白进行富集和纯化,结合质谱分析实现对同位素标记的多肽进行鉴定,同时可以根据轻重ICAT标签的信号强度对S-亚硝基化水平进行定量.
目前,研究者们应用S-亚硝基化蛋白质组学方法对拟南芥(Arabidopsisthaliana)[9,11,13-14]、水稻(Oryzasativa)[8]、小麦(Triticumaestivum)[6]、马铃薯(Solanumtuberosum)[7]、酸橙(Citrusaurantium)[15]、芥菜(Brassicajuncea)[4]和落地生根(Kalanchoepinnata)的叶片或幼苗应答各种胁迫处理(包括S-亚硝基谷胱甘肽(GSNO,细胞内NO的主要存在形式)、H2O2、低温、盐和干旱胁迫)的S-亚硝基化蛋白质进行了分析(表1).这些研究鉴定了植物中495种S-亚硝基化蛋白质,其中包括173种叶绿体蛋白质,叶绿体S-亚硝基化修饰蛋白质数量占植物S-亚硝基化修饰蛋白质数量的34.9%.叶绿体是植物光合作用的重要场所,也参与多种代谢物质的合成,包括氮和硫同化,以及多种代谢物(氨基酸、脂质、激素、叶绿素和类胡萝卜素、嘌呤和嘧啶)的合成.由于叶绿体快速变化的氧化还原环境导致容易积累RNS,从而引起蛋白质S-亚硝基化发生.在蛋白质组学水平认识S-亚硝基化修饰在植物叶绿体中的作用对于揭示叶绿体信号转导与代谢网络具有重要意义.
1 S-亚硝基化调节光合放氧与电子传递
蛋白质S-亚硝基化可调节光合电子传递相关蛋白质的结构和活性,从而调节植物的光合效率.蛋白质组学研究发现了一系列光合电子传递相关蛋白质受S-亚硝基化调控的情况(图1).植物光系统II(PS II)囊腔侧的放氧复合物(OEC)包含3个外周蛋白,分别是PsbO,PsbP和PsbQ,对PS II放氧活力起重要作用.PsbO可稳定OEC结构和释放氧气,并可作为鸟苷三磷酸(GTP)酶调节D1磷酸化,从而在PS II修复过程中发挥作用,而PsbP参与基粒堆叠的形成以及PS II的组装和稳定性,它们的氧化还原水平将调节PS II的稳定性以应答植物体内的氧化还原稳态[16].在GSNO处理的拟南芥叶片[11]和悬浮培养细胞[9],以及干旱处理的小麦植株中[6],PsbO和PsbP均存在S-亚硝基化修饰.这表明NO可能可以通过调节OEC的S-亚硝基化修饰来调控PS II释放氧气的活性,并且调整PS II的构象以应答逆境胁迫.
此外,捕光色素复合体[14]、叶绿素a/b结合蛋白[6,15]、PS II反应中心相关蛋白(如P680、D2和CP47)[9,15]、电子载体(如质体蓝素[8]、含铁硫簇结合结构域的蛋白质[8]和铁硫蛋白[9])、光系统I(PS I)反应中心相关蛋白(如D2和PsaF)[14],以及铁氧还蛋白和铁氧还蛋白-NADP+氧化还原酶(LFNR)[7]等一系列光合电子传递相关的蛋白质,都存在S-亚硝基化.这些蛋白质S-亚硝基化水平的变化可调节光捕获和电子传递,以应答各种环境胁迫.
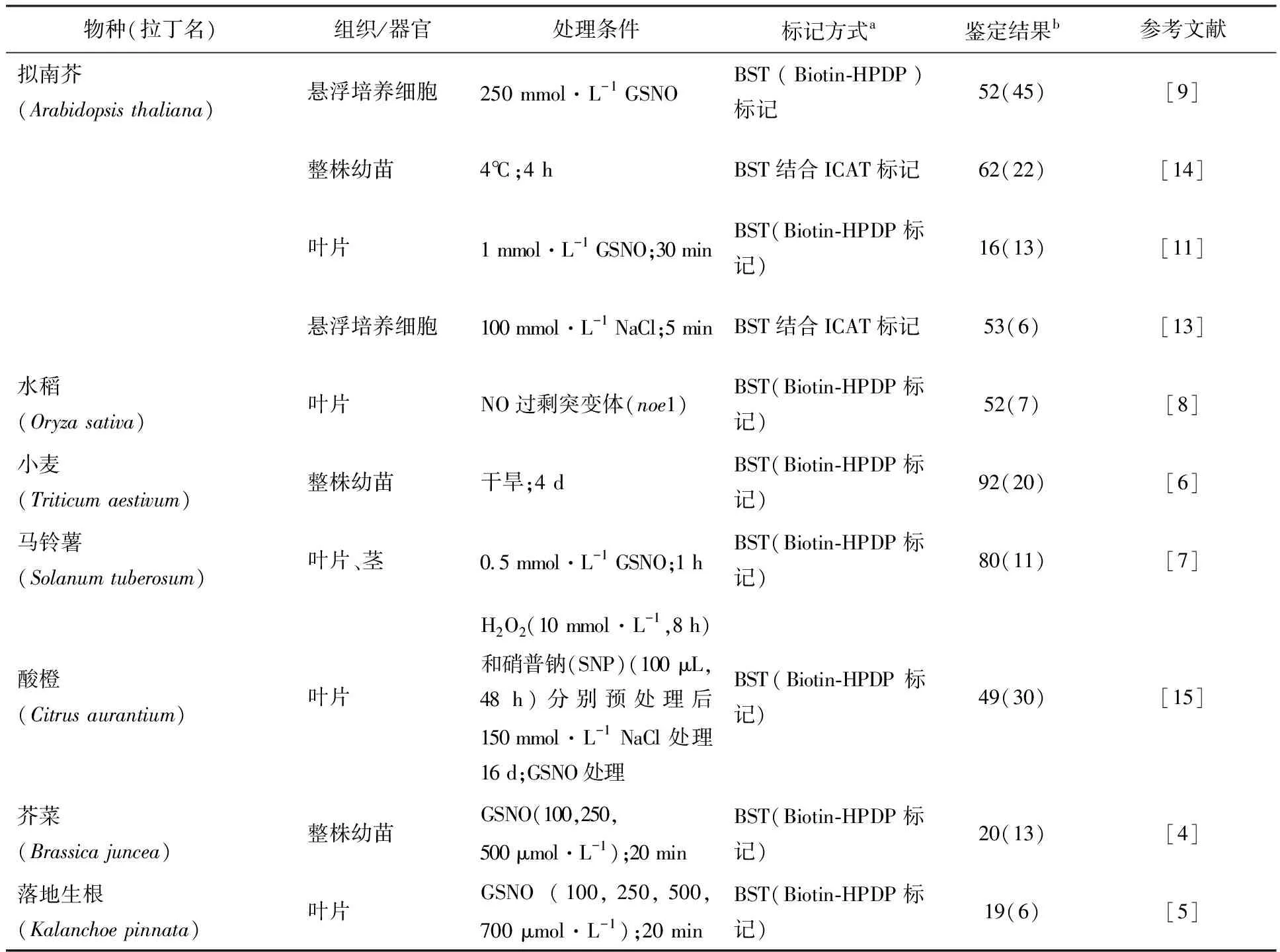
表1 植物亚硝基化蛋白质组学研究内容概述
a蛋白质组学研究方法:生物素置换法
b鉴定到的亚硝基化蛋白总数量(定位于叶绿体的亚硝基化蛋白数量)
蛋白质组学研究表明,叶绿体腺嘌呤核苷三磷酸(ATP)合成酶α、β、γ和δ亚基都被鉴定为S-亚硝基化蛋白[6-7,15].其中,ATP合成酶α、β和γ亚基在小麦、番茄(Solanumlycopersicum)、油菜(Brassicanapus)和拟南芥应答干旱、小麦条锈菌(Pst)感染、H2O2和脱落酸(ABA)处理时,受到氧化还原调控[6,17-19].叶绿体ATP合成酶的活性受其中心轴γ-亚基的氧化还原状态调节.硫氧还蛋白(Trx)介导的菠菜ATP合成酶γ-亚基中Cys199和Cys205之间二硫键的还原可诱导其构象变化,从而激活ATP合成酶[20].这表明,ATP合成酶的活性可能也与除γ-亚基以外的其他亚基的氧化还原状态相关,而NO可能是调控其活性的一种重要因子.
2 S-亚硝基化调节卡尔文循环
卡尔文循环负责光合生物的CO2固定,是生物圈食物链的基础.蛋白质组学研究发现,参与卡尔文循环途径的酶都已被鉴定为S-亚硝基化蛋白(图1)[21].二磷酸核酮糖羧化酶(RuBisCO)是光合作用C3碳反应中的重要羧化酶和光呼吸中不可缺少的加氧酶,也是光合作用中决定碳同化速率的关键酶.蛋白质组学研究表明,小麦[6]、水稻[8]、酸橙[15]和拟南芥[9,11]中RuBisCO大亚基和小亚基都被鉴定为S-亚硝基化蛋白.RuBisCO大亚基和小亚基酶活性依赖于巯基的氧化还原调节.ABAT等[5]发现GSNO可导致落地生根中RuBisCO发生S-亚硝基化修饰,导致酶活性下降.低温胁迫也可导致芥菜中RuBisCO的S-亚硝基化水平上升,导致酶活性降低[4].这些结果表明RuBisCO的S-亚硝基化可抑制其酶活性,从而降低植物碳同化效率.

图1 S-亚硝基化蛋白质组学研究揭示的植物叶绿体NO信号调控网络.缩写:APX,抗坏血酸过氧化物酶;CaM,钙调蛋白;DHAR,抗坏血酸还原酶;Grx,谷氧还蛋白;MDHAR,单脱氢抗坏血酸还原酶;NDPK2,核苷二磷酸激酶2;Prx,过氧化物氧化还原酶;SOD,超氧化物歧化酶
RuBisCO活化酶(RCA)调节RuBisCO活性,可利用水解ATP生成的能量促使磷酸糖抑制物从RuBisCO上解离,恢复RuBisCO活性.在GSNO和低温处理的拟南芥叶片中,RCA发生S-亚硝基化[9,14].氧化型的RCA对ATP的亲和力下降,活性被二磷酸腺苷(ADP)所抑制,但是被f型硫氧还蛋白(Trxf)还原后,则可以缓解该抑制作用[21].这表明S-亚硝基化可能抑制RCA的活性.
叶绿体磷酸甘油酸激酶(PGK)催化磷酸基从ATP转移到3-磷酸甘油酸,生成1,3-二磷酸甘油酸.甘油醛-3-磷酸脱氢酶(GAPDH)在还原型烟酰胺腺嘌呤二核苷酸磷酸(NAD(P)H)存在时,可催化1,3-二磷酸甘油酸可逆生成甘油醛3-磷酸.磷酸丙糖异构酶(TPI)催化甘油醛-3-磷酸与二羟丙酮磷酸的相互转变.研究显示,拟南芥和马铃薯中的PGK[7,9,11]、拟南芥、水稻和酸橙中的GAPDH和TPI[8-9,14-15]都被鉴定为S-亚硝基化蛋白.TPI在体外不能形成二硫键,但仍存在S-亚硝基化,S-亚硝基化可抑制衣藻中TPI的活性[22].此外,细胞质GAPDH活性可以被S-亚硝基化完全抑制,并且可被谷胱甘肽(GSH)完全激活,或者被Trx部分激活.考虑到叶绿体GAPDH与细胞质GAPDH结构和化学性质的高度相似性,细胞质GAPDH的S-亚硝基化调控机制可能也存在于叶绿体GAPDH中[21].因此,这3种酶的S-亚硝基化很可能会抑制3-磷酸甘油酸的还原.
蛋白质组学研究表明,植物中参与核酮糖-1,5-二磷酸再生的多种酶也被鉴定为S-亚硝基化蛋白,包括果糖二磷酸酶[4-5,7-9,14]、景天庚酮糖二磷酸酶[4]、转酮醇酶[4,8,14-15]、磷酸戊糖异构酶[7-8,15]、磷酸核酮糖激酶[8,11,14-15]和卡尔文循环蛋白CP12[8].衣藻(Chlamydomonasreinhardtii)中所有的卡尔文循环相关酶都被鉴定为S-亚硝基化蛋白.值得注意的是,除了活性可被S-亚硝基化抑制的衣藻TPI[22]和植物RuBisCO[4]之外,其他卡尔文循环相关酶的S-亚硝基化调节都没有被生物化学分析进一步证实[21].因此,进一步解析卡尔文循环相关酶的S-亚硝基修饰有助于深入认识植物碳同化的调控网络.
3 S-亚硝基化可调节抗氧化系统重要酶的活性
活性氧(ROS)的产生是植物体内有氧代谢的结果.正常条件下,植物体内ROS的产生和清除处于动态平衡状态,但当植物遭受胁迫时,体内的NO和ROS都会过量积累,从而导致亚硝化胁迫和氧化胁迫的发生.植物为了维持其内环境的ROS稳态,可利用酶与非酶系统清除过量积累的ROS.研究者们应用蛋白质组学技术鉴定了多种清除ROS的抗氧化酶在GSNO或逆境胁迫条件下发生的S-亚硝基化修饰(图1).
SOD可催化O2•-转变为H2O2的歧化反应,是植物细胞抵御ROS的第一道防线.芥菜和酸橙中的铁依赖型超氧化物歧化酶(Fe-SOD)和拟南芥中的铜锌依赖型超氧化物歧化酶(Cu/Zn-SOD)都被鉴定为S-亚硝基化蛋白[4,9,15].
Prx可以利用巯基催化机制还原H2O2,而Trx则有助于还原态Prx的再生.植物叶绿体中含有典型的2-Cys Prx,以及非典型单体PrxQ和Prx IIE.蛋白质组学研究表明,番茄和酸橙中的2-Cys Prx,以及拟南芥和水稻中的Prx IIE为S-亚硝基化蛋白[7-9,15].生化与遗传学分析表明,GSNO可导致拟南芥Prx IIE的Cys121位点发生亚硝基化,并抑制其还原H2O2的能力.此外,Prx IIE具有解毒过亚硝酸盐(ONOO-)的能力,且Prx IIE的亚硝基化也抑制了其解毒ONOO-的活性,导致ONOO-水平显著上升及蛋白质硝基化水平升高[23].
APX以抗坏血酸为底物催化H2O2的还原反应.在NO供体硝普钠(SNP)预处理后再经历NaCl胁迫的酸橙中,叶绿体APX的S-亚硝基化水平上升[15].烟草细胞质APX(cAPX)被亚硝基化修饰后,活性受到抑制,引起细胞内H2O2含量增加,导致细胞死亡.cAPX的亚硝基化修饰也可导致其发生泛素化修饰,从而促使其被蛋白酶体降解;而NO清除剂PTIO可以减少cAPX的泛素化与降解[24].与之相反,GSNO处理引发豌豆(Pisumsativum)cAPX的Cys32发生亚硝基化修饰,促进了该酶活性;在盐、氧化及硝化等胁迫条件下,cAPX发生亚硝基化修饰的同时,其活性也显著增加[25].对APX的S-亚硝基化调控活性的研究主要集中于cAPX,对叶绿体APX的研究较少.然而,考虑到叶绿体APX和cAPX的序列高度同源性,叶绿体APX可能也存在类似于cAPX的S-亚硝基化调控机制.
单脱氢抗坏血酸还原酶(MDHAR)和DHAR催化植物中重要抗氧化剂抗坏血酸的再生,在氧化胁迫应激过程中发挥重要作用.水稻和拟南芥中MDHAR[8,11]和马铃薯中DHAR[7]均被鉴定为S-亚硝基化蛋白.GSNO可导致MDHAR发生亚硝基化修饰并且抑制其酶活性[26].
Trx和Grx能够催化巯基-二硫键交换反应以及还原蛋白质谷胱甘肽二硫化物,从而维持胞内的氧化还原稳态.干旱处理4 d的小麦叶绿体中Trx M2的S-亚硝基化程度增加[6],叶绿体GrxS14和GrxS16在水稻noe1植株中S-亚硝基化水平增加[8].这表明NO可以通过调节抗氧化系统重要酶的S-亚硝基化修饰,影响其活性,从而调控植物细胞内的ROS和RNS稳态.
4 S-亚硝基化调节蛋白质合成、加工与周转
NO参与蛋白质合成的调控.水稻和拟南芥中多种RNA结合蛋白为S-亚硝基化蛋白(图1)[8-9,11].S-亚硝基化修饰可能通过影响RNA结合蛋白可与RNA相互结合形成核糖核蛋白复合体,参与蛋白质合成调控.此外,植物叶绿体内多种翻译起始因子(如EF5A-4和EF-Tu)和核糖体蛋白(如50S RP、50S L15、50S L16、50S L27)也是S-亚硝基化蛋白[6,8-9,14].这表明NO也可以通过调节翻译起始因子和核糖体蛋白的S-亚硝基化水平,影响叶绿体中蛋白质的生物合成过程.
S-亚硝基化影响蛋白质的加工与周转.蛋白质组学研究发现叶绿体内多种分子伴侣(包括Cpn10、Cpn21和Cpn60)和热激蛋白(如Hsp70)为S-亚硝基化蛋白[4,6,8-9,15].Cpn和Hsp有助于促进多肽的正确折叠和转运,防止异常蛋白质聚集,尤其在植物应答逆境胁迫时发挥重要作用.因此,Cpn和Hsp的S-亚硝基化修饰可能影响其参与蛋白质加工过程.此外,多种与蛋白质降解有关的蛋白质也是S-亚硝基化蛋白,包括半胱氨酸蛋白酶抑制剂(CPI)[15]和多种大肠杆菌ATP依赖的丝氨酸蛋白酶(Clp)[6,9].CPI可与巯基蛋白水解酶形成动态平衡,调节植物体内多种重要生物学过程.Clp蛋白酶可清除叶绿体内毒性蛋白或多肽,保证细胞正常的生理功能.CPI发生S-亚硝基化,可能导致CPI与巯基蛋白水解酶的动态平衡受到影响,从而影响蛋白质的降解速率;而Clp蛋白酶的S-亚硝基化也可能影响其降解蛋白质的速率,影响细胞的正常生理功能.
5 S-亚硝基化调控Ca2+介导的信号通路
蛋白激酶/磷酸酶催化的可逆蛋白磷酸化对于信号转导和酶活性调节至关重要.CaM是细胞内第二信使Ca2+的重要靶标,因此可作为钙感应器在细胞信号转导过程中发挥作用.NDPK参与维持细胞内NDP和NTP的代谢平衡,从而调控植物生长与发育的多种途径.叶绿体定位的NDPK2是植物光敏色素介导的植物光信号传导过程中的重要物质.蛋白质组学研究显示,马铃薯叶片中的NDPK2被鉴定为S-亚硝基化蛋白,拟南芥植株中CaM在低温条件下S-亚硝基化水平上升[7,14].这两种信号转导相关蛋白质的S-亚硝基化水平的变化可能调控相应信号的传递.
6 S-亚硝基化调控氮硫同化和四吡咯化合物合成
叶绿体内通过谷氨酰胺合成酶(GS)与谷氨酸合成酶(GOGAT)的联合作用,将植物吸收的无机氨转变成谷氨酰胺和谷氨酸.植物体中存在多种不同亚细胞定位的GS同工型.蛋白质组学研究表明,拟南芥中叶绿体定位的GS2在低温处理后S-亚硝基化程度增加[9,14].此外,水稻noe1植株中的GOGAT的S-亚硝基化水平也发生变化.这些表明叶绿体中GS/GOGAT循环同化氨过程受S-亚硝基化的调节.
硫是植物生长发育所需的大量营养元素之一,参与合成多种重要代谢物,如甲硫氨酸、维生素、辅酶、GSH和含巯基蛋白等.植物通过根细胞膜上的专一转运蛋白将环境中的无机硫吸收,在根细胞质体或叶肉细胞叶绿体中经过一系列酶促还原后生成硫化物.在半胱氨酸合成酶(CSase)的催化下,H2S与O-乙酰丝氨酸(OAS)反应生成Cys.蛋白质组学研究表明,马铃薯叶片中CSase可以被S-亚硝基化,低温可以诱导拟南芥植株中CSase的S-亚硝基化水平上升[7,14],这表明NO通过调节CSase的S-亚硝基化来参与调控叶绿体硫同化过程.
质体中合成的四吡咯化合物对于合成多种叶绿素、血红素和光敏色素等至关重要[27].四吡咯化合物的合成过程至少需要25种酶的催化作用.大量研究已经证实该过程中有4种酶的氧化还原状态受到Trx调节,5种酶受硫氧还蛋白还原酶C氧化还原系统(NTRC)的调节.其中,谷氨酸-1-半醛-2,1-氨基变位酶(GSAT)和Mg螯合酶(MgCh)的活性受到Trx和NTRC调节[27].酸橙中的GSAT和水稻中的MgCh均可发生S-亚硝基化[8,15].但是,目前并没有生物化学或分子遗传学证据可证明NO分子可以调控四吡咯化合物的生物合成.
7 结 语
环境变化导致叶绿体中RNS的产生,了解叶绿体蛋白质S-亚硝基化的调控机制具有重要意义.蛋白质组学研究结果揭示了蛋白质S-亚硝基化可调控叶绿体中多种信号和代谢途径,如光合电子传递、卡尔文循环、抗氧化系统、蛋白质合成、蛋白质加工与周转、Ca2+介导的信号通路、氮同化、硫同化,以及四吡咯化合物的合成等(图1).这对于深入理解植物NO信号分子调控网络具有重要意义.然而,由于目前对S-亚硝基化蛋白主要依赖于凝胶电泳的方法,该方法无法鉴定S-亚硝基化发生的具体Cys位点,也无法定量还原态Cys与发生S-亚硝基化的比例.同时,目前绝大部分蛋白发生S-亚硝基化的调控机理尚不清楚.因此,今后需完善翻译后修饰蛋白质组学的研究方法,实现精确鉴定和定量蛋白质发生S-亚硝基化的Cys位点,并且利用生物化学与分子遗传学策略深入解析蛋白质S-亚硝基化调控叶绿体代谢过程.
