喜树碱生物合成研究进展
2019-01-14徐姿艳潘静娴钱忠英崔丽洁
徐姿艳, 潘静娴, 钱忠英, 崔丽洁
(上海师范大学 生命科学学院 植物种质资源开发协同创新中心,上海 200234)
喜树(CamptothecaacuminataDecne)是亚热带珙桐科(Nyssaceae)喜树属(Camptotheca)多年生落叶阔叶树,是中国特有种[1].喜树的化学成分复杂,Wall等[2]在1966年从喜树中分离获得了一种色氨酸-萜烯类生物碱,将其命名为喜树碱(Camptothecin,CPT),研究结果显示喜树碱在体外对Hela和L1210等细胞会显示出较强的抗肿瘤活性,从而引起人们的关注[3].
喜树碱是目前已发现的唯一通过抑制拓扑异构酶Ⅰ而发挥细胞毒性的天然植物成分,对卵巢癌、结肠直肠癌及白血病等多种恶性肿瘤都有较好疗效.世界卫生组织将喜树碱及其衍生物作为主要的抗癌药物进行开发[4],现已有两种喜树碱衍生物——拓朴替康(Topotecan)和依诺替康(Irinotecan)在美国食品和药物管理局(FDA)获准用于临床;20世纪70年代中国科学家自主研发的羟基喜树碱疗效可靠,备受关注[5].目前,全球市场对喜树碱类的药物需求量大,其原材料主要源自天然喜树,受资源少和含量低的限制,喜树碱类抗癌药物的价格昂贵,因此寻找有效方法解决此类难题显得至关重要.
1 优质高产喜树的获得
植物次生代谢产物的合成和积累与遗传有关,受基因调控,也受树木发育期和环境影响,且在同株植物的不同组织器官中的含量也不同.分析产地、树龄及不同器官中的靶次生代谢物含量,采取适当策略获得喜树碱产品,可以达到较好效果.
1.1 喜树道地性和器官对喜树碱含量的影响
喜树分布于中国长江流域及西南各省[1].王自芬等[6]对来自15个不同产地的喜树果实进行检测,发现不同地理种群的喜树中的喜树碱含量存在显著差异.其中,福建产的喜树果实中喜树碱质量分数最高,为0.1902%;贵州产的喜树果实中喜树碱质量分数最低,为0.0853%,两者差异极显著(P<0.01).王玲丽等[7]通过研究不同种源喜树幼枝发现,四川成都所产的喜树幼枝中喜树碱质量分数最高,为0.163%;安徽合肥所产的喜树幼枝中喜树碱质量分数最低,仅为0.034%,两者差异极显著(P<0.01).
喜树各器官中均含有喜树碱及其衍生物,但不同器官及同一器官不同发育时期中喜树碱的含量差异非常大[7].研究表明,越幼嫩的组织中喜树碱质量分数越高,如幼叶(0.185%)、种子(0.172%)和幼枝(0.159%)[8].其中幼枝因其喜树碱含量高、产量大以及可重复采收等优点,可作为喜树碱生产的原料[9].随着喜树的生长发育,喜树碱的积累也会发生变化.LIU等[10]通过研究发现,两年生幼叶中喜树碱的含量是三年生的两倍,是四年生的16倍.王玲丽等[7]发现两年生幼枝的喜树碱含量比一年生高,并认为一年生喜树组织非常幼嫩,主要进行初生代谢,其生物量及次生代谢活动都比较低,而两年生喜树生物量大,次生代谢旺盛,生物碱积累也较多.因此生长2~3 a左右的喜树幼枝可以为喜树碱生产提供较丰富的原料.
1.2 含喜树碱的物种
喜树种植分布范围窄,群体数量少,生长缓慢,导致喜树碱的产量偏低.因此,寻找可替代植物,可以解决喜树碱来源单一、喜树资源匮乏等问题.目前,已经从夹竹桃科的海木狗牙花(Ervatamiaheyneana(Wall.) T.Cooke)茶茱萸科的臭味假柴龙树(Nothapodytesfoetida(Wight) Sleum)以及茜草科的短小蛇根草(OphiorrhizapumilaChamp.ex Benth)等至少16种植物中相继检测到喜树碱及其类似物[11-12].DIGHE等[13]分析了来自印度Dapoli地区的海木狗牙花(Ervatamiaheyneana)茎中喜树碱的质量分数高达0.0413 mg·g-1.LOKESH等[14]检测发现印度的臭味假柴龙树(Nothapodytesfoetida)和蛇根草(OphiorizzaMungos)也能合成喜树碱,但其含量存在明显的地域差异.在臭味假柴龙树中,Amboli地区的喜树碱平均质量分数为0.084%,Sagar地区的喜树碱平均质量分数为0.018%,Kodchadry地区产的喜树碱平均质量分数为0.035%;在蛇根草中,来自Kemmanagundi地区的喜树碱平均质量分数为0.036%,来自Karod地区的喜树碱平均质量分数为0.010%.从已有研究结果来看,在这些植物中,臭味假柴龙树的喜树碱含量较高,但是仍远低于喜树幼嫩组织中喜树碱的含量.目前尚没有寻找到一种合适的植物可以完全替代喜树,因此还需要结合其他理化或生物技术手段,对这些植物资源进行改良,为喜树碱生产提供更好的来源.
2 理化因子对喜树碱含量的影响
植物的次生代谢产物积累是长期进化过程中与各种因素相互作用的结果,其对提高植物自身保护和生存竞争能力,及对环境胁迫的适应能力具有重要作用[15],因此次生代谢产物的积累受环境影响很大.通过改变生长环境的理化条件可以改变相应次生代谢产物的积累.
2.1 物理因素对喜树碱积累的影响
LIU等[16-17]研究了暗培养及干旱胁迫对喜树幼苗中喜树碱含量的影响,结果表明:在暗培养下,根部的喜树碱逐渐减少,而茎部的喜树碱含量则显著升高;在干旱胁迫下,叶子中的喜树碱积累明显增多,说明喜树碱的合成受干旱胁迫的诱导.此外,适合的温度条件对喜树碱的生物合成与积累也是有利的,汪贵斌等[18]对喜树进行处理后发现喜树在昼/夜温度为35 ℃/30 ℃以及40 ℃/35 ℃的条件下生长量较高,且当昼/夜温度为35 ℃/30 ℃时叶片中喜树碱质量分数最高,为0.209 mg·g-1.王玲丽等[19]运用UV-B(ultraviolet-B)辐射梯度时间处理喜树,发现喜树碱含量随着每天UV-B辐射时间的延长呈现增长趋势,且经8 h辐射处理的喜树喜树碱质量分数最高,幼叶中的增至0.230%,茎中的为0.064%,根中的增至0.065%.这都说明了适当的高温、UV-B辐射增强等外界物理条件的影响都会促进喜树碱的积累[18-19].
2.2 化学因子对喜树碱积累的影响
植物细胞培养法生产喜树碱被认为是很有希望的替代途径.研究表明,在培养基中添加诱导因子可使喜树愈伤组织中喜树碱的含量增加.顾青等[20-21]在培养基中添加CuCl2导致愈伤组织中的喜树碱含量比未诱导前增加了约30倍,添加L-色氨酸可使喜树碱含量增加3倍.董妍玲等[22]发现壳聚糖诱导子的刺激能使喜树悬浮培养细胞中喜树碱的生物合成含量提高 6.18倍.有研究表明酵母粉、茉莉酸以及茉莉酸甲酯、真菌诱导子和抗褐变剂等的添加也可显著增加喜树愈伤组织中喜树碱的含量[23-24].
目前关于诱导子在体外培养的植物细胞中具体的作用机制尚未形成完善的理论体系,但已有许多研究发现诱导子可能是通过影响相关酶,最终影响次生代谢产物的合成.酶在植物次生代谢途径中有着重要的作用,利用基因工程技术影响相关酶的活动,可以从根本上解决喜树碱等次生代谢产物产量低的问题.
3 基因工程手段提高喜树碱含量
植物次生代谢的基因工程,是利用基因工程技术对植物次生代谢途径的遗传特性进行改造,进而改变植物次生代谢产物的品质、产率的技术,它主要包括关键酶基因工程及其转录因子或调节基因两个方面[25].
3.1 喜树碱生物合成途径及关键酶
喜树碱在结构上属于喹啉生物碱,其生物合成来自单萜吲哚生物碱(MIAs)[26].萜类吲哚生物碱具有普遍的前体物质异胡豆苷[27].如果以异胡豆苷的生成为分界线,可以将MIAs合成途径分为上游途径和下游途径.目前,以长春碱为代表的MIAs合成途径的上游途径已经有了研究结果,该途径主要包括甲羟戊酸(MVA)途径、磷酸甲基赤藓醇(MEP)途径、裂环烯醚萜(secoiridoid)途径和莽草酸(shikimate)途径.MVA、MEP和裂环烯醚萜途径提供MIAs合成前体裂环马钱子苷类似物,这些途径中的关键限速酶为香叶醇-10-脱氢酶(G10H).莽草酸途径提供合成前体色胺(tryptamine),该途径中的关键限速酶为色氨酸脱羧酶(TDC).而色胺和裂环马钱子苷在异胡豆苷合成酶(STR)作用下合成异胡豆苷.而从异胡豆苷之后开始,不同MIAs生物合成开始分化.异胡豆苷经过几步酶促反应后生成包括喜树碱、长春碱等在内的各种萜类吲哚生物碱[11,28].早期的研究认为喜树碱来自于异胡豆苷[27,29-30],但最新研究报道称在喜树中并未检测到裂环马钱子苷和异胡豆苷[27],由此推测喜树碱合成和长春碱合成的上游途径不完全相同.目前研究认为喜树在裂环烯醚萜途径催化过程中,产生裂环马钱子苷类似物——裂环马钱子酸,为喜树碱的合成提供了前体(图1).喜树碱是以色胺和裂环马钱子酸为前体在异胡豆苷酸合成酶(STRAS)的作用下合成异胡豆苷酸[31],之前曾有研究报道称在短小蛇根草中也存在异胡豆苷酸[29],因此异胡豆苷酸才可能是喜树碱合成过程中的核心中间体[28].异胡豆苷酸经过一系列脱水、氧化及还原反应形成喜树碱,部分喜树碱在细胞色素P450单加氧酶催化下合成10-羟基喜树碱,继续在10-羟基喜树碱O-甲基转移酶(Ca10OMT)催化下合成10-甲氧基喜树碱[32].目前关于喜树碱合成途径的推测仅建立在代谢物检测数据基础上,后续尚需要进行体外生物催化以及植物体内转基因验证,对该生物合成途径作进一步的确认.
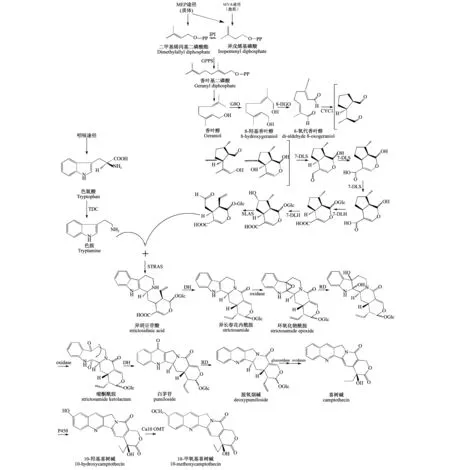
图1 喜树碱合成途径[27-28,31].Camptothecin synthesis pathway TDC:色氨酸脱羧酶;IPI:异戊烯基二磷酸异构酶;GPPS:香叶基二磷酸合酶:G8O:香叶醇-8-脱氢酶;8-HGO:8-羟基香叶醇氧化还原酶;CYC1:环烯醚萜合酶/环化酶;7-DLS:7-脱氧基酸合成酶;7-DLGT:7-脱氧葡萄糖酸葡糖基转移酶;7-DLH:7-脱氧鸟嘌呤羟化酶;SLAS:裂环马钱子酸合成酶;STRAS:异胡豆苷酸合成酶;DH:脱水;RD:还原;P450:细胞色素P450单加氧酶;Ca10OMT:喜树(Camptotheca acuminata)10-羟基喜树碱O-甲基转移酶.TDC:tryptoophan decarboxylase;IPI:isopentenyl diphosphate isomerase;GPPS:geranyl diphosphate synthase;G8O:geraniol-8-dehydrogenase;8-HGO:8-hydroxygeraniol oxidoreductase;CYC1:iridoid synthase/cyclase;7-DLS:7-deoxyloganetic acid synthase;7-DLGT:7-deoxyloganetic acid glucosyltransferase;7-DLH:7-deoxyloganic acid hydroxylase;SLAS:secologanic acid synthase;STRAS:strictosidinic acid synthase;DH:dehydration;RD:reduction;P450:cytochrome P450 monooxygenase;Ca10OMT:Camptotheca acuminate10-hydroxycamptothecin O-methyltransferase
3.2 喜树碱合成途径关键酶改造
3.2.1 喜 树
根据已知的喜树碱合成途径,可以通过改变关键酶的表达来影响喜树碱的生物合成.沈少华[32]利用叶盘法将细胞凋亡因子Bax基因转入到喜树中,发现在转基因愈伤中喜树碱以及10-羟基喜树碱的含量分别提高了4.4倍和2.1倍,表明虽然Bax会促进细胞凋亡,但是同时也激发了植物的次生代谢合成,最终导致次生代谢产物的积累;测定了获得TDC过表达转基因的细胞株中的喜树碱含量,发现TDC可以在一定程度上提高喜树碱的含量.闫通帅[33]通过病毒诱导的基因沉默(VIGS)技术诱导喜树内源位于上合成途径的G10H、HGO、TDC1和STR的沉默.基因沉默后,喜树碱含量有一定程度的下降,降幅为30%~40%.SADRE等[28]利用RNA干扰技术,对喜树体内的TDC1和CYC1基因的表达进行了抑制,结果发现基因抑制株系中的喜树碱含量大幅度下降.当TDC1在喜树中表达水平下降到对照株系的3%时,喜树碱含量只有对照株系的1/1000.此外还可以通过转入外源关键酶基因来影响喜树碱的合成.开国银等[34]将来自长春花的STR和G10H基因转入喜树的毛状根,将喜树碱含量提高了3.8倍.从目前的研究报道来看,利用吲哚生物碱合成途径中关键酶基因对喜树进行改造可以有效提高喜树碱含量.喜树作为木本植物,其遗传转化周期长且难度大,且无法获得足够的生物量进行后续研究,因此目前喜树基因工程研究停滞不前,急需开发含喜树碱的其他资源植物,来进行深入和有效的生物工程研究.
3.2.2 蛇根草
蛇根草喜树碱含量比喜树等其他植物略低[35-36],但作为草本植物,其具有易获得[37-38]和便于进行基因技术操作的优势[39-40].对蛇根草中喜树碱合成的研究起步较晚,相关报道较少.目前仅CUI等[41]在短小蛇根草毛状根中同时过表达CrG10H和CrSTR基因,结果发现此过表达毛状根的喜树碱产量平均提高了56%.而ASANO等[42]通过RNA干扰技术,抑制了短小蛇根草毛状根内源TDC和裂环马钱子苷合成酶(SLS)的表达,导致喜树碱和一些中间产物含量明显降低.
与喜树碱合成途径研究相比,对长春花中的萜类吲哚生物碱合成途径的研究结果更显著和深入,不同酶对萜类吲哚生物碱合成的影响不同[43-46].可以预期,随着对喜树碱合成途径以及关键酶基因序列不断深入的研究,利用基因技术对短小蛇根草中其他关键酶进行改造,将为喜树碱生产提供高质量的植物品种资源.
3.3 喜树碱合成相关转录因子研究
转录因子是能够识别并结合启动子区的元件达到调控基因表达作用的一类蛋白质分子.利用转基因技术调控转录因子,通常可以同时调节多个关键酶基因的转录,从而改变植物的表达性状,影响植物中次生代谢产物的合成[47].到目前为止,已经发现bHLH、MYB、WD40等转录因子参与调控黄酮类代谢;长春花中有CrORCAs、CrMYCs、CrZCTs、CrWRKYs等转录因子参与生物碱的次生代谢;AP2/ERF类、WRKY、bZIP以及锌指类转录因子参与调控萜类合成[48-49].目前对于参与喜树碱生物合成的转录因子的研究很少.
SIRIKANTARAM A S等[11]在蛇根草毛状根中过表达OpMYB1.OpMYB1作为一个负调节因子,会降低OpTDC的表达,导致喜树碱产量降低.此外还可以通过转入外源转录因子来影响喜树碱的合成,比如来自长春花的转录因子ORCA3,是一种响应于茉莉酮酸的APETALA2(AP2)结构域的基因,能够增强萜类吲哚生物碱的生物合成途径中部分关键基因的转录.由于长春花和喜树具有类似的MIAs生物合成途径,所以NI等[50]将ORCA3基因引入到喜树毛状根中,并将喜树碱的产量提高了1.5倍.随着喜树碱合成途径的进一步解密,和对转录调控研究的深入,利用转录因子实现对喜树碱合成的调控,选育优良的转基因株系替代野生资源生产喜树碱,将具有广阔的应用前景.
4 合成喜树碱其他策略
癌症发病率越来越高,喜树碱类抗癌药物的需求也在逐年增长,供不应求的矛盾日益突出.除了扩大药源以及提高药源中喜树碱的含量外,利用化学合成、内生真菌,生物反应器等的研究都为提高喜树碱的产量提供可能.1975年美国哈佛大学Corey 研究组[51]首次报道了手性全合成喜树碱的方法,此后EJIMA[52]等,COMINS[53]等,FORTUNAK等[54]报道了更加简单快速的喜树碱合成方法.此外喜树碱衍生物,如:10-羟基喜树碱,CPT-ll,9-硝基喜树碱和9-氨基喜树碱的化学合成方法也取得了巨大进展.但是由于途径长、成本高、产率低,这些化学合成途径均未实现产业化,喜树碱类药物生产仍然严重依赖植物原材料.喜树内生真菌的研究也取得了进展.陈贤兴等[55]首次从喜树种子中分离得到1株产喜树碱内生真菌.KUSARI 等[56]从喜树树皮中分离到1株Fusariumsolani(镰刀菌属),并在该菌株中同时检测到了喜树碱、10-羟基喜树碱和9-甲氧基喜树碱.盛贻林等[57]从喜树的果实、树皮、叶片中分离筛选得到1株能够产生喜树碱的菌株(JH001),喜树碱产量达到227 μg·L-1.此外,研究人员在紫龙树(Apodytesdimidiata)、青脆枝(Nothapodytesnimmoniana)、大叶鹿角藤(Chonemorphafragrans)中也分离得到了产喜树碱的内生真菌.但是目前关于这些内生真菌的报道仅限于实验室研究,要真正应用于喜树碱生产尚有许多技术问题需要解决.
5 结 语
随着癌症发病率越来越高,喜树碱类抗癌药物的需求也在逐年增长,临床供应是急待解决的关键问题.利用现代生物技术提高喜树碱产量,具有十分广泛的应用前景.自然界的植物资源丰富,可以扩大植物资源研究调查,继续寻找潜在的喜树碱生物资源.喜树碱等次生代谢产物对外界环境的改变比较敏感,研究不同环境因素及诱导子,可以借助外界因子对次生代谢产物的影响,提高目的产物的积累.喜树碱的生物合成途径的解析,可为发展相关基因工程,培育优良的植物品种作为替代产品提供基础.扩大筛选产喜树碱及其类似物内生真菌的植物范围,筛选更稳定和更高效的产喜树碱菌株,可以大幅度降低喜树碱合成成本.任何一方面的研究突破,都将会有效缓解目前市场上的喜树碱的供需矛盾,造福癌症患者.
