臭氧水对土壤微生物群落的影响
2019-01-14王永强李英东郭正红王全喜
王永强, 李英东, 郭正红, 王全喜
(上海师范大学 生命科学学院 植物种质资源开发协同创新中心,上海 200234)
0 引 言
喷洒农药可以防治设施蔬菜中的病虫害,增加作物的产量,但是其残留却会破坏生态环境,影响人体健康,同时会影响土壤的品质,造成土壤板结,无法再进行种植,其主要原因是农药会破坏土壤微生物群落结构.OMAR等[1]发现使用高剂量的溴苯腈后土壤中细菌、放线菌的数量会降低.ZHANG等[2]报道了施加不同剂量的氯嘧磺隆后,土壤中微生物群落结构出现显著变化,常年使用该药会严重降低土壤微生物总量,降低真菌与细菌间的比例,改变根际微生物群落结构.
蔬菜根际微生物是农田生态系统中重要的分解者,是连接地上和地下生态系统的桥梁[3],它们通过分解有机腐殖质,增加植物对矿物质元素的吸收和运转,改善植物的营养状况,增强植物的抗病能力,进而提高作物产量[4].同时根际微生物还可以反映土壤的质量,保持土壤微生物多样性,对于农业生产具有重要的意义[5].鉴于此,人们开始关注熏蒸剂对土壤病原菌的防效和土壤微生物群落结构的影响,并发现了氯化钴、二甲基二硫等化学物质可以作为熏蒸剂用于防治土壤病原菌[6].
臭氧(O3)是一种公认的广谱、高效、环保杀虫灭菌剂,目前已应用于水溶液消毒、空气净化、粮食储藏[7]、果蔬保鲜[8]、设施农业植物病虫害防治[9-11]等领域.KASURINEN等[12]研究发现臭氧对植物地下部分的影响比对地上部分的出现得早,生物量变化较明显,并且臭氧使得地下部分出现了积累效应.YU等[13]报道了有关大气中臭氧浓度的升高对土壤微生物的影响,但尚未有关于臭氧水直接对根际微生物群落结构影响的报道.
本文作者在不同温度条件下,对比了喷洒相同剂量的清水、臭氧水和“百菌清”对土壤微生物群落结构的影响.同时通过基于序列间相似度的分类单元(OTUS)聚类分析,明确了臭氧能代替农药并保护土壤微生物菌群的组成,特别是Actionbacteria放线菌等能参与分解有机物的菌属,进而改善土壤结构.
1 材料与方法
1.1 实验材料
75%(质量分数)百菌清可湿性粉剂(达科宁);塑料花盆:高35 cm,口径22 cm;臭氧发生器,本研究中臭氧气体的获取来自于臭氧发生器(北京山美水美环保科技有限公司,型号为CF-YG10),主要是通过高压放电的方法获取臭氧,产生臭氧的速率为10 g·h-1;喷壶等.
1.2 研究方案

表1 各处理组设计方案表
注:“√”代表处理对象
模拟大棚中的温度,设置15,25和35 ℃三个温度,从设施大棚中同一片区域内选取相同质量的土壤,利用低(质量)浓度(3 mg·L-1)、中浓度(6 mg·L-1)和高浓度(9 mg·L-1)的臭氧水,以百菌清农药(用水按体积比1∶600稀释)为实验组,以清水为对照组.用臭氧水和清水每天喷洒土壤1次,共喷洒15 d;百菌清每隔5 d喷洒1次,共喷洒3次,每个花盆的喷洒剂量为50 mL.表1为各处理组的处理方案.
1.3 根际微生物群落总数测定
称取10 g根际土壤,移至装有90 mL无菌水的三角瓶中,在摇床中以150 r·min-1的转速摇30 min,使细菌充分悬浮于水溶液中,用移液枪吸取1 mL上清液,加入已装有9 mL 无菌水的试管中,按照稀释分离程序制成不同生物量浓度的菌液(1×105CFU·mL-1和1×106CFU·mL-1);分别取 100 mL菌悬液涂布于Luria-Bertani培养基上,每种浓度做2个平行实验,在37 ℃ 的培养箱中培养,待菌落产生,按菌落形态和颜色特征归类,统一编号,并记录菌落数量,进行计算.计算公式为:
其中,N为样品中菌落数,CTOTOL为平板菌落数之和,n1为菌液中细菌的生物量浓度为1×105CFU·mL-1的平板数,n2为菌液中细菌的生物量浓度为1×106CFU·mL-1的平板数,d为较低的生物量浓度.
1.4 土壤的总DNA提取
为研究臭氧水和百菌清对土壤微生物群落多样性的具体影响,分别从不同的实验组和对照组中提取5 g土样,溶解到无菌水中.并以孔径为0.22 μm的微孔过滤器滤菌.用强力土壤DNA提取试剂盒(美国MoBio公司)按操作要求提取DNA.以1.2%(体积分数)琼脂糖检验所提取的DNA的浓度和纯度.
1.5 各处理组中聚合酶链式反应(PCR)扩增和Illumina高通量测序
基于所有门类在常规和宏基因组研究中的高覆盖率[14-16].用通用引物515 F (GTGCCAGCMGCCGCGGTAA) and 926 R (CCGTCAATTCMTTTRAGTTT)进行16s rDNA的序列扩增.此引物同样用于16 s rRNA同源分析,以及Illumina平台的5′端序列的两步扩增子库的建设.按照对悬序列的操作说明进行分析.在25 μL反应体系中加入1 μL DNA底物,1 μL物质的量浓度为250 μmol·L-1的三磷酸脱氧核苷酸(dNTPs),1 μL物质的量浓度为0.25 μmol·L-1的引物,1倍扩增缓冲液,0.5 U Phusion DNA聚合酶(New England Biolabs,USA),进行初次PCR.PCR循环参数:94 ℃ 预变性 2 min;54 ℃退火 30 s,72 ℃延伸30 s,循环25次;72 ℃最终延伸5 min.用双8条带的NextEra XT指标试剂盒(Illumina Inc.,San Diego.CA,USA)进行复用.循环条件包括1次94 ℃、3 min,8次94 ℃、30 s,56 ℃、30 s,72 ℃、30 s,72 ℃、1 min,循环,最终延伸5 min.在library pooling数据库连接池分析之前,用DNA凝胶提取试剂盒(Axygen,China)纯化PCR产物条带,Qubit dsDNA HS (Life Technologies,Carlsbad,CA,USA)分析试剂盒进行核酸定量.通过微基生物技术公司(上海)在MiSeq平台上用MiSeq v3试剂盒进行2×300 bp的双端测序,并建立文库.
1.6 生物信息学分析
原始序列被分在不同的实验组,每个样本的正反序列都生成一个FASTQ文件.利用QIIME软件在MISeqf分析说明书的指导下对序列进行预处理.通过FASTA格式的文件将序列进行拼接,并过滤掉歧义片段和小于200 bp或大于600 bp的片段.剩余序列用 “unique.seqs”命令简化组成一组独特序列,在SILVA数据库version 119[17]内比对.嵌合序列通过缺省参数在“chimera.uchime”命令下移除.预选序列在“classify.seqs”命令(Wang approach)下按80%置信区间进行分类.清除所有与真核生物、线粒体、叶绿体相似以及未知的序列.最终按照97%的一致性聚集成OTUS.通过“classify.otu”命令进行所用OTUS的聚类分析.覆盖率计算公式为:
其中,nOTUS为OTUS出现次数,N为总克隆分株数.
本研究中数据预处理以及OTUS分析均在MOTHUR上进行.将不同对照组、实验组中的优势菌群分离,按照由DNA序列数量得到的相对丰度进行物种分类,并标出未知序列.利用MOTHUR制作文氏图显示独特和共有的OTUS.
2 结果与分析
2.1 各处理组土壤中微生物群落总数
表2为在不同温度条件下清水、不同浓度的臭氧水和百菌清对土壤微生物群落总数的影响.由表2可知,在相同的温度条件下,清水喷洒的对照组和臭氧水喷洒的实验组中的土壤微生物群落总数都明显大于喷洒农药的实验组,说明臭氧水较农药对设施植物根际微生物群落多样性的影响较小.在相同条件下,较低浓度的臭氧可能会导致较高的微生物群落总数.本实验中当温度为25 ℃时,臭氧水的最适质量浓度为6 mg·L-1.值得关注的是,喷洒臭氧水和清水的微生物群落总数在不同的温度下都显示出了较显著的差异,这表明温度对微生物群落总数有较大调节作用.而喷洒百菌清的微生物群落总数在高温条件下较高,原因可能是温度的升高导致了百菌清成分的分解,使药效降低.总的来看,当温度为25 ℃时,百菌清较臭氧水会大大降低土壤中的微生物多样性.陈展等[18]通过升高臭氧浓度检测了臭氧对土壤微生物功能变化的影响,结果表明适当浓度的臭氧对土壤微生物的多样性和丰富度没有显著影响.
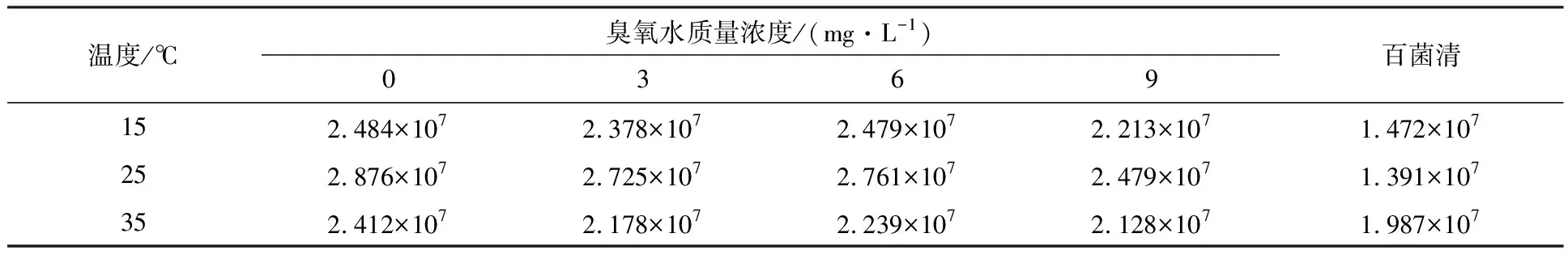
表2 各组微生物群落总数测定结果 CFU·mL-1
2.2 各处理组土壤总DNA的提取及PCR扩增

图1 不同处理组中的PCR产物.1~11分别代表在不同温度条件下喷洒不同的溶液.1:15 ℃,清水;2:15 ℃,6 mg·L-1臭氧水;3:15 ℃,百菌清;4:25 ℃,清水;5:25 ℃,3 mg·L-1臭氧水;6:25 ℃,6 mg·L-1臭氧水;7:25 ℃,9 mg·L-1臭氧水;8:25 ℃,百菌清;9:35 ℃,清水;10:35 ℃,6 mg·L-1臭氧水;11:35 ℃,百菌清
对各处理组分别进行取样,用孔径为0.22 μm的微孔过滤器滤菌.用强力土壤DNA提取试剂盒(美国MoBio公司)按操作要求提取DNA并检测其纯度,共得到11组DNA.利用通用引物进行16s rRNA的序列扩增,结果如图1所示.与Marker进行对比,各处理组均扩增出大小一致的条带,可进行高通量测序并将测序后的结果进行分析.
2.3 微生物丰度
通过测序数据,得到各组土壤中微生物的种类,数据处理时引入微生物丰度与香农指数来描述土壤中微生物群落特征.对比在不同温度条件下喷洒纯水和农药的处理组可以发现:相同温度条件下,纯水组的微生物丰度均大于农药组的,纯水的处理保护了更多微生物不受到损伤,如图2(a)所示.由图2(b)可知,不同温度下质量浓度为6 mg·L-1的臭氧水对微生物丰度的影响也十分明显.实验中,大多微生物丰度会随着温度的上升而上升,而当温度为25 ℃时,实验组的微生物丰度会随着臭氧浓度的上升而减小.其原因可能为:臭氧水处理土壤时,当温度升高,臭氧水随着温度的升高而挥发较快,微生物多样性可能增加.图2(c)为将不同温度下的测序数据按处理方法进行的拟合分析.由图2(c)可知,农药的使用极大影响了土壤中的微生物丰度,使得土壤的种植肥力受到了影响,与之相比,臭氧水和纯水处理组都有较好的微生物丰度保存能力,进而保存了土壤的种植肥力.在不同的实验组中,尽管温度和臭氧水浓度可能会引起香农指数的波动,但相较于其他实验处理方法,臭氧水在提高微生物多样性方面仍更胜一筹.通过测序,也为在不同温度下确定最合适的臭氧水浓度以代替农药提供了有力的依据.

图2 土壤微生物丰度的香农曲线.(a) 不同温度下,水和农药中微生物丰度的比较;(b) 臭氧水在不同温度下对微生物丰度的影响;(c) 比较3个处理组中微生物丰度的变化
2.4 菌种热图分析
通过筛选测序数据中的菌种能够鉴别到种数前50的菌种,将其绘制成热图分析图(图3),颜色深浅对应了二维矩阵中各类菌株的含量:红色代表菌株含量多,绿色代表菌株的含量较少.分析图反映出各实验组中的差异菌株,明显看出X8农药实验组中具有与其他实验组差异较大的菌种,表明百菌清喷洒后造成土壤中微生物群落的改变,破坏了土壤中的微生物结构,通过查找文献能确定百菌清对这些菌种的降解力.比较了臭氧水实验组和农药实验组在菌种含量上的差别,确定了这些含量有差异的菌种对植物生长的促进作用,进一步证明了臭氧水喷洒优于农药喷洒.并将热图与OTUS聚类分析图对应,以表示不同的UUTs含量.由图3可知,X8的微生物群落与其他实验组明显不同.X8实验组即25 ℃下的百菌清实验组,此温度条件下农药对土壤微生物群落组成影响最大,而这一温度正是设施大棚中持续时间最长的温度.X8中的立克次体、鞘氨醇单胞菌、Delftla、多嗜菌、不动杆菌、短波单胞菌和甲基菌属的数目较多,而尼龙菌、Chitinophaga、Mucilaginibacter、链霉菌、柄杆菌、伯克氏菌属和黄杆菌属的数目则较少,而这些菌落多数参与有机磷、原油、有机农药的分解等土壤生态系统的能量流动和物质循环[19-21].然而,其他百菌清实验组在15 ℃和35 ℃温度中表现出相似的微生物群落结构和微生物丰度,说明在25 ℃时百菌清对土壤微生物群落的伤害最大,15 ℃时,可能由于温度过低,农药还没有发挥药效,而35 ℃时,又由于温度过高,农药挥发得过快.图3中各臭氧水实验组中的微生物组成变化不大,表明臭氧水能够在很大的温度跨度内保护土壤的微生物多样性.
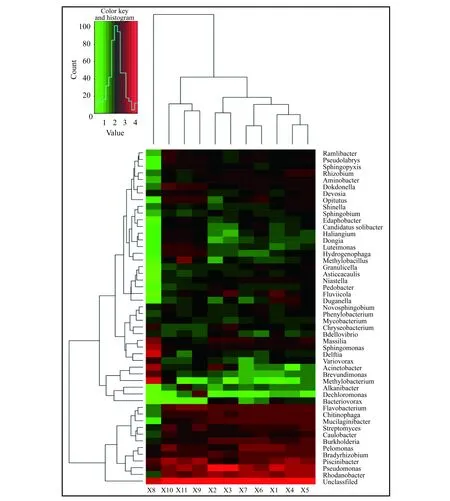
图3 各实验组中微生物种类差异的热图
2.5 菌种差异性分析结果
将所有比率大于0.001的农药实验组和臭氧测序数据筛选出来,进行差异性分析,结果如图4所示.具体缺失的菌种通过红色标注出来并注释,可以看出主要缺失了Actinobacteria属的细菌.由图4可知,相比臭氧水实验组,百菌清实验组缺失了12种菌类,经分析,这12种细菌多数属于放线菌属.放线菌会参与有机物分解、物质循环,也能促进土壤形成团粒结构而改善土壤质量[22-23],还能够产生大量抗生素、酶及其抑制剂等具有活性的物质[24].放线菌的存在还会促进农作物连作与土壤修复,刺激作物根系的生长代谢能力[25].陆启环等[26]研究发现,用质量浓度为1 mg·L-1的臭氧水浇灌草莓的幼苗,会显著增加土壤中大量N和P元素及微量元素Zn的含量,增加草莓幼苗根系活力和叶片的抗氧化酶的活性,还能增加草莓幼苗的抗逆性.具有强氧化性的臭氧将土壤中的有机物质氧化成无机盐,能为土壤提供更多的无机元素,降低土壤的有机质.

图4 臭氧水和农药实验组中微生物种类的差异
3 结 论
本研究以喷水臭氧水和农药为对照,分别通过不同浓度的臭氧水对土壤作用.利用MisSeq 2×300 bp高通量测序分析喷洒臭氧水对土壤微生物多样性的影响,得到以下结论:
1) 不同温度,相同臭氧水浓度条件下,臭氧水对微生物丰度的影响比较显著,土壤中微生物的丰度随着温度的上升而上升;
2)在相同的温度条件下,清水喷洒的对照组和臭氧水喷洒的实验组中的土壤微生物群落总数都明显大于喷洒百菌清的实验组的说明臭氧水对设施植物根际微生物群落多样性影响不大,而百菌清会大大降低土壤中的微生物多样性.尽管温度和臭氧浓度可能会引起香农指数的波动,但相较于其他实验处理方法,臭氧水在保护微生物多样性方面仍更胜一筹;
3)相比臭氧实验组,百菌清实验组的土壤中缺失了可以改善土壤肥力的放线菌(Actinobacteria),降低了土壤的肥力.
总体而言,在设施蔬菜种植过程中,喷洒臭氧水以取代农药对病虫害进行防止,有利于保持土壤中的微生物群落的多样性与微生物总量,进而保持土壤的肥力.
