高挂草中多糖的提取纯化和活性研究
2019-01-11张心慧
张心慧
高挂草为松萝科松萝属的破茎松萝(UsneadiffractaVain)全株,又叫节松萝。高挂草为藻和菌共生的地衣体,我国高挂草分布广泛,主要分布于东北及山西、内蒙古、陕西等地。目前多为裕固族人常用草药之一[1],高挂草寄生在海拔2 500 m以上的松柏树上,是地方性民间药材。高挂草具有较强的活血化瘀、消炎止疼、祛湿止痒的功效[2],因此常在中医药领域应用。目前关于高挂草的研究较少,大部分是对其全株的中药药用价值进行研究,而对高挂草多糖的研究却鲜见报道。常见的植物多糖都有明显的机体调节功能和防病作用,但人们对高挂草多糖却知之甚少。因此,本文以高挂草为原料,对多糖的抗氧化性和抑菌性进行研究,为其药用价值应用提供基础理论依据。
1 材料、仪器设备与试剂
1.1 材料
试验材料:高挂草(采自云南);供试菌:大肠杆菌、黑曲霉、枯草杆菌、酵母菌、根霉(由吉林农业科技学院微生物实验室提供)。
1.2 仪器设备
低速离心机(KDC-1044型,科大创新股份有限公司中佳分公司)、电子分析天平(FA2004A型,上海精天)、电热鼓风干燥箱(DHG-9240A型,上海一恒科技有限公司)、紫外分光光度计(UV-9100型,上海光谱仪器有限公司)、数显恒温水浴锅(HH-8型,金坛市晶玻实验仪器厂)、恒温振荡培养箱(HZQ-X100A型,上海一恒科技有限公司)、真空泵、透析袋、超净工作台、培养皿、研钵、接种环、血球计数板、涂布器、移液枪、移液管、容量瓶、烧杯、试管、三角瓶。
1.3 试剂及配制
1.3.1 试剂 邻苯三酚、盐酸、Tris、无水乙醇、乙醚、水杨酸、30%H2O2、FeSO4·7H2O、三氯甲烷、正丁醇、DPPH、NaOH、NaCl、HCl均为分析醇,无菌生理盐水、蒸馏水等。
1.3.2 试剂的配制 (1)0.1 μmol·L-1的DPPH溶液的配制:用电子天枰称量1.81 mgDPPH,在25 mL容量瓶中用无水乙醇定容。取10 mL定容后的液体再用无水乙醇将其稀释2倍,可得到0.1 μmol·L-1的DPPH(避光保存)。(2)Tris-HCl缓冲液的配制:先用移液枪量取2.1 mL浓盐酸,加蒸馏水定容至250 mL得到0.1 mol·L-1HCl溶液,再用电子天枰称取三羟甲基氨基甲烷3.0285 g,加蒸馏水溶解,再向该液体中加入114.5 mL 0.1 mol·L-1HCl溶液,用蒸馏水定容至500 mL,得到pH=8.2,浓度为50 mmol·L-1的Tris-HCl缓冲液。(3)25 mmol·L-1邻苯三酚溶液的配制:用电子天枰称取0.315 g邻苯三酚,定容至100 mL。(4)8 mmol·L-1HCl溶液的配制:用移液枪量取0.067 mL浓盐酸,定容至100 mL。(5)6 mmol·L-1Fe2+的配制:用电子天枰称取FeSO4·7H2O 0.0167 g,用蒸馏水定容至100 mL。(6)6 mmol·L-1水杨酸-乙醇的配制:用电子天枰称取水杨酸1 g,用无水乙醇45mL溶解。(7)6 mmol·L-1H2O2溶液的配制:用移液枪量取浓度为30% H2O20.3 mL,定容至500 mL。
2 试验方法
2.1 高挂草多糖的提取纯化
用研钵将高挂草研磨成粉末备用(不能使用粉碎机,因为高挂草粉末的质量较轻容易飞散浪费材料)。称取16.0 g高挂草粉末,先加入乙醚脱色,乙醚的用量没过高挂草粉末即可。脱色过程中乙醚易挥发适当时再补加入一定量乙醚(乙醚有毒试验时开窗通风保证安全)。脱色后加入80 mL蒸馏水,间歇搅拌,纱布过滤,过滤后的滤液待用,滤渣用同样的方法再重复煮沸3次后,合并滤液。抽提滤液再次除去滤渣得到清澈的提取液。将得到的提取液在放着石棉网的电磁炉上煮沸浓缩至24 mL。用1 mol·L-1NaOH溶液调节提取液的pH至8.0后用H2O2脱色[3]。脱色后的提取液用Sevage法去除杂蛋白(加入等体积的三氯甲烷和正丁醇的混合液,混合液的体积比是三氯甲烷∶正丁醇=4∶1,然后震荡20 min)[4]。再用离心机离心(1 000 rpm,5 min),保留上清液备用。取备用上清液装入MD44透析袋中进行透析,透析的方法是用流动蒸馏水透析72 h。称量透析后的液体体积为45 mL,加入无水乙醇55 mL使乙醇含量达到85%以上,然后放入4℃冰箱中静止12 h,再次用离心机离心(1000 rpm,5 min)留沉淀备用。将所得的沉淀加入少量的无水乙醇(没过沉淀即可)震荡洗涤2次后,用相同的方法分别用丙酮、乙醚再各洗2次。最后将得到的沉淀放入电热鼓风干燥箱干燥,直至呈粉末状,即可得到纯化的高挂草多糖[5]。
2.2 抑菌性试验
2.2.1 菌悬液的配制 选取已经在斜面培养基活性良好的菌种,在无菌超净工作台上,用无菌接种环挑取少量菌种接种到装有液体培养基的小三角瓶中(试验时应在点燃酒精灯的无菌区内进行操作),将接种好的液体培养基在恒温培养箱中震荡培养18 h左右。然后吸取1.0mL菌悬液用无菌生理盐水稀释10、102、103、104、105、106、107、108倍,再用血球计数板在显微镜下计算各稀释液浓度[6]。最后选用105~106CFU·mL-1菌悬液备用。对于霉菌,将无菌生理盐水倒入培养72 h左右的斜面接种试管中振荡,再把液体倒入三角瓶中作为孢子悬液,然后吸取1.0 mL霉菌的孢子悬液,用无菌生理盐水分别稀释至10、102、103、104、105、106、107、108倍,然后用血球计数板法计算各菌悬液的浓度[7],最后同样选用浓度为105~106CFU·mL-1的孢子稀释液备用。
2.2.2 抑菌圈的测定 采用滤纸片扩散法测定其抑菌性[8],将提取纯化的多糖溶于蒸馏水中,配制其浓度为5.00 mg·mL-1。取用直径9 mm的圆形滤纸片置于5.00 mg·mL-1高挂草多糖浸泡并将其灭菌,在超净工作台中将0.1 mL各种菌悬液置于已经凝固的平板培养基上(细菌用LB培养基,真菌用PDA培养基),用无菌的涂布器涂均匀。用镊子夹取浸泡的滤纸片,在沥去多余的糖液,将3个滤纸片按呈品字状贴于平板培养基中。在恒温培养箱中37℃静止培养24 h后,用卡尺测定抑菌圈直径。每种供试菌设三个平行组取其平均值。
2.2.3 最小抑菌浓度(MIC)的测定 采用二倍稀释法[9],将高挂草多糖母液稀释成5.00 mg·mL-1、2.50 mg·mL-1、1.25 mg·mL-1、0.625 mg·mL-1、0.3125 mg·mL-1、0.1563 mg·mL-1、0.0781 mg·mL-1、0.0391 mg·mL-1、0.0195 mg·mL-1、0.0098 mg·mL-1、0.0049 mg·mL-1各种浓度的多糖溶液。用无菌的移液枪分别移取1.0 mL不同浓度稀释液,与14.0 mL冷却至45 ℃的琼脂培养基混合均匀,置于无菌平皿中冷凝备用。再取1.0 mL的蒸馏水用同样的方法作为对空白照组。然后用接种环分别蘸取各供试菌105~106CFU·mL-1菌悬液,接种于各平板的不同区域。
在恒温培养箱中37 ℃培养24 h,以不长菌培养基的最低浓度作为各菌的最小抑菌浓度[10](霉菌28 ℃培养24 h)。
所谓的喷灌技术主要是通过专门设备把水通过压力管道输送到田间,然后喷射到空中,达到灌溉的目的。这种喷灌技术对于土壤和地形使用性强,但是容易受到风力的影响。
2.3 抗氧化性试验
2.3.1 对DPPH·清除能力的测定 用移液枪分别取浓度0.2 mg·mL-1,0.4 mg·mL-1,0.6 mg·mL-1,0.8 mg·mL-1高挂草多糖溶液各2.0 mL于试管中,再分别加入4.0 mL0.1 μmol/L的DPPH溶液。在黑暗中放置20 min后,以85%乙醇溶液为空白,在517 nm处测吸光度值,做三次平行实验取其平均值。再分别取浓度0.2 mg·mL-1,0.4 mg·mL-1,0.6 mg·mL-1,0.8 mg·mL-1高挂草多糖溶液各2.0 mL于试管,分别加入4.0 mL的85%乙醇溶液,在黑暗中放置20 min,以85%乙醇溶液为空白,在517 nm处测吸光度值,做三次平行试验取其平均值。最后取4.0 mL 0.1 μmol/L的DPPH溶液加0.2 mL 85%乙醇溶液在相同条件下测吸光度值,做三次平行实验取其平均值。
将测得的结果代入下式计算清除率(P):
P(%)=(1-Ai-AjA0)×100%
公式1
式中A0为4.0 mL 0.1 μmol/L的DPPH溶液加0.2 mL 85%乙醇溶液所测吸光度的平均值;Ai分别为0.2 mg·mL-1、0.4 mg·mL-1、0.6 mg·mL-1、0.8 mg·mL-1高挂草多糖溶液加4.0 mL 0.1 μmol/L的DPPH溶液所测吸光度的平均值;Aj分别为0.2 mg·mL-1、0.4 mg·mL-1、0.6 mg·mL-1、0.8 mg·mL-1多糖溶液加4.0 mL85%乙醇溶液所测吸光度的平均值;P为清除率。
2.3.2 对O2-清除能力的测定 用移液管量取4.5 mL 50 mmol·L-1Tris-HCl 缓冲液(pH=8.2)于4支试管中,置于25 ℃水浴锅中预热20 min,分别向4支加入1.0 mL浓度为0.2 mg·mL-1,0.4 mg·mL-1,0.6 mg·mL-1,0.8 mg·mL-1的高挂草多糖溶液和0.4 mL 25 mmol·L-1邻苯三酚溶液,混合后在25 ℃水浴锅中反应5 min,立即加入8 mmol·L-1HCl 1.0 mL终止反应后,于470 nm处测吸光度值,取1.0 mL蒸馏水用相同的方法做空白对照,做三次平行试验取其平均值。再取一支试管加4.5 mL 50 mmol·L-1Tris-HCl缓冲液(pH=8.2)于25 ℃水浴锅中预热20 min,加1.4 mL 25 mmol·L-1邻苯三酚溶液,混合后25 ℃水浴中反应5 min。立即加入8 mmol·L-1HCL 1.0 mL终止反应,于470 nm处测吸光度值。取用相同体积蒸馏水的方法做空白对照,做三次平行试验取其平均值。
将测得的结果代入下式计算清除率(P):
P(%)=(A0-AiA0)×100%
公式2
2.3.3 对·OH清除能力的测定 先取5支试管分别加入浓度为6 mmol·L-1Fe2+1.0 mL和6 mmol·L-1水杨酸-乙醇溶液1.0 mL,再向5支试管中分别加入1.0 mL浓度为0.2 mg·mL-1,0.4 mg·mL-1,0.6 mg·mL-1,0.8 mg·mL-1的高挂草多糖溶液,加蒸馏水2.0 mL,再分别加入6 mmol·L-1H2O21.0 mL,10 min后以蒸馏流水为参比。在510 nm处测吸光度值,做三次平行试验取其平均值。再向一支试管中分别加入浓度为6 mmol·L-1Fe2+1.0 mL和6 mmol·L-1水杨酸-乙醇溶液1.0 mL,加蒸馏水2.0 mL,分别加入6 mmol·L-1H2O21.0 mL,10 min后以蒸馏流水为参比。在510 nm处测吸光度值,做三次平行试验取平均值。
将所得结果代入下式计算清除率(P):
P(%)=(A0-AiA0)×100%
公式3
式中A0为6 mmol·L-1Fe2+1 mL和6 mmol·L-1水杨酸-乙醇溶液和6 mmol·L-1H2O2溶液的吸光度平均值;Ai分别为0.2mg·mL-1,0.4 mg·mL-1,0.6 mg·mL-1,0.8 mg·mL-1的高挂草多糖溶液和6 mmol·L-1Fe2+1.0 mL和6 mmol·L-1水杨酸-乙醇溶液的吸光度平均值,P为清除率。
3 结果与讨论
3.1 抑菌性试验结果
3.1.1 抑菌圈结果 按2.2.2方法可得结果如表1所示。

表1 高挂草多糖溶液抑菌圈直径(n=3)
由表1可知,在相同条件下,高挂草多糖对大肠杆菌、枯草杆菌抑制效果明显,抑制效果基本相同;对酵母菌、对黑曲霉、根霉有一定的抑制作用。由此可知,在相同条件下,高挂草多糖对细菌的抑菌效果比真菌的抑菌效果好。
3.1.2 最小抑菌浓度(MIC)的测定结果 按2.2.3方法可得结果如表2所示。
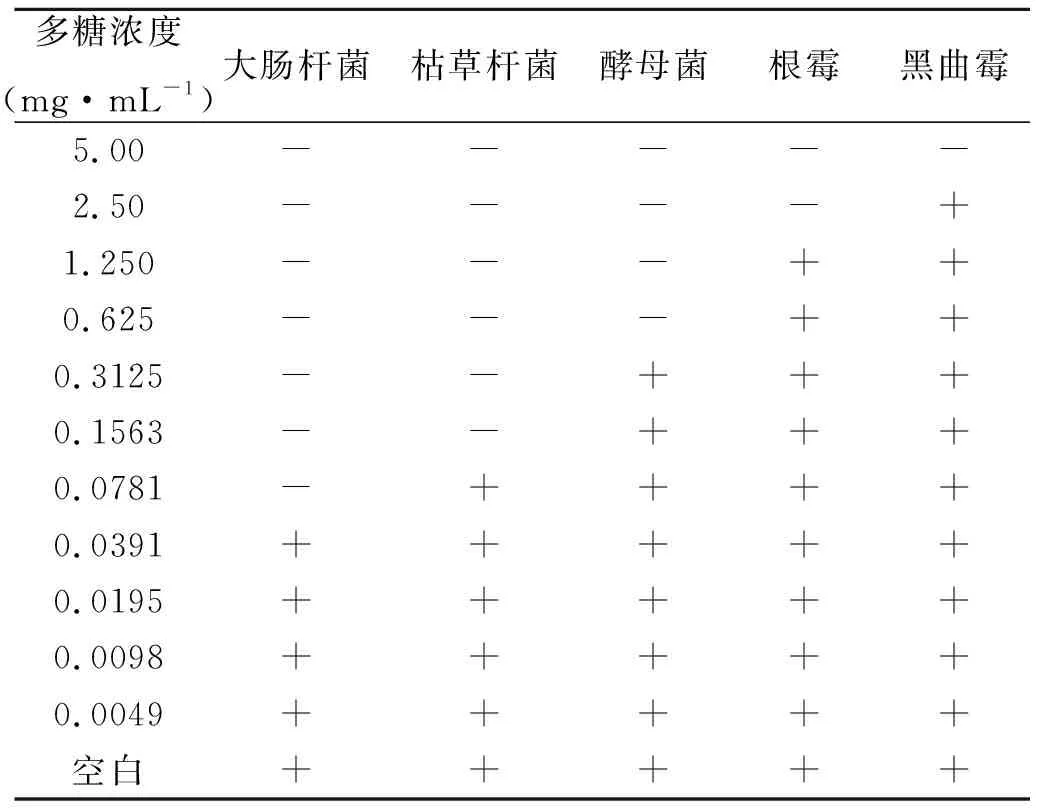
表2 最小抑菌浓度(MIC)的测定结果
注:“+”为平板长菌,“-”为平板未长菌
由表2可知,在相同的条件下,当高挂草多糖浓度为0.0 781 mg·mL-1时含有大肠杆菌的培养基中不长菌,所以高挂草对大肠杆菌的最小抑菌浓度为0.0 781 mg·mL-1;同样在高挂草多糖浓度为0.1 563 mg·mL-1时含有枯草杆菌的培养基中不长菌,所以高挂草对枯草杆菌的最小抑菌浓度为0.1 563 mg·mL-1;当高挂草多糖浓度为0.625 mg·mL-1时含有酵母菌的培养基中不长菌,所以高挂草对酵母菌的最小抑菌浓度为0.625 mg·mL-1;当高挂草多糖浓度为2.50 mg·mL-1时含有根霉的培养基中不长菌,所以高挂草对根霉的最小抑菌浓度为2.50 mg·mL-1;当高挂草多糖浓度为5.00 mg·mL-1时含有黑曲霉的培养基中不长菌,所以高挂草对黑曲霉的最小抑菌浓度为5.00 mg·mL-1。该结果与高挂草多糖的抑菌圈测试结果相吻合。
3.2 抗氧化性试验结果
3.2.1 对DPPH·清除能力的测定结果 按2.3.1的方法得到高挂草多糖对DPPH·清除能力结果如图1所示。

图1 高挂草多糖对DPPH·清除能力结果
由图1可以看出,高挂草多糖对DPPH·的清除能力较好,在相同的条件下,不同浓度的高挂草多糖对DPPH·的清除能力不同;当高挂草多糖的浓度是0.2 mg·mL-1时清除率为12.51%,当多糖浓度达到0.8 mg·mL-1时清除率为19.84%。因此多糖对DPPH·有一定的清除能力,且随着多糖浓度的增加对DPPH·的清除能力也增大。
3.2.2 对O2-清除能力的测定结果 按2.3.2中的方法可得到高挂草多糖对O2-清除能力结果如图2所示。

图2 高挂草多糖对O2-清除能力结果
由图2可以看出,高挂草多糖对O2-的清除能力较好,在相同的条件下,不同浓度的多糖对O2-的清除能力不同;当高挂草多糖的浓度是0.2 mg·mL-1时清除率为12.41%,当多糖浓度达到0.8 mg·mL-1时清除率为23.36%。因此多糖对O2-有一定的清除能力,且随着多糖浓度的增加对O2-的清除能力也增大。
3.2.3 对·OH清除能力的测定结果 按2.3.3中的方法可得到高挂草多糖对·OH清除能力结果如图3所示。
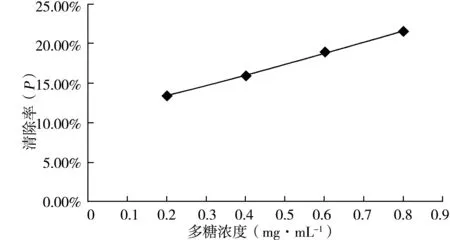
图3 高挂草多糖对·OH清除能力结果
由图3可以看出,高挂草多糖对·OH的清除能力较好,在相同的条件下,不同浓度的多糖对·OH的清除能力不同;当高挂草多糖的浓度为0.2 mg·mL-1时清除率为13.59%,当高挂草多糖浓度是0.8mg·mL-1时清除率为21.51%。故高挂草多糖对·OH有一定的清除能力,且随着高挂草多糖浓度的增加对·OH的清除能力也增大。
4 结 论
本文用热水浸提法对高挂草中多糖进行提取,利用水提醇沉法纯化高挂草多糖,并研究其抑菌性和抗氧化性。抑菌试验中,高挂草多糖对大肠杆菌、枯草杆菌、酵母菌有较好的抑制效果,对根霉、黑曲霉有一定的抑制作用;最小抑菌浓度(MIC)的测定试验中,高挂草多糖对大肠杆菌、枯草杆菌、酵母菌、根霉、黑曲霉的最低抑菌浓度分别为0.0 781 mg·mL-1、0.1 563 mg·mL-1、0.625 mg·mL-1、2.50 mg·mL-1、5.00 mg·mL-1,该结果与抑菌圈的测试结果相吻合。抗氧化试验中高挂草多糖对DPPH·、O2-、·OH均有较好的清除能力,且清除率均随着多糖浓度增大而增大。以上试验结果表明:高挂草多糖具有较好的抑菌效果(细菌>酵母菌>霉菌)和明显的抗氧化作用,具有很强的生物活性。我国高挂草分布广泛、资源丰富,开发潜力巨大。本试验能够为高挂草资源的开发利用提供很好的理论基础。
