超声法与酶切法随机打断基因组方法的比较
2019-01-11王阔鹏于凌娇刘麒刘倩宏
李 莹,王阔鹏,于凌娇,刘麒,刘倩宏
1 材料与方法
1.1 试验材料
1.1.1 试验材料及仪器 马耳他布鲁菌16M株(标准热灭活)、NEB公司基因组提取试剂盒、琼脂糖、异丙醇、70%乙醇、0.2%溴酚蓝、50%蔗糖上样缓冲液、电泳缓冲液、1 mg/mL溴化乙锭溶液(EB)、10×酶切缓冲液、Sau 3AI限制性内切酶(NEB公司)。超声波细胞破碎仪(新芝SCIENTZ-IID型)、电泳仪、凝胶成像仪、高速离心机、超低温冰箱、高压灭菌锅、水浴锅、稳压电泳仪、电泳槽、紫外检测仪、EP管、离心管、微量移液器、量筒、烧杯、锥形瓶、吸嘴、剪刀、镊子、塑料手套等。
1.1.2 试剂配制 氨苄青霉素(Ampicillin)配置(浓度100 mg/mL):称取5 gAmp,在50mL离心管加入称好的Amp,并加入40 mL无菌水,使其充分混合溶解之后,定容到50 mL。采用规格为0.22 μm的滤膜过滤除菌,再分装成小份(约1 mL/管),在-20 ℃中保存。无菌水的制备:量取50 mL重整水,在100 mL三角瓶中加入称量好的重整水,高压灭菌20 min后,用高压灭菌后的EP管分装,-20℃保存备用。
1.2 试验方法
1.2.1 基因组提取 用NEB公司基因组提取试剂盒提取马耳他布鲁菌16M株基因组,具体按试剂盒操作,用1%琼脂糖凝胶电泳检测基因组提取结果[1-5]。
1.2.2 软件DNAMAN分析基因组 用DNAMAN分析16M株基因组序列,识别Sau3AI酶切位点,预测该酶可能的酶切片段大小[6]。
1.2.3 Sau3AI酶切基因组 根据Sau3AI酶的使用说明书,进行如下操作:
(1)在0.5mLEP管中,建立基因组DNA酶解的混合体系;并将混合物置于55 ℃水浴中,水浴15 min,使基因组DNA片段被分散。
10×Sau3AI缓冲液 5 μL
提取的基因组DNA 20 μL(25-60 μg)
无菌重整水 75 μL
共100 μL。
(2)将(1)中液体分装在5个Ep管中(Ep管需要标记数字1、2、3、4、5,便于区分),其中1管为30 μL,2管-4管各为20 μL,5管为10 μL。5个Ep管冰浴放置。
(3)根据3-10 U/μgDNA的量,加入Sau3AI酶于1管,轻轻弹动管壁,利于二者混匀,短暂离心2s后,收集反应物,并在冰上放置。
(4)用微量移液器在1管中吸取10 μL液体放入到2管中,立刻混匀,混匀后放置在冰上。
(5)梯度稀释。在2管中,用移液器取10 μL液体到3管,在3管中取10 μL液体至4管,4管10 μL液体到5管。注意:连续稀释后,每管体积都是20 μL。
(6)在37 ℃时,保温20 min,然后在68 ℃水浴锅中水浴5-8 min,使Sau3AI内切酶失活,在冰上放置。
(7)在各酶解产物管中分别取4 μL,进行琼脂糖凝胶电泳检测,大约电泳5-16 h,判断酶解产物的大小范围[7]。
1.2.4 超声裂解法打断基因组 利用超声波细胞破碎仪(新芝SCIENTZ-IID型)随机打断布鲁菌基因组[8-9]。超声条件设定见表1。

表1 超声组别
1.2.5 1%琼脂糖凝胶电泳检测 利用电泳检测两种方法随机打断基因组情况。
(1)制备1%琼脂糖凝胶:称取0.5 g琼脂糖,放在锥形瓶中,加一倍浓度的电泳缓冲液(1X电泳缓冲液),轻轻晃动几下,用微波炉加热,使融化均匀。加热之前,锥形瓶口要密封,减少在加热过程中水分的蒸发。
(2)制备胶板:把胶槽放到制胶板上,插上梳子,注意梳子齿末端与胶槽底部保留大约1 mm距离。等到凝胶溶液冷却到50 ℃时,加浓度为0.5 μL/mL的EB,轻轻地摇匀,慢慢将其倒入到制胶板中,要注意消灭气泡。等到凝胶冷却凝固后,将梳子拔出。将凝胶放入到电泳槽内,加1X电泳缓冲液,使缓冲液液面比琼脂糖凝胶面高一点点。
(3)加样:把样品DNA和样品缓冲液混合在点样板上,用10 μL微量移液器取样加在样品槽中,每次加样都要更换枪头,防止污染,影响结构。加样时要小心谨慎,勿触碰样品孔周围,记住加样顺序、加样量。注意:样品缓冲液不小于1X。
(4)电泳:加样后,应立刻通电进行电泳。样品从黑色负电极移动至红色正电极。当溴酚蓝移至距离胶板下缘1 cm处时,停止电泳。
(5)拍照观察:电泳后取出凝胶。在波长为254 nm的紫外线下,观察电泳胶板。可以看到在DNA存在的位置,有橘红色条带。用凝胶成像系统拍照并保存。
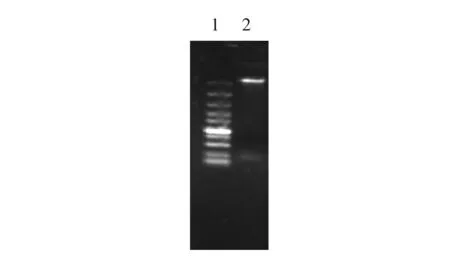
图1 布鲁菌基因组1.Marker从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2.马尔他布鲁菌16M株DNA提取结果
2 试验结果
2.1 马耳他布鲁菌16M基因组提取结果
用NEB公司基因组提取试剂盒提取布鲁菌16M基因组,用琼脂糖凝胶电泳进行检测分析,结果见图1。结果显示提取基因组成功,且DNA提取浓度较高;经OD260/280分析,基因组纯度也达到要求。
2.2 软件分析结果
Sau3AI 识别酶切位点为GATC。软件预测布鲁菌16M株基因组(NC_003317.1) 经Sau3AI酶切图谱如图2。结果表明布鲁菌16M株基因组上有Sau3AI酶的酶切位点,且经酶切后得到的线性DNA片段大小分别为30 bp,42 bp,120 bp, 127 bp,267 bp,503 bp;得到的环形DNA片段大小分别为30 bp,42 bp,120 bp,127 bp,770 bp。
酶切后得到线性DNA片段为30 bp,42bp,120bp,127bp,267bp,503bp;得到的环形DNA为30 bp,42 bp,120 bp,127 bp,770 bp。

图2 Sau3AI酶切位点图
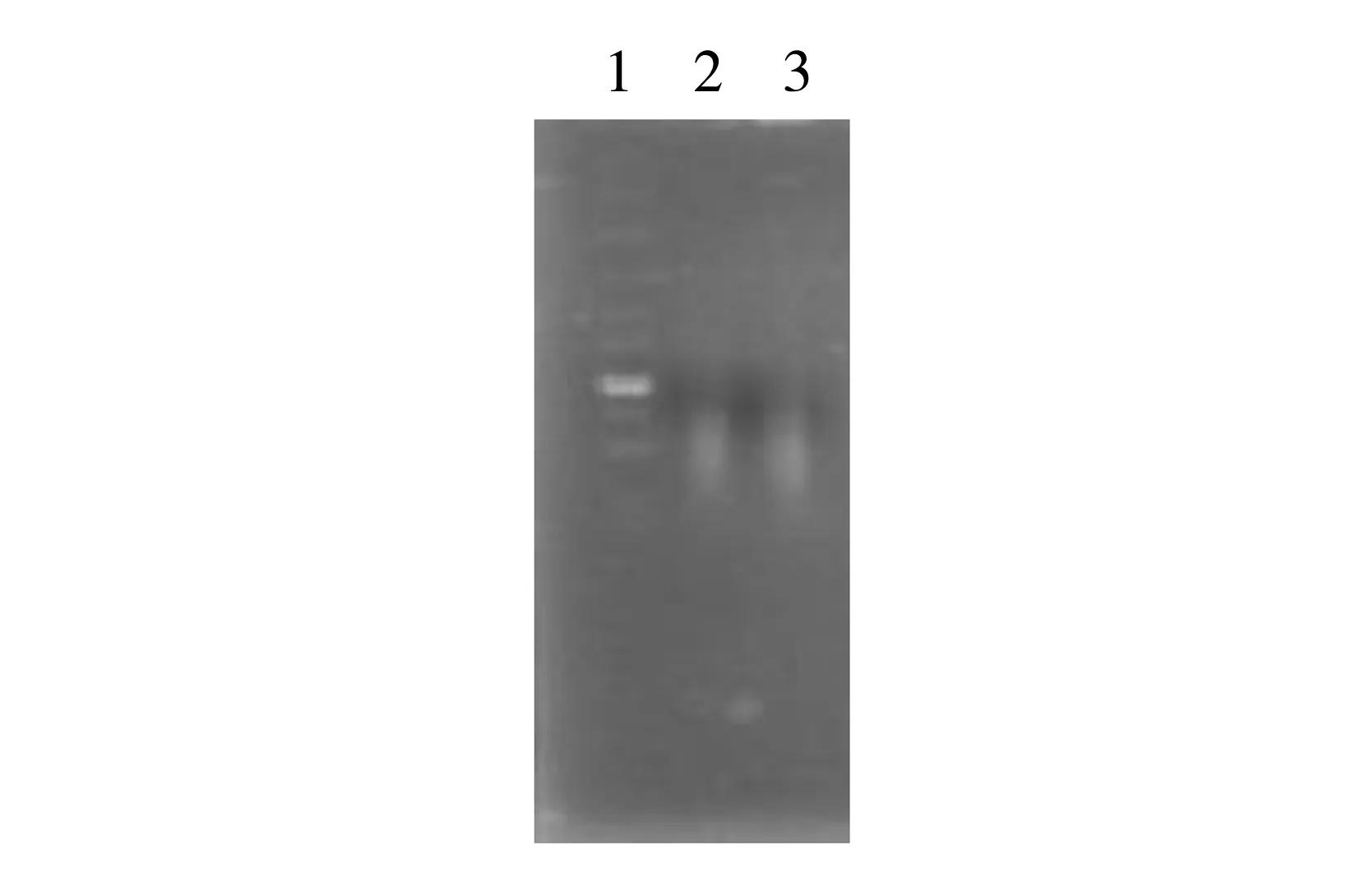
图3 酶切法打断基因组1.Marker 从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2-3.Sau3AI酶切基因组结果
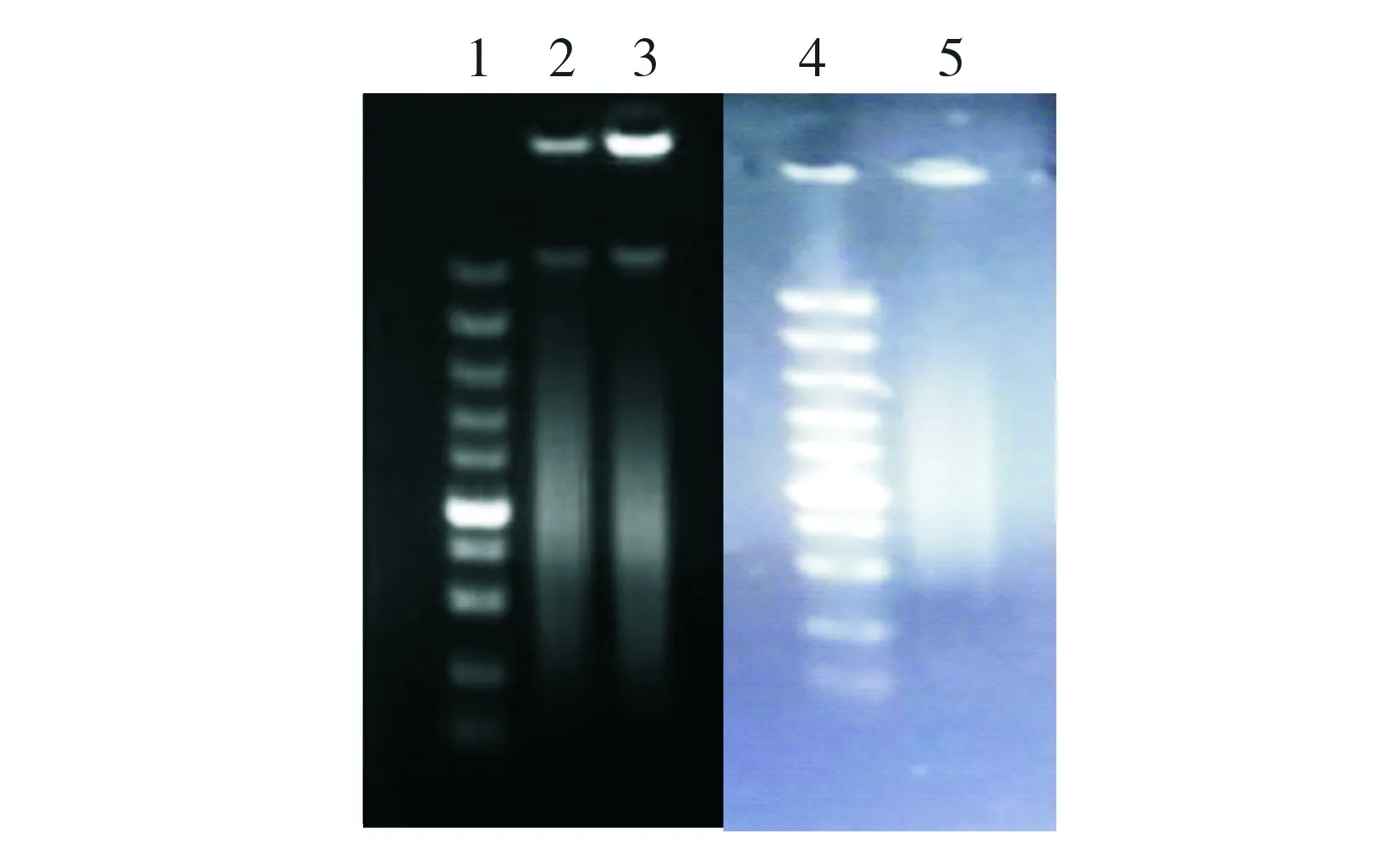
图4 超声法打断基因组1.Marker 从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2.超声30下;3超声20下;4.Marker;5.超声10下
2.3 酶切法随机打断基因组结果
Sau3AI酶切马耳他布鲁菌16M株基因组,用琼脂糖凝胶电泳检测分析,结果见图3。结果表明酶切的基因片段比较小,并且分布均匀。
2.4 超声法随机打断基因组结果
采用3组不同超声裂解条件,对16M株基因组随机打断,进行琼脂糖凝胶电泳,结果见图4。结果表明输出功率50% ,超声3s,间隔3s,超声次数为10下,效果最好。
2.5 基因组打断效果检测分析
本试验的目的是为了建立布鲁菌基因组随机文库,通过用Sau3AI酶切和超声破碎基因组,得到想要的基因片段,为后续试验做准备。所需基因片段大小约为200-3 000 bp之间,片段均匀,大小适中。而通过电泳检测可知,酶法得到的基因片段大多数都是小片段,超声法得到的片段为一条抹带,范围在200-3 000 bp,符合后续试验需要。
3 分析与讨论
利用超声法处理基因组具有设备简单,操作方便,样品损失少,处理速度快,有利于分离纯化,具有良好的通透性,易于实现连续化、自动化,样品处理量大,成本低,转化率高等优点。酶法显著的特点是专一性强,样品处理速度快,比较温和,并且能够更好的保留DNA完整性以及蛋白质的抗原表位。
超声法对DNA的打断是随机的,且实验重复性较高。对于那些与DNA结合不紧密的蛋白或低丰度表达的蛋白,如调控因子、转录因子等通常需要用交联试剂固定样本(细胞或组织)以稳定蛋白质和DNA的形态,这种情况最好用超声法。如果样本无需交联,例如研究对象是与DNA结合紧密的蛋白或高丰度表达的蛋白,那么便可以使用酶法。但酶切法得到的DNA片段相对较短,不适合染色质免疫共沉淀技术及与芯片方法的结合(CHIP-Chip)实验和染色质免疫沉淀测序(CHIP-Seq)实验。
研究拟利用随机打断的基因组DNA片段构建布鲁菌16M株随机文库,基因组DNA片段的质量(包括片段的浓度、大小等)直接决定构建文库的多样性及随机性。因此,本研究比较了酶切法和超声法对基因组DNA的随机打断效率,并对超声法裂解基因组DNA进行了条件优化,为后续随机文库构建你奠定基础。
4 结 论
试验通过比较超声法和酶切法随机打断布鲁菌16M株基因组效果,为后续建库奠定基础。结果表明,超声法(输出功率50% ,超声3 s,间隔3 s,超声次数10下)效果更好。
